Vaardigheden om te ontwikkelen
- Om te beschrijven hoe elektronen binnen atomen gegroepeerd zijn.
Hoewel we de algemene rangschikking van subatomaire deeltjes in atomen besproken hebben, hebben we weinig gezegd over hoe elektronen de ruimte rond de atoomkern innemen. Bewegen ze willekeurig rond de kern, of bestaan ze in een geordende ordening?
De moderne theorie over het gedrag van elektronen wordt kwantummechanica genoemd. Zij doet de volgende uitspraken over elektronen in atomen:
- Elektronen in atomen kunnen slechts bepaalde specifieke energieën hebben. We zeggen dat de energieën van de elektronen gekwantiseerd zijn.
- Elektronen zijn volgens hun energie geordend in groepen die schillen worden genoemd. In het algemeen geldt dat hoe hoger de energie van een schil is, hoe verder deze (gemiddeld) van de kern verwijderd is. Schillen hebben geen specifieke, vaste afstanden tot de kern, maar een elektron in een schil met een hogere energie zal meer tijd ver van de kern doorbrengen dan een elektron in een schil met een lagere energie.
- Schelpen zijn verder onderverdeeld in subsets van elektronen die subschelpen worden genoemd. De eerste schil heeft slechts één subshell, de tweede schil heeft twee subshells, de derde schil heeft drie subshells, enzovoort. De subschillen van elke schil worden in volgorde aangeduid met de letters s, p, d en f. Zo heeft de eerste schil alleen een s-subschil, de tweede schil een s- en een p-subschil, de derde schil s-, p- en d-subschalen, enzovoort.
- Verschillende subschillen bevatten een verschillend maximumaantal elektronen. Een s-subschil kan maximaal 2 elektronen bevatten; p-supschil maximaal 6 elektronen; d-subschil maximaal 10; en f-subschil maximaal 14.
Het is de ordening van elektronen in schillen die het meeste effect heeft op chemische eigenschappen, dus zullen we ons hier voornamelijk richten op schillen.
We gebruiken getallen om aan te geven in welke schil een elektron zich bevindt. De eerste schil, het dichtst bij de kern en met de elektronen met de laagste energie, is schil 1. Deze eerste schil heeft slechts één subshell (aangeduid met 1s) en kan maximaal 2 elektronen bevatten. Daarom zijn er twee elementen in de eerste rij van het periodiek systeem (H & He).
Omdat de eerste schil slechts maximaal 2 elektronen kan bevatten, moet het derde elektron in de tweede schil gaan zitten. Daarom zal lithium (Li), dat in totaal drie elektronen heeft, twee elektronen in de eerste schil hebben en één elektron in de tweede schil. Merk op dat lithium het eerste element is in de tweede rij van het periodiek systeem.
De tweede schil heeft twee subschillen (aangeduid met 2s en 2p). De 2s-subschil bevat maximaal 2 elektronen, en de 2p-subschil bevat maximaal 6 elektronen. Dit betekent dat de tweede schil maximaal acht elektronen kan bevatten (2+6=8). Merk op dat er acht elementen zijn in de tweede rij van het periodiek systeem.
Alleen de elektronen in de buitenste schil, de zogenaamde VALENCE-schil, hebben de neiging te reageren (gewonnen, verloren of gedeeld worden). Je zou je kunnen voorstellen dat, als twee atomen tegen elkaar botsen, het de buitenste elektronen zijn die het eerst op elkaar reageren. Hieronder volgt een lijst van totale elektronen, elektronen per schil, en valentie-elektronen voor de eerste 10 elementen.
- Hydrogeen heeft 1 elektron in de eerste schil (dus 1 valentie-elektron).
- Helium heeft 2 elektronen — beide in de eerste schil (dus 2 valentie-elektronen).
- Lithium heeft 3 elektronen — 2 in de eerste schil, en 1 in de tweede schil (dus één valentie-elektron).
- Beryllim heeft 4 elektronen — 2 in de eerste schil, en 2 in de tweede schil (dus twee valentie-elektronen).
- Boron heeft 5 elektronen — 2 in de eerste schil, en 3 in de tweede schil (dus drie valentie-elektronen).
- Koolstof heeft 6 elektronen — 2 in de eerste schil, en 4 in de tweede schil (dus vier valentie-elektronen).
- Stikstof heeft 7 elektronen — 2 in de eerste schil, en 5 in de tweede schil (dus vijf valentie-elektronen).
- Zuurstof heeft 8 elektronen — 2 in de eerste schil, en 6 in de tweede schil (dus zes valentie-elektronen).
- Fluor heeft 9 elektronen — 2 in de eerste schil, en 7 in de tweede schil (dus zeven valentie-elektronen).
- Neon heeft 10 elektronen — 2 in de eerste schil, en 8 in de tweede schil (dus acht valentie-elektronen).
Figuur 2.6.1 hieronder geeft het atoomnummer voor de elementen van de hoofdgroep. Het atoomnummer bepaalt het aantal protonen in de kern van elk atoom. Voor neutrale atomen zal het aantal positieve protonen gelijk zijn aan het totale aantal negatieve elektronen (netto lading nul). Bijvoorbeeld, broom (Br) heeft 35 protonen en 35 totale elektronen. Periodieke tabellen vermelden altijd het atoomnummer.

Figuur 2.6.1 – Atoomnummer voor elk van de hoofdgroepelementen
Het aantal valentie-elektronen voor elk hoofdgroepelement kan worden bepaald aan de hand van de kolom, of groep, die het element in het periodiek systeem inneemt. Tabel 2.6.2 hieronder geeft een overzicht van het aantal valentie-elektronen voor elke hoofdgroep kolom van elementen. Bijvoorbeeld, de elementen in de eerste kolom (soms aangeduid met IA), hebben allemaal één valentie-elektron. De tweede kolom (IIA) heeft twee valentie-elektronen. Het korte blok van tien elementen in het midden slaan we over, omdat hier een subschil uit de orde wordt gevuld. De elementen in de kolommen IIIA, IVA, VA, VIA, en VIIA, en VIIIA* hebben respectievelijk drie, vier, vijf, zes, zeven, en acht* valentie-elektronen.
* Merk op dat helium (He) slechts twee valentie-elektronen heeft. Sommige periodieke tabellen plaatsen helium in kolom IIA, andere in VIIIA, en weer andere op beide plaatsen.
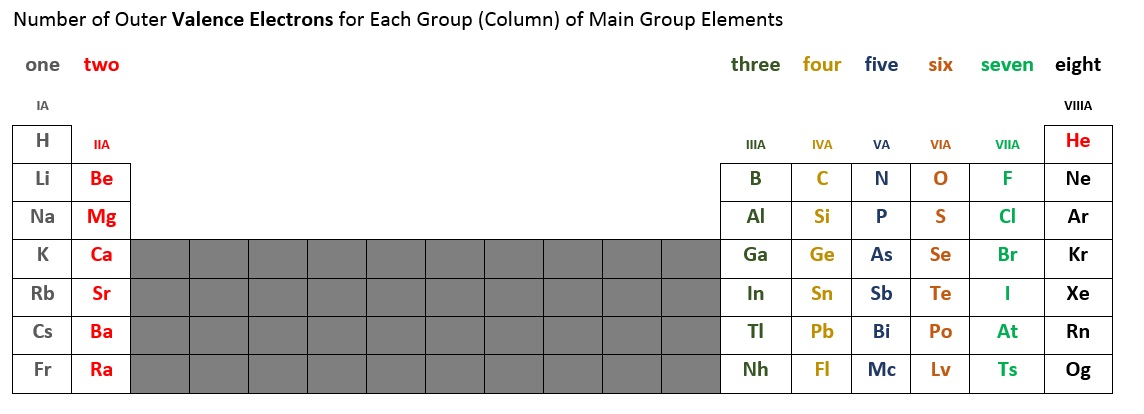
Figuur 2.6.2 – Aantal valentie-elektronen voor elementen uit de hoofdgroep
voorbeeld (Pagina-index{1}): Elektronen van fosforatomen
Hoeveel totale en valentie-elektronen zitten er in een neutraal fosforatoom?
Oplossing
Een neutraal fosforatoom heeft 15 totale elektronen. Twee elektronen kunnen in de eerste schil, acht in de tweede schil, en hij heeft er nog vijf in de derde schil. De derde schil is de buitenste valentieschil, dus heeft het 5 valentie-elektronen.
Het aantal elektronen in elke schil wordt ingewikkelder naarmate er meer elektronen worden toegevoegd, omdat er meer subschillen worden gebruikt en omdat de schillen zich in een andere volgorde beginnen te vullen. Voor elementen met een groter atoomnummer dan 20 (verder dan calcium) zullen we ons alleen concentreren op het totale aantal en het aantal valentie-elektronen, niet op het aantal in elke schil. We hebben gezegd dat de elektronen in de buitenste schil valentie-elektronen worden genoemd. De binnenste (niet-valentie) schillen en elektronen worden vaak de kern genoemd.
Voorbeeld: Tellen van totale en valentie-elektronen in xenonatomen
Hoeveel totale, valentie- en kernelektronen zitten er in een neutraal xenonatoom?
Oplossing
Xenon heeft 54 totale, 8 valentie- en 46 kernelektronen.
Oefeningen voor begripsherziening
- Hoe zijn elektronen in atomen georganiseerd?
- Wat is het maximale aantal elektronen dat in de eerste twee schillen van een atoom past?
- Wat is het verschil tussen kernelektronen en valentie-elektronen?
Antwoorden
- Elektronen zijn georganiseerd in schillen en subschillen rond kernen.
- In de eerste schil passen maximaal twee en in de tweede schil maximaal acht elektronen.
- Valence-elektronen zitten in de hoogst genummerde (buitenste) schil; alle andere elektronen zijn kernelektronen.
Key Takeaway
- Elektronen zijn georganiseerd in schillen en subschillen rond de kern van een atoom.
Bijdragers
-
Anoniem