Basiciteit van heterocyclische amines
Wanneer een stikstofatoom direct in een aromatische ring wordt opgenomen, hangt de basiciteit af van de bindingscontext. In een pyridine ring, bijvoorbeeld, bezet het eenzame stikstofpaar een sp2-hybride orbitaal, en maakt geen deel uit van het aromatische sextet – het is in wezen een imine stikstof. Het elektronenpaar is beschikbaar voor de vorming van een binding met een proton, en dus is het pyridine-stikstofatoom enigszins basisch.

In een pyrrol-ring daarentegen maakt het stikstof-nevenpaar deel uit van het aromatische sextet. Dit betekent dat deze elektronen zeer stabiel zijn op de plaats waar ze zich bevinden (in het aromatische systeem), en veel minder beschikbaar zijn voor binding aan een proton (en als ze toch een proton oppikken, wordt het aromatische systeem vernietigd). Om deze redenen zijn pyrroolnitrogenen niet sterk basisch.

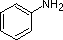
De voorbeelden aniline, pyridine en pyrrool zijn goede modellen voor het voorspellen van de reactiviteit van stikstofatomen in complexere ringsystemen (waarvan er in de natuur een enorme verscheidenheid wordt gevonden). De tryptofaanzijketen bevat bijvoorbeeld een niet-basische ‘pyrrolachtige’ stikstof, terwijl adenine (een DNA/RNA-basis) alle drie de typen bevat.


De eenpaar elektronen op de stikstof van een nitril bevinden zich in een sp-hybride orbitaal. Het 50% s-karakter van een sp-hybride orbitaal betekent dat de elektronen dicht bij de kern zijn en daarom niet significant basisch zijn.
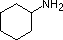
Een overzicht van de basisbegrippen zuur-base kan nuttig zijn voor de volgende discussie. Net als ammoniak zijn de meeste amines Brønsted en Lewis basen, maar hun basische sterkte kan enorm worden veranderd door substituenten. Het is gebruikelijk basen kwantitatief te vergelijken door de pKa’s van hun geconjugeerde zuren te gebruiken in plaats van hun pKb’s. Aangezien pKa + pKb = 14, hoe hoger de pKa hoe sterker de base, in tegenstelling tot de gebruikelijke omgekeerde relatie van pKa met zuurtegraad. De meeste eenvoudige alkylaminen hebben pKa’s in het bereik van 9,5 tot 11,0, en hun wateroplossingen zijn basisch (hebben een pH van 11 tot 12, afhankelijk van de concentratie). De eerste vier verbindingen in de volgende tabel, met inbegrip van ammoniak, vallen in die categorie.
De laatste vijf verbindingen (gekleurde cellen) zijn beduidend zwakkere basen als gevolg van drie factoren. De eerste daarvan is de hybridisatie van de stikstof. In pyridine is de stikstof sp2 gehybridiseerd, en in nitrillen (laatste stof) maakt een sp-hybride stikstof deel uit van de drievoudige binding. In elk van deze verbindingen (rood gearceerd) is het niet-bindende elektronenpaar gelokaliseerd op het stikstofatoom, maar toenemend s-karakter brengt het dichter bij de stikstofkern, waardoor het minder geneigd is zich te binden aan een proton.
|
Samenstelling |
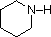 |
 |
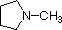 |
NH3 |  |
 |
 |
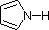 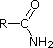 |
CH3C≡N | |
|---|---|---|---|---|---|---|---|---|---|---|
| pKa | 11.0 | 10.7 | 10.7 | 9.3 | 5.2 | 4.6 | 1.0 | 0.0 | -1.0 | -10. |
Basiciteit van gewone aminen (pKa van de geconjugeerde ammoniumionen)
Ten slotte weerspiegelt de zeer lage basiciteit van pyrrol (blauw gearceerd) de uitzonderlijke delokalisatie van het stikstof-elektronenpaar dat gepaard gaat met de opname ervan in een aromatische ring. Indool (pKa = -2) en imidazool (pKa = 7,0), zie hierboven, hebben ook soortgelijke heterocyclische aromatische ringen. Imidazool is meer dan een miljoen keer basischer dan pyrrol omdat de sp2 stikstof die deel uitmaakt van een dubbele binding structureel vergelijkbaar is met pyridine, en een vergelijkbare basiteit heeft.
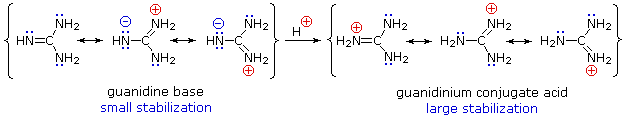
Hoewel resonantiedelocalisatie over het algemeen de basiteit van aminen vermindert, wordt een dramatisch voorbeeld van het omgekeerde effect gevonden in de verbinding guanidine (pKa = 13.6). Hier, zoals hieronder getoond, is de resonantiestabilisatie van de base klein, wegens ladingsscheiding, terwijl het geconjugeerde zuur sterk wordt gestabiliseerd door ladingsdelokalisatie. Bijgevolg zijn waterige oplossingen van guanidine bijna even basisch als oplossingen van natriumhydroxide.