US Pharm. 2013;38(2):HS2-HS8.
ABSTRACT: Acuut gedecompenseerd hartfalen (ADHF), een exacerbatie van chronisch hart-, long- en/of nierfalen, is verantwoordelijk voor het grootste deel van de 39 miljard dollar die wordt uitgegeven aan chronisch hartfalen. De farmacotherapie van ADHF is de laatste tijd niet veranderd, maar studies hebben uitgewezen dat de meeste therapieën even effectief zijn, maar niet economisch verantwoord. Evidence-based, intramurale farmacotherapie wordt geleid door begrip van de Forrester Hemodynamic subsets en hun pathofysiologie. Klinisch succes is niet alleen afhankelijk van de juiste intramurale behandeling, maar ook van de inzet van een ontslagteam.Apothekers kunnen de kloof tussen ziekenhuisbezoeken en ambulante zorg overbruggen door aanbevelingen te doen en continuïteit van zorg te bieden.
In 2010 werden de kosten van de behandeling van hartfalen (HF) in de Verenigde Staten geschat op $39,2 miljard.1,2Bijna 1 miljoen patiënten worden jaarlijks in het ziekenhuis opgenomen voor exacerbaties en HF is momenteel de meest voorkomende reden voor ziekenhuisopname bij volwassenen ouder dan 65 jaar.2 Acuut gedecompenseerd hartfalen (ADHF) kan het gevolg zijn van slecht gecontroleerde, chronische HF en/of hart-, long- of nierdisfunctie. De intramurale zorgkosten voor deze patiënten zijn extreem hoog en maken ongeveer 60% uit van de totale HF-uitgaven.3
Naast de financiële impact van HF, worden de levensduur en levenskwaliteit ernstig aangetast bij patiënten met acute exacerbaties. Ziekenhuisopname wordt geassocieerd met een verhoogd risico op sterfte bij HF-patiënten; sterfte komt voor bij 15,5% van de patiënten, en een derde van de patiënten wordt nooit ontslagen uit het ziekenhuis.2 ADHF is een verlammende ziekte die niet alleen een last vormt voor de patiënten, maar ook voor de gezondheidszorg.
ADHF farmacotherapie is een slagveld voor ziekenhuizen die de kosten willen beheersen in een tijdperk van lagere betalingen en hogere kosten. In oktober 2012 is het Centers for Medicare and Medicaid (CMS) begonnen met het korten van vergoedingen aan ziekenhuizen met hoge percentages heropnames van patiënten in drie dure ziektebeelden: myocardinfarct (MI), longontsteking, en HF. Als patiënten met deze aandoeningen binnen 30 dagen opnieuw worden opgenomen, verlaagt CMS de totale basisvergoeding jaarlijks met 1%, tot een maximale verlaging van 3% in 2014.4 Binnenkort zal het financiële verlies de bijna 2.000 ziekenhuizen die de hoogste boetes krijgen, motiveren om nieuw beleid en follow-upzorg in te voeren voor patiënten die worden ontslagen met een diagnose van HF.
Gelukkig genoeg bleek uit een analyse van CMS uit 2011 dat het aantal HF-opnames over een periode van tien jaar juist was gedaald.1 In 2008 waren er 229.000 minder opnames dan verwacht gezien de waargenomen trends in de afgelopen decennia.1,5 Onderzoekers schreven deze daling toe aan “verminderde incidentie van coronaire hartziekte, verbeterde controle van de bloeddruk, meer gebruik van evidence-based therapieën, en mogelijk veranderingen in de drempels voor opname”. Het 1-jaars sterftecijfer door alle oorzaken bleef echter hoog met ongeveer 30% voor patiënten die in het ziekenhuis werden opgenomen vanwege HF.1,5Zwarte mannen en bepaalde regio’s in het land deden het slechter wat betreft het percentage ziekenhuisopnamen; onderzoekers veronderstelden dat verschillen in toegankelijkheid of kwaliteit van zorg zouden kunnen bijdragen aan deze ongelijkheid.1 De beste resultaten (lagere kosten en heropnamepercentages) worden gezien met een multidisciplinaire aanpak die artsen, apothekers, verpleegkundigen, voedingsdeskundigen en fysiotherapeuten omvat.6 Dit artikel geeft een kort overzicht van de farmacotherapie bij ADHF met een extra blik op farmaco-economische overwegingen en controverses over ontslag.
Pathofysiologie
ADHF wordt gedefinieerd als een plotselinge verslechtering van de HF-symptomen en wordt meestal veroorzaakt door cardiogeen longoedeem met snelle vochtophoping in de longen, hoewel het ook kan voorkomen zonder longoedeem.7 Hypertensie, ischemie en/of ventriculardysfunctie veroorzaken een afname van de cardiale output, hetgeen leidt tot een activering van de neurohormonale pathway. Het sympatische systeem verhoogt de noradrenaline om de perifere perfusie te verbeteren viavasoconstrictie en activeert het renine-angiotensine-aldosteronsysteem om de nierperfusie te verhogen door waterretentie.8 Een acute verhoging van de linkerventrikelvullingsdruk veroorzaakt lekkage van eiwit-voorvocht in de longblaasjes en het interstitium, maar de integriteit van het longmembraan komt niet in het gedrang. Compensatiemechanismen verhogen de hartfrequentie en de systemische vasculaire weerstand in een poging om de cardiale output te verbeteren, en er ontstaat een vicieuze cirkel.7,8
Gemeenschappelijke oorzaken van ADHF zijn linkerventrikel- ofiastolische disfunctie met of zonder coronaire hartziekte (CAD) of ventrikelafwijkingen. Hoewel de meeste patiënten die met ADHF in het ziekenhuis worden opgenomen een verergering van reeds bestaande HF hebben, is bij 20% van de patiënten HF niet eerder gediagnosticeerd.9
ADHF kan ook optreden bij patiënten zonder reeds bestaande hartziekte, waaronder aandoeningen als ernstige hypertensie, vochtoverbelasting, ernstige nierziekte of nierslagaderstenose. De factoren die de gebeurtenis veroorzaken, hebben te maken met een verandering in de bloedstroom door het hart; ADHF kan worden veroorzaakt door hypertensieve crisis, MI of ischemie, atriale obstructie, acute mitralisklepinsufficiëntie, vochtoverbelasting, of het niet innemen van HF-medicijnen. Bepaalde medicijnen, zoals bètablokkers, nondihydropyridine calciumkanaalblokkers en niet-steroïde anti-inflammatoire geneesmiddelen (NSAID’s), kunnenADHF ook versnellen.7,10

Classificatie
ADHF kan worden ingedeeld in hemodynamische stadia, afhankelijk van de cardiale index en de pulmonale capillaire wiggedruk. De stadia worden geclassificeerd als de Forrester Hemodynamic subsets (TABEL 1).11 De cardiale index (CI) geeft de mate van perfusie aan; patiënten worden gekarakteriseerd als “warm” of “koud” afhankelijk van de aanwezigheid van hypoperfusie. Een CI van <2,2 L/min/m2 geeft recht op de classificatie “koud”, hetgeen duidt op hypoperfusie. Tekenen en symptomen die wijzen op hypoperfusie zijn onder meer vermoeidheid, hypotensie, verkoelende ledematen, verminderde nierfunctie en een veranderde mentale status.Pulmonale capillaire wiggedruk (PCWP) geeft de vochtstatus aan; patiënten worden geclassificeerd als “droog” of “nat” afhankelijk van de aanwezigheid van oedeem, dat wordt gedefinieerd als een PCWP >18 mmHg. Tekenen en symptomen van volume-overload zijn hoest, dyspnoe, paroxysmale nachtelijke spnoe, verhoogde jugulaire veneuze druk, perifeer oedeem, ascites, hepatomegalie en splenomegalie.
De meest voorkomende presentatie, die tweederde van de ADHF-opnames uitmaakt, is subset II (warm en nat).8 In vergelijking met subset I (warm en droog), verhoogt subset IV (koud en nat) het sterftecijfer met tweeënhalf maal.12Drie belangrijke laboratoriumparameters wijzen volgens de ADHERE-studie (Acute Decompensated Heart Failure NationalRegistry) op een verhoogd sterfterisico bij patiënten: een bloedureumstikstof van ≥43 g/dL, systolische bloeddruk <115 mmHg, en/of serumcreatinine >2,75 mg/dL.13
Farmacotherapie
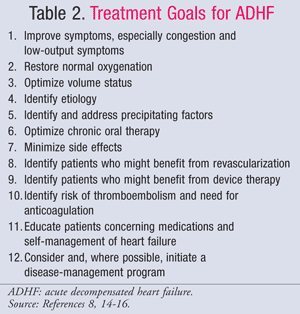
Farmacologische behandeling van ADHF wordt geleid door de hemodynamische status van de patiënt, die wordt beoordeeld met behulp van CI- en PCWP-waarden (TABEL 1).11 De doelen en medicatie voor de behandeling van ADHF worden samengevat in TABEL 2 en 3.8,14-16 Hoewel de zorgstandaard de afgelopen jaren niet significant is veranderd, heeft een nieuwe focus op de farmaco-economische gevolgen van HF aangetoond dat niet alle behandelingen gelijk zijn. Farmacotherapie moet worden gekozen op basis van de gediagnosticeerde subset, waarbij ofwel vochtoverbelasting wordt behandeld ofwel hypoperfusie. Patiënten in subset IV hebben zowel vochtoverbelasting als perfusiedisfunctie en moeten daarom voor beide symptomen behandeld worden.
Subset II of IV-Wet: Intraveneuze (IV) lusdiuretica zijn de belangrijkste behandelingsvorm voor ADHF bij patiënten die zich presenteren met vochtoverbelasting (PCWP >18 mmHg), ondanks tegenstrijdige gegevens over de voordelen voor mortaliteit en morbiditeit. Een meta-analyse van 14 kleine onderzoeken toonde een lagere mortaliteit en ziekenhuisopnames bij met diuretica behandelde patiënten17 ; een recente analyse van waarnemingsgegevens van het ADHERE-onderzoek toonde echter aan dat gehospitaliseerde patiënten die met IV-diuretica werden behandeld, een langere totale verblijfsduur hadden en langer op de IC lagen18. Hoe dan ook, de in 2009 gepubliceerde update van de richtlijnen van het American College of Cardiology/American Heart Association (ACC/AHA) voor de behandeling van HF beveelt vroegtijdige toediening van IV-diuretica aan.14 Bolusdoses van lisdiuretica hebben de voorkeur. Furosemide wordt het meest gebruikt; bumetanide en torsemide zijn echter even effectief. Als patiënten onvoldoende reageren op de aanbevolen maximale bolusdosis van een lisdiureticum, kan een continue infusie van furosemide worden gestart met 5 mg/uur en indien nodig worden getitreerd tot 20 mg/uur.14
De superioriteit van het toedienen van furosemide als continue infusie moet nog worden vastgesteld; de DOSE-studie (Diuretic Optimization StrategiesEvaluation), waarin 308 gehospitaliseerde patiënten werden onderzocht die werden gerandomiseerd om ofwel bolus ofwel IV furosemide te krijgen, liet geen significant verschil zien tussen de veiligheids- en werkzaamheidseindpunten, maar kleinere studies hebben een kleine toename van de urineproductie bij continue infusie aangetoond.19 De onbeheersbare effecten van snelle diurese, zoals een verstoring van de elektrolytenbalans en nierdisfunctie, kunnen leiden tot een langere ziekenhuisopname na het verdwijnen van de symptomen van ADHF, zodat de elektrolyten en serumcreatinine regelmatig moeten worden gecontroleerd.
Een andere strategie om de diurese te verhogen is het toevoegen van een tweede diureticum met een ander werkingsmechanisme, zoals metolazon of spironolacton. Metolazon, een thiazide-achtig diureticum, wordt het meest gebruikt voor acute volumeregeling; spironolacton en andere antaldosteronantagonisten hebben echter de voorkeur bij chronische HF-behandeling.20-22
Bij patiënten met aanhoudende hypertensie en/of persisterende klachten ondanks agressieve diuretica kan een vaatverwijdend middel worden toegevoegd om de pulmonale congestie te verminderen. Natriumnitroprusside, nesiritide en intraveneuze nitroglycerine zijn veneuze vaatverwijders die de congestiesymptomen snel verlichten door de PCWP te verlagen. Als een patiënt zich presenteert met een lage cardiale output en een hoge systemische vasculaire weerstand, worden veneuze vasodilatoren of inotropes aanbevolen, hoewel vasodilatoren de voorkeur hebben. Wegens het risico van cyanidetoxiciteit bij langdurige, hoge-dosis infusies van nitroprusside, zijn de voorkeursvasodilatoren nesiritide en nitroglycerine. Van de twee gaf nesiritide een grotere verbetering van de algehele klinische status dan nitroglycerine in het VMAC-onderzoek (Vasodilation in theManagement of Acute Congestive Heart Failure), ondanks de neiging van het middel om hypotensie te veroorzaken.13
Het nut van nesiritide is in twijfel getrokken vanwege de hoge aanschafkosten.23 Klinische uitkomsten ontbreken, maar één farmaco-economisch model laat zien dat de hoge initiële kosten van nesiritide worden gecompenseerd door het lagere percentage ziekenhuisheropnames binnen 21 dagen in vergelijking met patiënten die dobutamine kregen.24 Evenzo bleek uit een retrospectieve analyse van ADHERE-gegevens dat patiënten die met nitroglycerine of nesiritide werden behandeld, eerder uit het ziekenhuis werden ontslagen dan patiënten die met dobutamine of milrinon werden behandeld, en ook een lager sterfterisico hadden.13 Aangezien meer ernstig zieke patiënten werden behandeld met dotropes, is het moeilijk om de incidentie van verhoogde mortaliteit toe te schrijven aan het geneesmiddel.
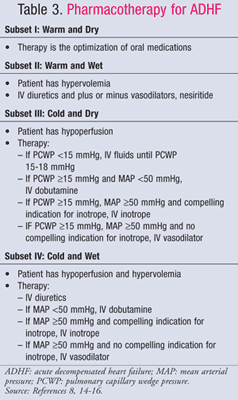
Subset III of IV-Koud: Dobutamine en milrinon zijn de inotrope middelen bij uitstek om de perfusie te verhogen en de eindorgaandoorbloeding te behouden bij patiënten met een verminderde cardiale output.dwingende indicaties voor inotrope middelen zijn onder andere systolische bloeddruk<90 mmHg, symptomatische hypotensie ondanks adequate vullingsdruk (PCWP 15-18 mmHg), verslechtering van de nierfunctie, of onvoldoende respons op IV-vasodilatoren. Voorzichtige selectie van patiënten is noodzakelijk omdat uit gegevens blijkt dat slechte resultaten optreden wanneer inotropes worden toegediend aan patiënten met een behouden hartvolume. De OPTIME-CHF trial toonde een niet-significante toename in mortaliteit en aritmieën wanneer milrinone infusies werden gegeven aan patiënten als onderdeel van de standaard zorg.25 Milrinone moet worden gekozen voor de behandeling van patiënten die gelijktijdig bètablokkers krijgen, omdat het een effect heeft op de cardiale output en systemische vasculaire weerstand via fosfodiësteraseremming, terwijl dobutamine een abeta1 agonist is. Dobutamine is echter de beste keuze voor hypotensieve patiënten, omdat milrinon de bloeddruk aanzienlijk kan verlagen.15
Planning van ontslag
De laatste stap in de behandeling van ADHF is de planning van ontslag en follow-up. Zowel de ACC/AHA- als de HFSA-richtlijnen (Heart Failure Society of America) benadrukken het belang van een goede ontslagplanning.14,15 De belangrijkste pijlers van evidence-based ontslagzorg zijn het behandelen van verergerende factoren, zoals het staken van niet-hydropyridine calciumkanaalblokkers of NSAID’s, het bereiken van een optimale volumestatus, het optimaliseren van de farmacologische therapie en de overgang naar orale therapie (TABEL 4).15 De ACC/AHA-richtlijnen bevelen aan om patiënten en/of zorgverleners bij ontslag schriftelijke instructies of voorlichtingsmateriaal te geven, waarin het volgende aan de orde komt: activiteitenniveau, dieet, ontslagmedicatie, vervolgafspraak, gewichtscontrole en wat te doen als de symptomen verergeren.14De richtlijnen geven ook het voordeel aan van het starten van mortaliteitsverlagende orale therapie voor HF tijdens de ziekenhuisopname, zoals ACE-remmers (angiotensine-converting enzyme) en bètablokkers.Onderzoek toont aan dat op richtlijnen gebaseerde zorg de mortaliteit verlaagt,26 maar geen verlaging laat zien van het aantal heropnames voor patiënten met HF.27,28

Ontslagondersteuning, of casemanagement vanuit het ziekenhuis, wordt nu gebruikt voor ontslagplanning. Ontslagbegeleiding is een multidisciplinaire, teamgebaseerde benadering van zorg die zich bezighoudt met medicatieondersteuning, voorlichting van patiënten, planning van de follow-up en coördinatie van informatie. Een meta-analyse van 18 gerandomiseerde, gecontroleerde trials (RCT) die ontslagplanning met ondersteuning na ontslag analyseerden, waarbij 3.304 patiënten betrokken waren, vond een significante reductie in heropnames door alle oorzaken (relatief risico 0,75, 95% CI 0,68-0,88).29 De externe validiteit van de meta-analyse is moeilijk te bepalen, maar kan een aantal kosteneffectieve strategieën bieden. Eén strategie is afkomstig uit een RCT met 223 HF-patiënten waarin traditionele ontslagbegeleiding met voorlichtingsmateriaal werd vergeleken met een 1 uur durende, individuele onderwijssessie met een verpleegkundige voor ontslag.30 De verpleegkundige interventiegroep had 180 dagen na ontslag een lager risico op heropname in het ziekenhuis of overlijden en er werd geschat dat dit een besparing van $2.823 per patiënt opleverde. Daarentegen is in grootschalige observationele studies geen relatie gevonden tussen patiënten die voorlichtingsmateriaal kregen en een lager heropnamepercentage.26,31 De huidige ACC/AHA-richtlijnen geven niet expliciet aan hoe patiënten na ADHF moeten worden ontslagen, behalve door het geven van voorlichtingsmateriaal.14 De aanbevelingen in de richtlijnen voorzien mogelijk niet in ontslagprocedures die ziekenhuizen helpen te voldoen aan de verwachtingen van CMS.
Hoewel educatief materiaal bij ontslag geen amortaliteitsvoordeel liet zien, kan elk extra oraal middel dat wordt gebruikt voor de behandeling vanHF, zoals een bètablokker of aldosteronantagonist, het aantal ziekenhuisopnames en/of het sterftecijfer met 25% tot 35% verlagen. De ACC/AHA-richtlijnen suggereren dat veel HF-patiënten worden ontslagen voordat een optimale volumestatus is bereikt of naar huis worden gestuurd zonder levensreddende therapieën, waardoor de snelle heropname van deze patiënten in stand wordt gehouden.14 Een ziekenhuisapotheker moet een voorvechter zijn voor patiënten in het ontslagondersteuningsteam door te helpen bij medicatieafstemming, het staken van gecontra-indiceerde medicatie en het aanbevelen van op bewijs gebaseerde HF-farmacotherapie. Medicijnen moeten zo snel mogelijk worden gestart, bij voorkeur in het ziekenhuis; het starten van deze medicijnen kan de HF-symptomen verergeren die ADHF veroorzaken, wat het belang van tijdige follow-up voor deze patiëntenpopulatie nog eens onderstreept.
Conclusie
ADHF is een last voor patiënten, zorgverleners en belastingbetalers. De farmacotherapie voor ADHF is recentelijk niet veranderd, maar het gebruik van ontslagondersteunende teams en snelle follow-up na ontslag bieden mogelijkheden voor interventie door apothekers, zowel binnen als buiten het ziekenhuis. Openbare apothekers kunnen een grote rol spelen in de continuïteit van de zorg, door patiënten te helpen bij de overgang van ziekenhuiszorg naar eerstelijnszorg. Apothekers zijn in staat om de juiste aanbevelingen te doen op basis van richtlijnen, te helpen bij de afstemming van medicatie en voorlichting te geven bij ontslag. Met de recente veranderingen in CMS terugbetaling, apothekers moeten een grotere rol in de behandeling van deze chronische ziekte te nemen.
1. Winslow R, Wang SS. Hartfalen brengt minder mensen in het ziekenhuis. Wall Street Journal. 19 oktober 2011. http://online.wsj.com/article/SB10001424052970203658804576639360226103584.html. Accessed September 1, 2012.
2. Lloyd-Jones D, Adams RJ, Brown TM, et al. Heart disease and stroke statistics-2010 update. Een rapport van de American HeartAssociation. Circulation. 2010;121:e46-e215.
3. Michota FA Jr, Amin A. Bridging the gap between evidence and practice in acute decompensated heart failure management. J Hosp Med. 2008;3(suppl):S7-S15.
4. Rau J. Medicare gaat 2.217 ziekenhuizen bestraffen voor te hoge heropnames. Kaiser Health News.August 13, 2012.www.kaiserhealthnews.org/Stories/2012/August/13/medicare-hospitals-readmissions-penalties.aspx.Accessed September 1, 2012.
5. Chen J, Normand ST, Wang Y, Krumholz HM. National andregional trends in heart failure hospitalization and mortality rates for Medicare beneficiaries, 1998-2008. JAMA. 2011;306:1669-1678.
6. Amin A. Who is managing acute decompensated heart failure? De noodzaak van een multidisciplinaire aanpak. J Hosp Med. 2008;6(suppl):S1-S6.
7. Pinto DS, Lewis S. Pathophysiology of acute decompensated heart failure. In: Basow DS, ed. UpToDate. Waltham, MA: UpToDate; 2012.
8. Crouch MA, Didomenico RJ, Rodgers JE. Applyingconsensus guidelines in the management of acute decompensated heartfailure. ACPE Programma #204-000-06-407-H01. Bethesda, MD: ASHP Advantage;2007.
9. Joseph SM, Cedars AM, Ewald GA, et al. Acuut gedecompenseerd hartfalen: hedendaags medisch management. Tex Heart Inst J. 2009;36:510-520.
10. Pinto DS, Lewis S. Evaluatie van acuut gedecompenseerd hartfalen. In: Basow DS, ed. UpToDate. Waltham, MA: UpToDate; 2012.
11. Forrester JS, Diamond G, Chatterjee K, et al. Medicaltherapy of acute myocardial infarction by application of hemodynamicsubsets. N Engl J Med. 1976;295:1356-1362.
12. Nohria A, Mielniczuk LM, Stevenson LW. Evaluation and monitoring of patients with acute heart failure syndromes. Am J Cardiol. 2005;96:32G-40G.
13. Abraham WT, Adams KF, Fonarow GC, et al. In-hospitalmortality in patients with acute decompensated heart failure requiring intravenous vasoactive medications: an analysis from the AcuteDecompensated Heart Failure National Registry (ADHERE). J Am Coll Cardiol. 2005;46:57-64.
14. Hunt SA, Abraham WT, Chin MH, et al. 2009 focusedupdate incorporated in the ACC/AHA 2005 guidelines for the diagnosisand management of heart failure in adults: a report of the AmericanCollege of Cardiology Foundation/American Heart Association Task Forceon Practice Guidelines. Circulation. 2009;119;e391-e479.
15. Heart Failure Society of America. Evaluatie en behandeling van patiënten met acuut gedecompenseerd hartfalen: HFSA 2010comprehensive heart failure practice guideline. J Card Fail. 2010;16:e134-e156.
16. Colucci W. Behandeling van acuut gedecompenseerd hartfalen: Componenten van therapie. In: Basow DS, ed. UpToDate. Waltham, MA: UpToDate; 2012.
17. Faris R, Flather MD, Purcell H, et al. Diuretica voor hartfalen. Cochrane Database Syst Rev. 2012;(1):CD003838.
18. Gheorghiade M, Filippatos G. Reassessing treatment of acute heart failure syndromes: the ADHERE registry. Eur Heart J. 2005;7:813-819.
19. Felker GM, Lee KL, Bull DA, et al. Diuretische strategieën bij patiënten met acuut gedecompenseerd hartfalen. N Engl J Med. 2011;364:797-805.
20. Effectiveness of spironolactone added to anangiotensin-converting enzyme inhibitor and a loop diuretic for severechronic congestive heart failure (the Randomized Aldactone EvaluationStudy ). Am J Cardiol. 1996;78:902-907.
21. Pitt B, Remme W, Zannad F, et al. Eplerenone, aselective aldosterone blocker, in patients with left ventriculardysfunction after myocardial infarction. N Engl J Med. 2003;348:1309-1321.
22. Zannad F, McMurray JJ, Krum H, et al; EMPHASIS-HFStudy Group. Eplerenone in patients with systolic heart failure and mildsymptoms. N Engl J Med. 2011;364:11-21.
23. Gerhard T, Zineh I, Winterstein AG, Hartzema AG.Pharmacoeconomic modeling of nesiritide versus dobutamine fordecompensated heart failure. Farmacotherapie. 2006;26:34-43.
24. Lissovoy G, Stier DM, Ciesla G, et al. Economicimplications of nesiritide versus dobutamine in the treatment of patients with acutely decompensated congestive heart failure. Am J Cardiol. 2003;92:631-633.
25. Cuffe MS, Califf RM, Adams KF Jr, et al. Short-termintravenous milrinone for acute exacerbation of heart failure: arandomized controlled trial. JAMA. 2002;287:1541-1547.
26. Kfoury AG, French TK, Horne BD, et al. Incrementalsurvival benefit with adherence to standardized heart failure coremeasures: a performance evaluation study of 2958 patients. J Card Fail. 2008;14:95-102.
27. Patterson ME, Hernandez AF, Hammill BG, et al. Process of care performance measures and long-term outcomes in patientshospitalized with heart failure. Med Care. 2010;48:210.
28. Fonarow GC, Abraham WT, Albert NM, et al. Associationbetween performance measures and clinical outcomes for patientshospitalized with heart failure. JAMA. 2007;297:61-70.
29. Phillips CO, Wright SM, Kern DE, et al. Comprehensivedischarge planning with postdischarge support for older patients withcongestive heart failure: a meta-analysis. JAMA. 2004;291:1358-1367.
30. Koelling TM, Johnson ML, Cody RJ, Aaronson KD.Discharge education improves clinical outcomes in patients with chronicheart failure. Circulation. 2005;111:179-185.
31. Jha AK, Orav EJ, Epstein AM. Public reporting of discharge planning and rates of readmissions. N Engl J Med. 2009;361:2637-2645.