Synthese, nomenclatuur en eigenschappen van de amidefunctiegroep
In dit artikel proberen we een breed overzicht te geven van amiden. We geven een kort overzicht van de amidennomenclatuur, twee belangrijke eigenschappen van amiden die sterk verschillen van die van aminen, en we bespreken drie belangrijke strategieën voor amidesynthese.
Inhoudsopgave
- Nomenclatuur van de amidefunctiegroep: Primaire, secundaire en tertiaire amiden
- Amiden versus aminen: Minder basisch, meer zuur
- Synthese van Amiden, deel 1. Nucleofiele Acyl Substitutie van Acyl Halogeniden (of Anhydriden) met Aminen
- Synthese van Amiden, Deel 2: Partiële Hydrolyse van Nitrillen
- Synthese van Amiden, Deel 3: Gebruik van een dehydraterend reagens (zoals DCC)
- Samenvatting: Drie doeltreffende methoden voor de synthese van amiden
- Laten we even stilstaan bij een vierde, minder belangrijke methode: Brute kracht
- Noten
- Quiz Yourself!
- (Gevorderd) Referenties en verder lezen
1. Nomenclatuur van de Amide-functiegroep: Primaire, Secundaire en Tertiaire Amiden
“Amiden” noemen we een amine waaraan een enkele carbonylgroep is verbonden. De amide-functiegroep is voor aminen wat esters zijn voor alcoholen.
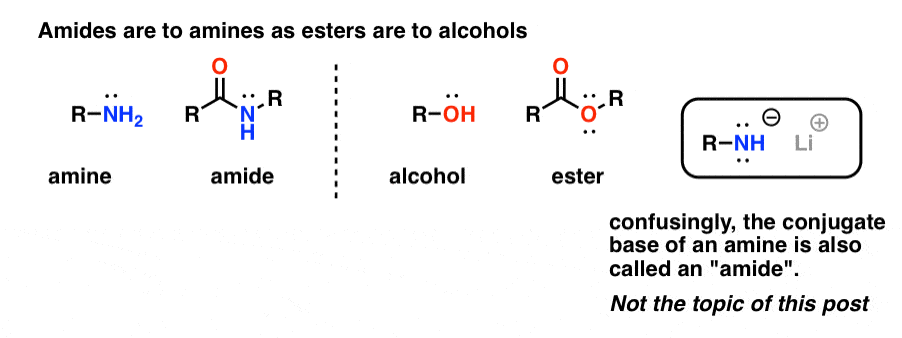
Verwarrend genoeg wordt het woord “amide” ook gebruikt om te verwijzen naar de geconjugeerde basis van aminen, zoals natriumamide (NaNH2) en lithiumdi-isopropylamide (LDA). Deze laatste worden soms onderscheiden door ernaar te verwijzen als “amidebasen”. Anderen gebruiken een iets andere uitspraak om de twee van elkaar te onderscheiden (ayyy-myde en aaah-midd).
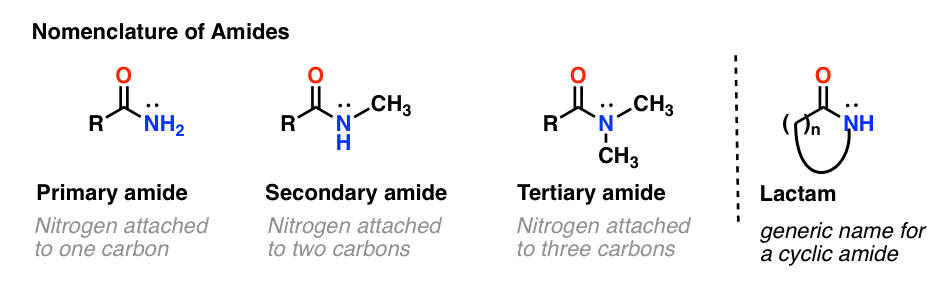
Zoals bij aminen hangt de gebruikte nomenclatuur voor een amide af van het aantal koolstofatomen dat aan de stikstof is verbonden.
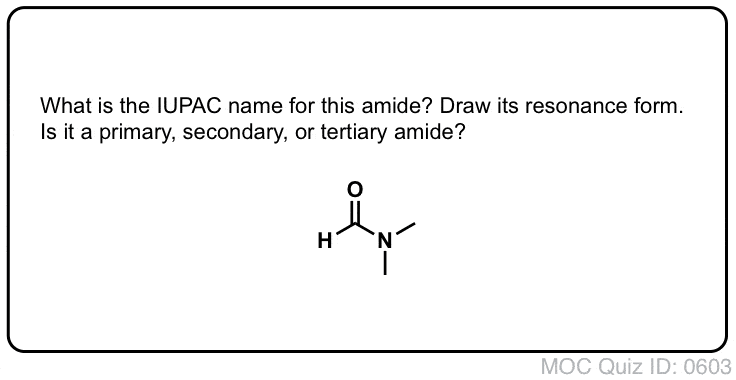
Een primair (1°) amide heeft de stikstof aan één koolstofatomen; een secundair (2°) amide heeft de stikstof aan twee koolstofatomen; een tertiair (3°) amide heeft de stikstof aan drie koolstofatomen. Een cyclisch amide wordt een lactam genoemd.
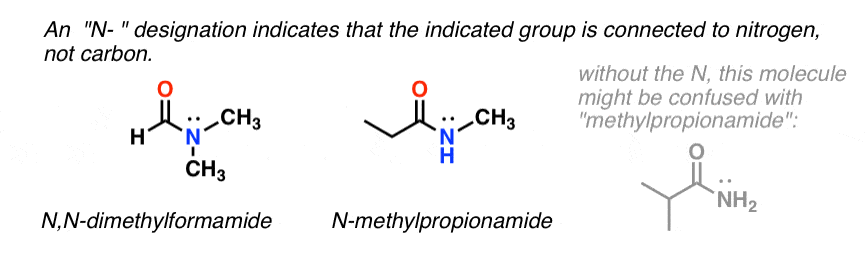
Wanneer de amidestikstof andere substituenten dan waterstof heeft, geven we deze aan met het voorvoegsel N- om verwarring te voorkomen. N-methylpropionamide bijvoorbeeld geeft aan dat er een methylgroep op de stikstof zit; zonder het N-voorvoegsel zou men kunnen denken dat de methylgroep aan koolstof vastzit, wat een heel ander molecuul zou zijn.
Amiden vs. aminen: Minder basisch, meer zuur
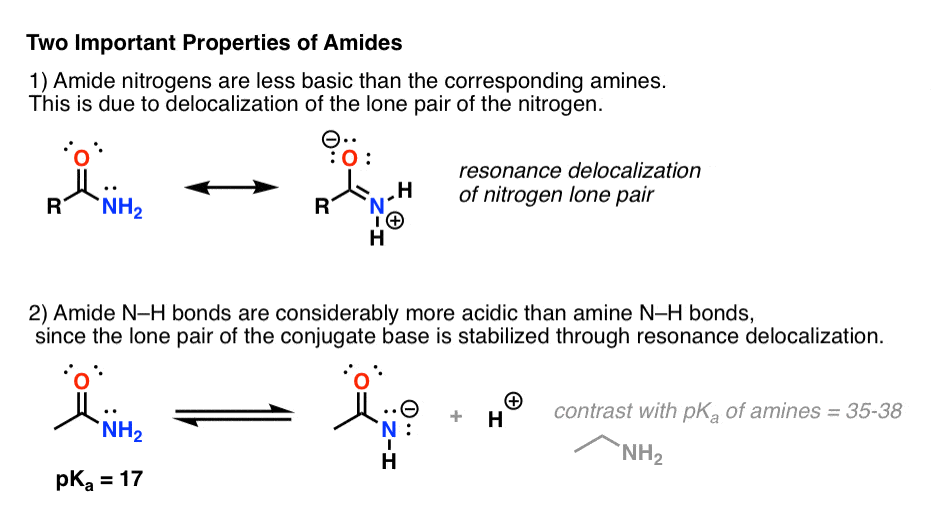
Aanhechting van een carbonylgroep aan een amine heeft twee drastische gevolgen voor de eigenschappen van de stikstof.
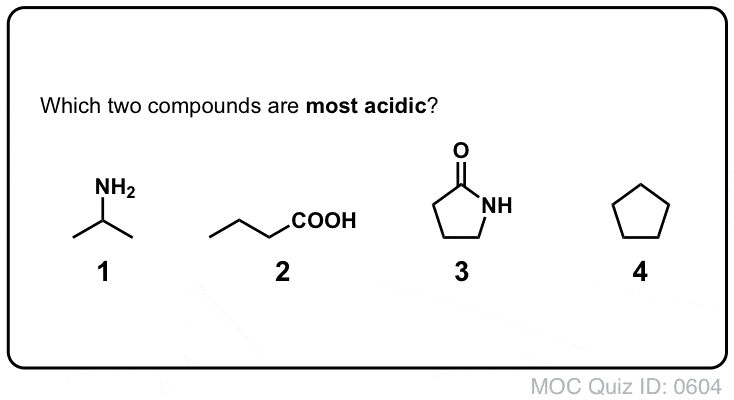
- Ten eerste zijn amidestikstofstikstofstikstofstikstofstikstofstikstofstikstofstikstofstikstofstikstofstikstofstikstofstikstofstikstofstikstofstikstofstikstofstikstofstikstofstikstofstikstofstikstofstikstof. Dat is vooral het gevolg van de delokalisatie van het lone paar van de stikstof in de pi binding van het carbonyl. In feite is de meest basische positie van een amide niet de stikstof maar de zuurstof (!).
- Ten tweede zijn de N-H bindingen van amiden veel zuurder dan de N-H bindingen van aminen. Waarom? Opnieuw delokalisatie. Door de aanhangende carbonylgroep kan het lone paar van de geconjugeerde base door resonantie worden gedelokaliseerd. De pKa van acetamide (17) is ongeveer 20 orden van grootte zuurder dan ammoniak (38).
Een derde, subtielere eigenschap van amides is dat ze meestal een beperkte rotatie om de C-N binding hebben. De resonantievorm waar een C-N binding is, levert zo’n belangrijke bijdrage aan de resonantiehybride dat men kan denken dat de C-N binding een “gedeeltelijk dubbel-bond karakter” heeft.
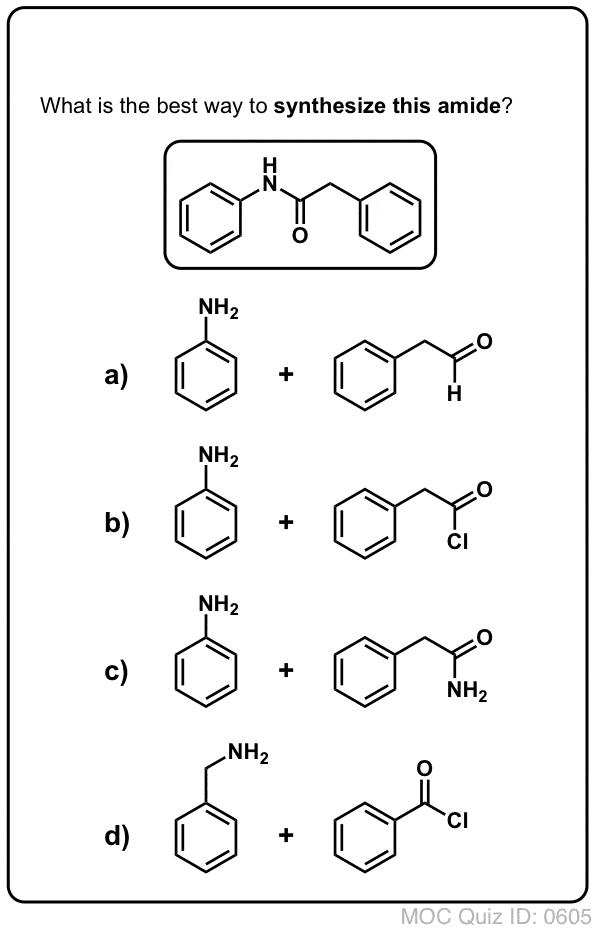
Synthese van Amiden, Deel 1. Nucleofiele Acyl Substitutie van Acyl Haliden (of Anhydriden) Met Aminen
Acyl groepen die aan een goede vertrekkende groep zijn gebonden, zoals zure chloriden of zure anhydriden, kunnen gemakkelijk nucleofiele acyl substitutie ondergaan met amine nucleofielen.
Als om te beginnen alleen het carbonzuur beschikbaar is, is het gebruik van een reagens als thionylchloride (SOCl2) om een carbonzuur om te zetten in een zuurchloride een goede eerste stap bij de omzetting van een carbonzuur in een amide. (PCl3, PCl5, oxalylchloride en een hele reeks andere reagentia kunnen ook werken). Als alternatief levert de behandeling van een carbonzuur met een acylhalogenide een anhydride op, dat ook effectief kan zijn.
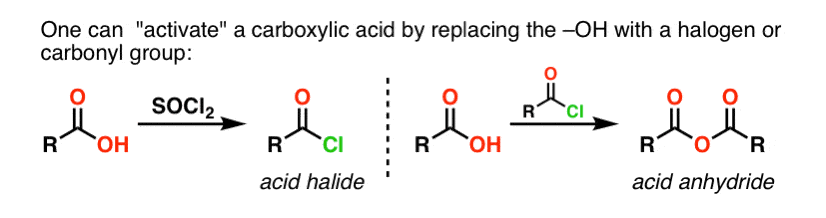
Halogeniden (bijv. Cl- ) en carboxylaten (RCO2- ) zijn veel zwakkere basen, en dus veel betere verlatende groepen dan HO-. Dus door een amine toe te voegen aan een acylhalogenide of zuuranhydride kan nucleofiele acylsubstitutie plaatsvinden onder veel mildere omstandigheden, wat resulteert in ons gewenste amide.
(Men kan amiden verkrijgen door de reactie van esters met aminen, maar aangezien alkoxiden slechtere verlatingsgroepen zijn dan halogeniden of carboxylaten, vereist deze methode meer dwingende voorwaarden. )
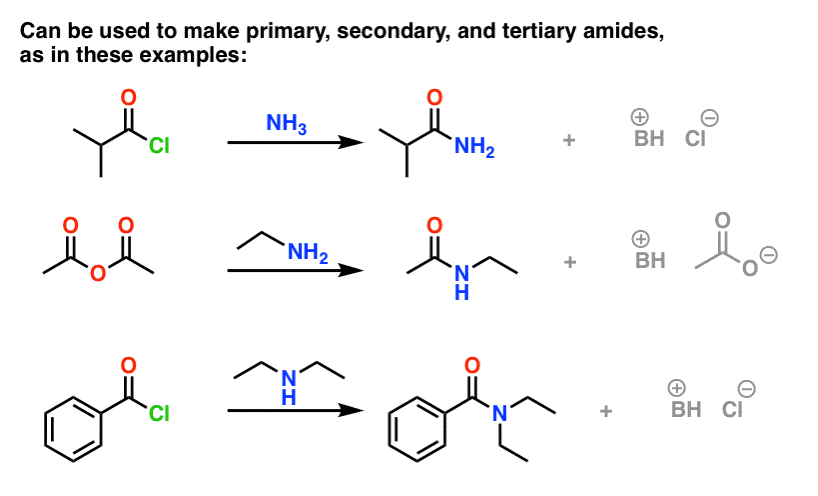
Eén ding om op te merken met zure halogeniden is dat het proces één equivalent HCl als bijproduct genereert. Zonder extra base zou de maximale opbrengst van de procedure 50% zijn, omdat het HCl elk amine protoneert en er een niet-nucleofiel ammoniumzout van maakt.
Een manier om ervoor te zorgen dat de reactie wordt voltooid, is het toevoegen van een tweede amine-equivalent. Er zijn andere praktische manieren om dit probleem op te lossen, die ik in een voetnoot heb gezet.
Als je een opfrisser nodig hebt over het mechanisme van nucleofiele acylsubstitutie, klik dan hier voor een pop-up plaatje of open de link hier:
.
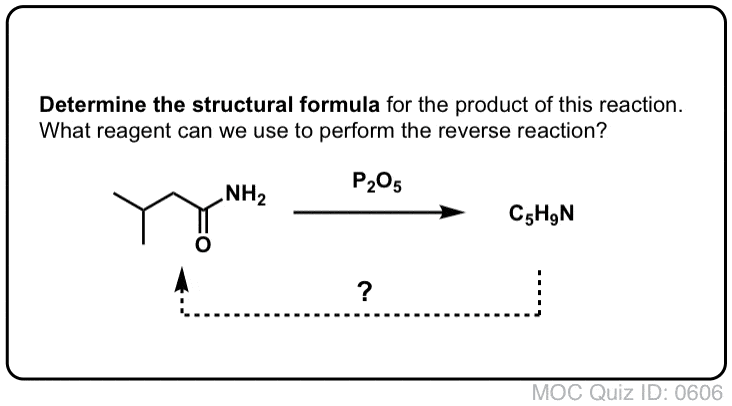
Synthese van Amiden, Deel 2: Gedeeltelijke hydrolyse van Nitriles
Een manier om aan nitriles te denken is dat het gemaskeerde carboxylzuren zijn. Als ze worden behandeld met waterig zuur en veel warmte – mokeromstandigheden – kunnen ze worden gehydrolyseerd tot carbonzuren.
Een van de tussenproducten in dit proces is een primair amide.
Dus als we een iets vriendelijker, voorzichtiger mokertechniek gebruiken, is het soms mogelijk om het amide uit ons reactiemengsel te redden voordat het is gehydrolyseerd tot carbonzuur.
Het plaatje hieronder laat zien hoe je een amide kunt synthetiseren uit een alkylhalogenide-precursor, via de good-ol’ SN2-reactie:
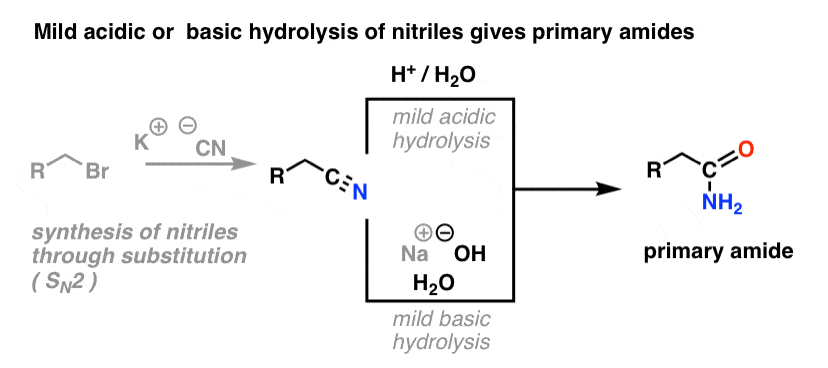
Wat wordt bedoeld met “mild”? Eén set voorwaarden voor de hydrolyse van fenylacetamide (PhCH2CN) naar PhCH2CONH2 geeft als reactievoorwaarden “HCl, H2O, 40-50°C, 1h”.
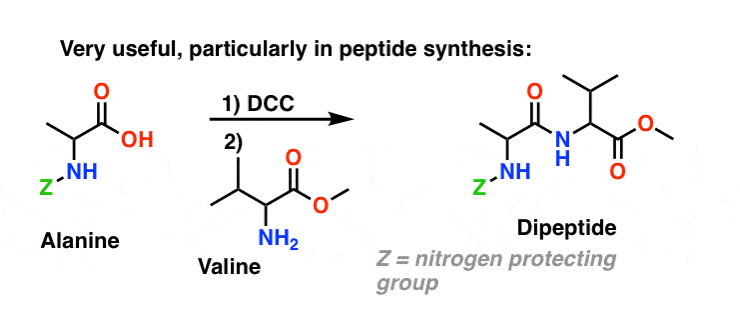
Synthese van amiden, deel 3: Gebruik van een dehydraterend reagens (zoals DCC)
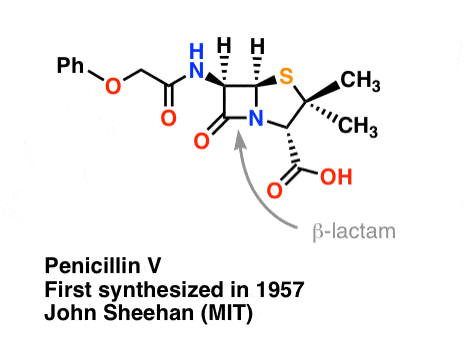
De synthese van penicilline V in 1957 door de groep van John Sheehan aan het MIT staat te boek als een van de heroïsche successen van de naoorlogse organische chemie. Het kernprobleem was de constructie van een cyclisch amide (de β-lactam ring) dat extreem onstabiel is onder zure omstandigheden. Dit was niet onbelangrijk, omdat de β-lactam ook de sleutel is tot het werkingsmechanisme van penicilline: interfereren met de synthese van de bacteriële celwand. Pogingen om dit cyclische amide te maken door een carbonzuur om te zetten in een acylhalogenide met SOCl2, PCl3, PCl5, en een groot aantal andere methoden, mislukten allemaal.
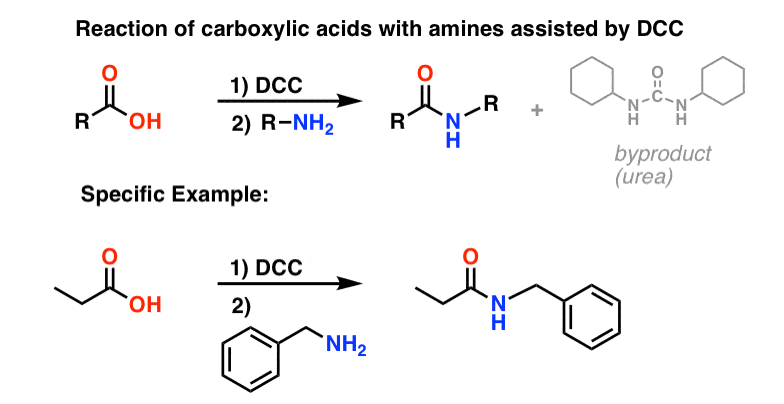
In reactie hierop vond de groep van Sheehan een zeer mild dehydraterend reagens uit: N, N’-dicyclohexylcarbodiimide (DCC), dat de vorming van amiden mogelijk maakte onder zeer milde omstandigheden bij neutrale pH.
Heden ten dage worden DCC (en zijn meer praktische (noot) neefje, EDC ) op grote schaal gebruikt voor de synthese van gevoelige amiden – met name peptiden – onder zeer milde omstandigheden.
Onder de reactieomstandigheden hecht de carboxylaatzuurstof zich aan de elektrofiele koolstof van DCC, waardoor een zogenaamde “actieve ester” wordt gevormd – met andere woorden, een ester die daadwerkelijk een fatsoenlijke vertrekgroep heeft (in tegenstelling tot de meeste esters, die dat niet hebben). De actieve ester wordt vervolgens aangevallen door het amine in een klassieke nucleofiele acylsubstitutie, die leidt tot de vorming van het amide.
Als je naar het bijproduct kijkt, zie je dat er twee hydrogenen zijn (elk verbonden met stikstof) en een zuurstof (verbonden met de centrale koolstof). Daar is de H2O naartoe!
Omdat dit bericht al belachelijk lang wordt, heb ik het mechanisme bewaard voor deze pop-up afbeelding.
Doordat deze reactie onder neutrale omstandigheden plaatsvindt, is ze uiterst nuttig bij de synthese van peptiden, die zowel onder basische als onder zure omstandigheden racemisatie (epimerisatie, eigenlijk) kunnen ondergaan.
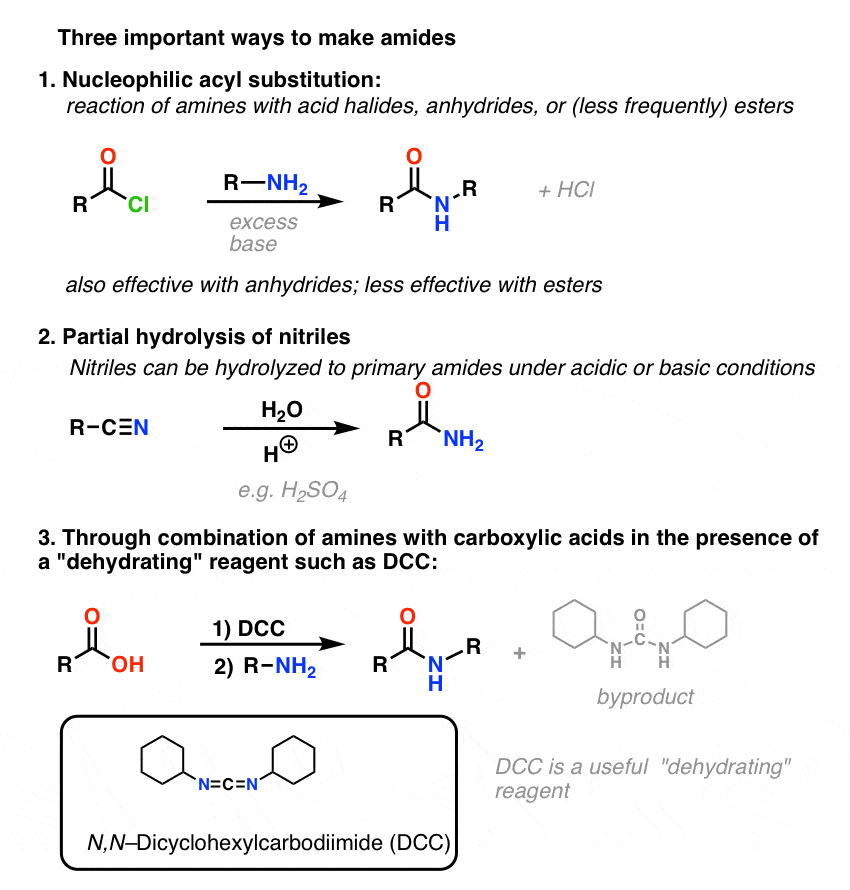
Samenvatting: Drie effectieve methoden voor de synthese van amiden
Laten we eindigen met een samenvatting van deze drie belangrijke (maar geenszins uitputtende) manieren om amiden te maken:
Dit is het einde van onze post over de belangrijkste punten van amidenomenclatuur, eigenschappen en synthese. Lees verder voor een bonusmethode voor amidesynthese.
Laten we kort stilstaan bij een vierde, minder belangrijke methode: Brute kracht
Omdat dit meestal in de leerboeken wordt behandeld, overwegen we tot slot nog een vierde mogelijkheid – de eenvoudigst denkbare. Wat als we een carbonzuur nemen en dat combineren met een amine, in de hoop dat er een amide ontstaat. Wat gebeurt er dan?
Aminen zijn basen, en carbonzuren zijn, nou ja, zuren. Voeg je die twee samen, dan krijg je een onschadelijk zout.
Soms kun je amiden maken door dit zout in een afgesloten buis te verhitten, waarbij een hoeveelheid water vrijkomt. Deze methode heet pyrolyse.
De methode is niet direct, en heeft alle subtiliteit van een houwitser.
Het probleem met pyrolyse is dat de HO-groep van een carbonzuur een verschrikkelijke vertrekkende groep is.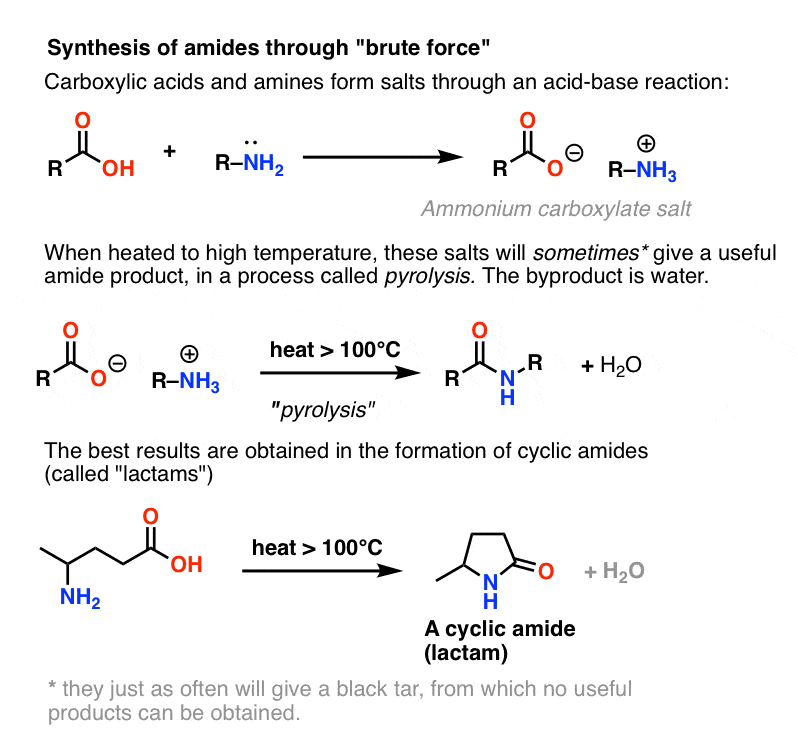
Om een amide te vormen uit deze soort, moet de carboxylaatzuurstof (O- ) op de een of andere manier vertrekken. Dit is niet eenvoudig, want de geconjugeerde base van O- is het dubbelanion O2- . In elke lijst van vertrekkende groepen zou O2- ergens tussen, “shitty” en “f&cking awful” staan.
Als men echter op dit zout slaat met het chemische equivalent van de hamer van Thor: brute kracht, hoge hitte, kan een reeks protonoverdrachten vanuit het ammoniumzout plaatsvinden, waarbij uiteindelijk H2O vrijkomt en de C-N binding wordt gevormd.
Dit proces wordt pyrolyse genoemd (pyro = vuur, lysis = breken).
In bepaalde gevallen, vooral eenvoudige amiden, en ook bij de vorming van eenvoudige lactamen, kan dit proces bevredigend zijn.
In veel andere gevallen resulteert het echter in de vorming van een zwarte teer op de bodem van je erlenmeyer waaruit geen bruikbaar product kan worden verkregen.
Zoals elke organisch chemicus je kan vertellen, zijn er vele uiteenlopende manieren om hardnekkige zwarte teer op de bodem van je erlenmeyer te creëren, en dit is slechts één methode. Bedenk eens hoeveel er nog te ontdekken valt!

“Hamer van Thor” Google Image Search was scheikunde-gerelateerd, maar verrassend genoeg NSFW.
Noten
Een leuk, verwant artikel: Amiden: Humble But Useful (uit Chemical & Engineering News).
Er is ook een inductief effect, waarbij de elektronegatieve zuurstof (elektronegativiteit van 3,44) aan de elektronen van de aangehechte koolstof trekt, die op zijn beurt weer aan de elektronen van de stikstof trekt.
Note 2. Een zeer gebruikelijke manier om deze reactie uit te voeren is het gebruik van de zogenaamde Schotten-Baumann-condities, waarbij men de reactanten opneemt in een oplosmiddel als diethylether of dichoromethaan, en een waterige oplossing van NaOH toevoegt, waardoor een bifasisch mengsel ontstaat. Eventuele gevormde ammoniumzouten kunnen oplossen in de waterige fase, waarna zij worden geneutraliseerd door de overmaat base en terugkeren naar de organische fase. Amines zijn over het algemeen veel meer nucleofiel dan hydroxide-ionen, zodat hydrolyse van het zuurchloride tot een carboxylzuur over het algemeen geen probleem is.
Noot 3.
“Ten tijde van mijn succesvolle synthese van penicilline V in 1957 vergeleek ik het probleem van het synthetiseren van penicilline volgens klassieke methoden met dat van het proberen te repareren van de drijfveer van een mooi horloge met een aambeeld, hamer en tang van een smid” – John C. Sheehan
Note 4. Het probleem met het gebruik van DCC is dat het bijproduct, DCU, enorm lastig te verwijderen is. De meeste bijproducten zijn gemakkelijk te verwijderen met behulp van kolomchromatografie. DCU niet. Door weinig rekening te houden met de polariteit van het oplosmiddel, komt DCU langzaam en druppelsgewijs uit een kolom en verontreinigt daarbij elke fractie. EDC is een variant van DCC met een tertiaire amine-eenheid; een eenvoudige zure spoeling tijdens de bewerking verwijdert dus al het ureum, wat veel tijd en hoofdpijn bespaart.
De volgende afbeelding toont de laatste stap van Sheehan’s synthese met DCC.
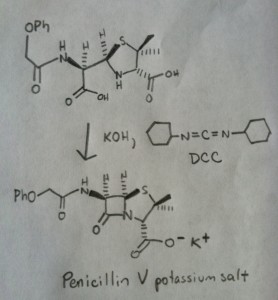
Afbeelding: Carmen Drahl/Chemical & Engineering News
Quiz Yourself!
 Klik om te bladeren
Klik om te bladeren 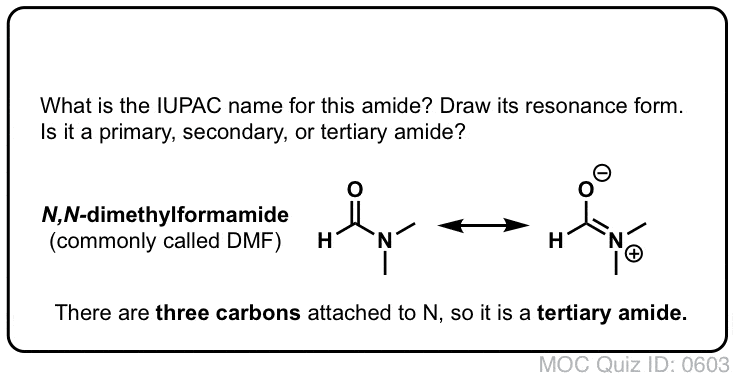
 Klik om te spiegelen
Klik om te spiegelen 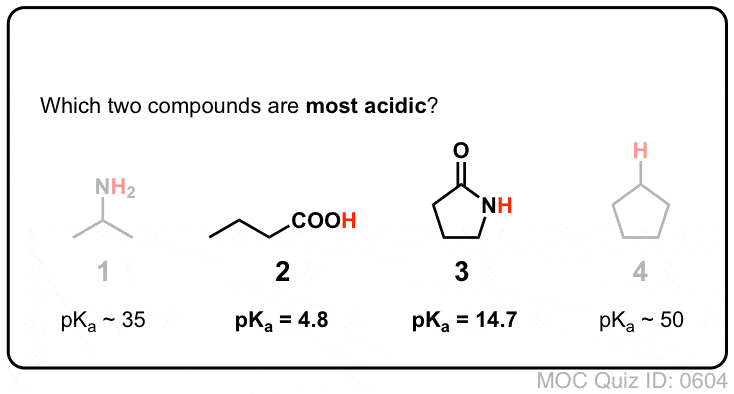
 Klik om te spiegelen
Klik om te spiegelen 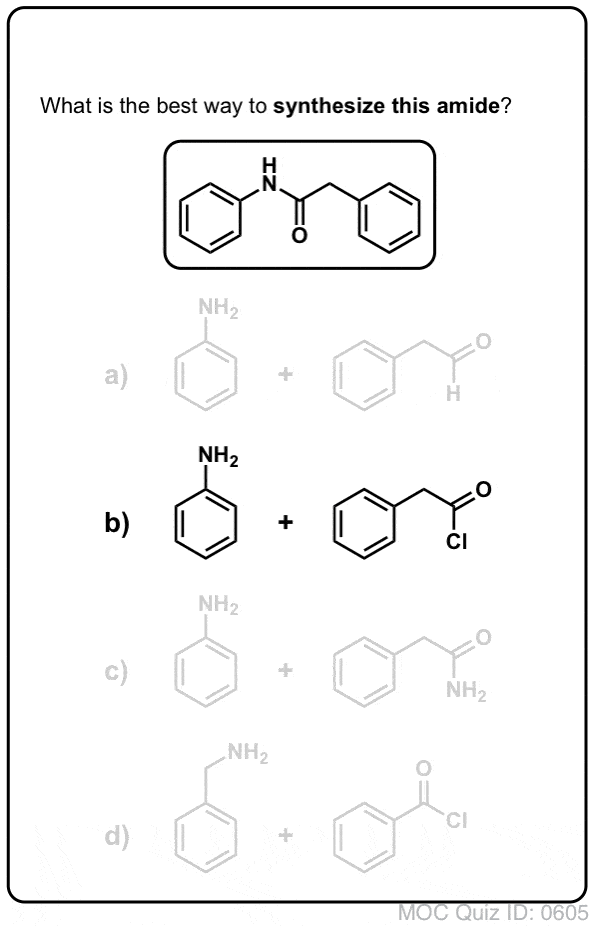
 Klik om te spiegelen
Klik om te spiegelen 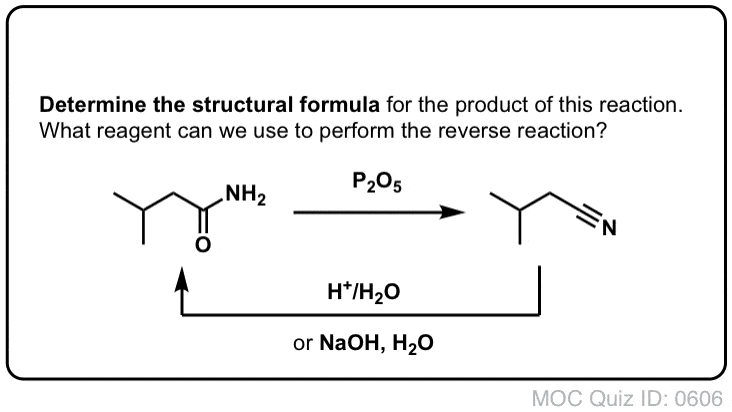
 Klik om te bladeren
Klik om te bladeren 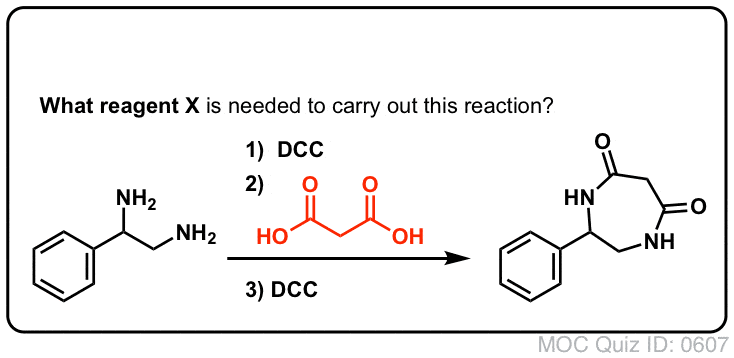
(Gevorderde) Referenties en verdere lectuur
Nitrilhydrolyse:
- PHENYLACETAMIDE
Wilhelm Wenner
Org Synth. 1952, 32, 92
DOI: 10.15227/orgsyn.032.0092
De hier gebruikte condities voor hydratatie van de nitril tot de amide zijn tamelijk zacht – hierbij wordt een temperatuur van 40 °C gedurende ongeveer 1 uur gebruikt. - Hydrolyse van nitril door halogeniden
James M. Photis
Tetrahedron Lett. 1980, 21 (37), 3539-3540
DOI: 10.1016/0040-4039(80)80228-0
Dit is een nuttige procedure voor selectieve hydrolyse van nitrillen tot primaire amiden, vooral in het geval van aroylcyaniden (b.v. PhCOCN). - Makkelijke en zeer selectieve omzetting van nitrillen in amiden via indirecte zuur-gekatalyseerde hydratatie met TFA of AcOH-H2SO4
Jarugu Narasimha Moorthy en Nidhi Singhal
The Journal of Organic Chemistry 2005, 70 (5), 1926-1929
DOI: 10.1021/jo048240aSchotten-Bauman Reactie:
#4 en #5 zijn de originele papers van Schotten en Baumann over een eenvoudige bifase amide synthese. - Ueber die Oxydation des Piperidins
Schotten, C.
Ber. 1884, 17 (2), 2544-2547
DOI: 10.1002/cber.188401702178 - Ueber eine einfache Methode der Darstellung von Benzoësäureäthern
Baumann, E.
Ber. 1886, 19 (2), 3218-3222
DOI: 10.1002/cber.188601902348 - Enantioselectieve totaalsynthese van (-)-Kibdelone C
John R. Butler, Chao Wang, Jianwei Bian, and Joseph M. Ready
Journal of the American Chemical Society 2011, 133 (26), 9956-9959
DOI: 1021/ja204040k
De nederige Schotten-Baumann reactie wordt zelfs gebruikt in veeleisende totaalsynthesen – in dit geval wordt hij gebruikt om het lactam in 4 te maken uit 5 en 6! - BENZOYL PIPERIDINE
Marvel, C. S.; Lazier, W. A.
Org. Synth. 1929, 9, 16
DOI: 10.15227/orgsyn.009.0016
Deze procedure uit Organic Syntheses, een bron van onafhankelijk geteste en reproduceerbare synthetische organische laboratoriumprocedures, is een klassieke Schotten-Baumann amide synthese. - Een High-Throughput Proces voor Valsartan
Ulrich Beutler, Matthias Boehm, Peter C. Fuenfschilling, Thomas Heinz, Jean-Paul Mutz, Ulrich Onken, Martin Mueller, and Werner Zaugg
Organic Process Research & Development 2007, 11 (5), 892-898
DOI: 1021/op700120n
Organic Process & Research Development (“OPRD”) is een geweldig tijdschrift voor proces- of scale-upchemie. Dit artikel laat zien hoe de Schotten-Baumann reactie (4 tot 3) de voorkeur geniet voor grootschalige reacties, omdat het eenvoudig, robuust en gemakkelijk uit te voeren is, en geen grote exothermen heeft (in tegenstelling tot bijvoorbeeld de Grignard reactie). - De nylon touw truc: Demonstratie van condensatiepolymerisatie
Paul W. Morgan en Stephanie L. Kwolek
Journal of Chemical Education 1959, 36 (4), 182
DOI: 1021/ed036p182
De klassieke ‘nylon rope trick’ waarbij men een sliert nylon uit een bifasisch mengsel van hexamethylenediamine en sebacoylchloride trekt, kan beschouwd worden als een soort Schotten-Baumann reactie, in die zin dat er een polyamide wordt gevormd! Dit werd voor het eerst ontwikkeld door Stephanie Kwolek, die meer dan 40 jaar een vooraanstaand chemicus bij DuPont was en verantwoordelijk was voor de ontdekking van Kevlar en de ontwikkeling van de chemie van aramiden en andere materialen met hoge treksterkte.DCC: - Een nieuwe methode om peptidebindingen te vormen
John C. Sheehan en George P. Hess
Journal of the American Chemical Society 1955, 77 (4), 1067-1068
DOI: 1021/ja01609a099
Oorspronkelijk artikel over de synthese van peptidebindingen/amidebindingen met behulp van DCC.DeTar heeft een reeks artikelen gepubliceerd over het mechanisme van de bindingsvormende reacties die door DCC en andere carbodiimiden worden bemiddeld, en hier zijn de eerste twee: - Reacties van carbodiimiden. I. The Mechanisms of the Reactions of Acetic Acid with Dicyclohexylcarbodiimide
DeLos F. DeTar and Richard Silverstein
Journal of the American Chemical Society 1966, 88 (5), 1013-1019
DOI: 10.1021/ja00957a027 - Reacties van Carbodiimiden. II. De reacties van Dicyclohexylcarbodiimide met Carboxylzuren in aanwezigheid van Amines en Fenolen
DeLos F. DeTar en Richard Silverstein
Journal of the American Chemical Society 1966, 88 (5), 1020-1023
DOI:1021/ja00957a028 - The Chemistry of Carbodiimides.
G. Khorana
Chemical Reviews 1953, 53 (2), 145-166
DOI: 10.1021/cr60165a001
Een oud overzichtswerk van Prof. Har Gobind Khorana, die later de Nobelprijs voor Geneeskunde ontving voor zijn werk waarmee hij aantoonde dat de nucleotiden in DNA en RNA coderen voor de eiwitsynthese. - ESTERIFICATIE VAN CARBOXYLIC ACIDS MET DICYCLOHEXYLCARBODIIMIDE/4-DIMETHYLAMINOPYRIDINE: tert-BUTYL ETHYL FUMARATE
Neises en Wolfgang Steglich
Org. Synth. 1985, 63, 183
DOI: 10.15227/orgsyn.063.0183
Dit is een procedure voor selectieve verestering met behulp van DCC – hierdoor wordt de transesterificatie vermeden die onder de gebruikelijke Fischer-veresteringsomstandigheden zou optreden. Deze procedure is afkomstig van Organic Syntheses, een bron van betrouwbare, onafhankelijk geteste synthetische organische reacties. - Vaste fase peptide synthese. I. De synthese van een tetrapeptide
B. Merrifield
Journal of the American Chemical Society 1963, 85 (14), 2149-2154
DOI: 10.1021/ja00897a025
Dit is een van de meest geciteerde artikelen in JACS, en niet voor niets – het legt in feite de basis voor SPPS, en wat nu een miljarden-dollar-industrie is. Dit werk leidde tot een Nobelprijs in Chemie voor de auteur, Prof. R. Bruce Merrifield (Rockefeller U.). De peptidekoppelingen worden gedaan met niemand minder dan DCC. - Notities – Een gemakkelijke synthese van wateroplosbare carbodiimiden.
John Sheehan, Philip Cruickshank, and Gregory Boshart
The Journal of Organic Chemistry 1961, 26 (7), 2525-2528
DOI:1021/jo01351a600
Het grote nadeel met DCC is dat het scheiden van de aldus geproduceerde DCU (dicyclohexylurea) omslachtig kan zijn. Daarom zijn andere reagentia ontwikkeld, zoals EDC (1-Ethyl-3-(3′-dimethylaminopropyl)carbodiimide), waarbij het resulterende ureum in water oplosbaar is en gemakkelijk door extractie kan worden verwijderd. - Totale synthese van een monocyclisch peptide lacton antibioticum, etamycine
John C. Sheehan and Stephen L. Ledis
Journal of the American Chemical Society 1973, 95 (3), 875-879
DOI:1021/ja00784a041
EDC werd gebruikt voor de meeste peptidekoppelingen in de synthese van dit peptide, dat een van de eerste cyclische peptiden is die synthetisch werden geproduceerd.