Enolisatie of een keto-enol tautomerisme is een proces waarbij een keton of een aldehyde wordt omgezet in een corresponderend enol (in zure omstandigheden) of een enolaat (in basische omstandigheden). Dit proces kan ook in esters voorkomen. Ik ga me in dit bericht echter richten op aldehyden en ketonen, zodat ik het niet overlaad met de details en nuances.
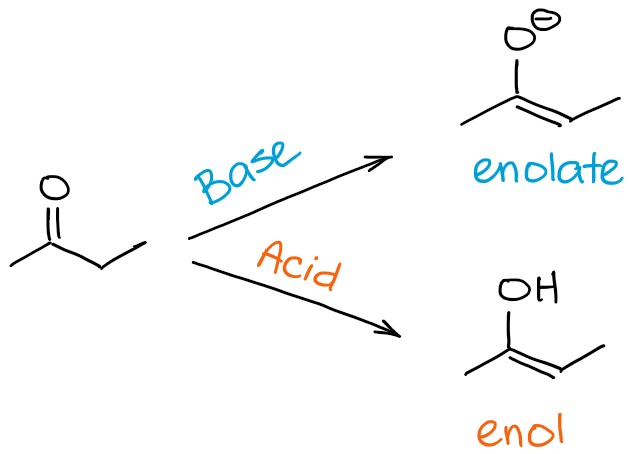
Dus, wat is het verschil tussen een enolisatie- en een keto-enol tautomerisatieproces? Een kort antwoord is eigenlijk geen 😊
Wanneer we het over enolisatie hebben, hebben we het specifiek over het proces dat je van een keton of een aldehyde naar een enol of een enolaat brengt. Wanneer we het hebben over een keto-enol tautomerisme, bedoelen we het evenwicht in het algemeen. Door te zeggen dat mijn molecule de keto-enol tautomerisatie ondergaat, kan ik dus de richting van het proces impliceren, maar ik wijs het in het algemeen niet per se aan. De richting van de keto-enol tautomerisatie kan echter vaak worden afgeleid uit de context van de reactie.
In een notendop, als je zegt dat molecuul “A” een enolisatie ondergaat, betekent dit dat “A” een enol of een enolaat wordt. Als je zegt dat een molecuul “B” een keto-enol tautomerisatie ondergaat, kan dat enolisatie betekenen als B een carbonyl is, of het kan een omgekeerd proces betekenen als B al een enol of een enolaat is.
Base-gekatalyseerde enolisatie
Terwijl enolisatie zowel in basische als in zure omstandigheden kan plaatsvinden, is base-gekatalyseerde enolisatie een meer gebruikelijke manier om deze reactie uit te voeren. Daarom lijkt het me een goed idee om eerst de enolisatie in basische omstandigheden te behandelen.
In basische omstandigheden fungeert een keton of een aldehyde als een Brønsted zuur dat een proton van een α-koolstof aan een base in de oplossing doneert. Dit proces levert een resonant gestabiliseerd enolaatanion op:

Omdat in dit evenwicht ons carbonyl als zuur fungeert, moet het voldoende zuur zijn om het proton weg te geven. Of de base moet sterk genoeg zijn om dit evenwicht in de richting van het product te drijven.
Hoe zuur zijn de hydrogenen op de α-karbonen?
Het enolaat anion is een resonant gestabiliseerde soort, dus de mate van resonantiestabilisatie speelt een zeer belangrijke rol bij de zuurgraad van carbonylverbindingen. Wij weten, dat hoe meer resonantiebijdragen wij voor de geconjugeerde base kunnen trekken, hoe stabieler deze is. En hoe stabieler de geconjugeerde base, hoe zuurder het oorspronkelijke zuur is. Zo zullen de hydrogenen tussen twee C=O bindingen beduidend zuurder zijn dan die naast slechts één C=O.
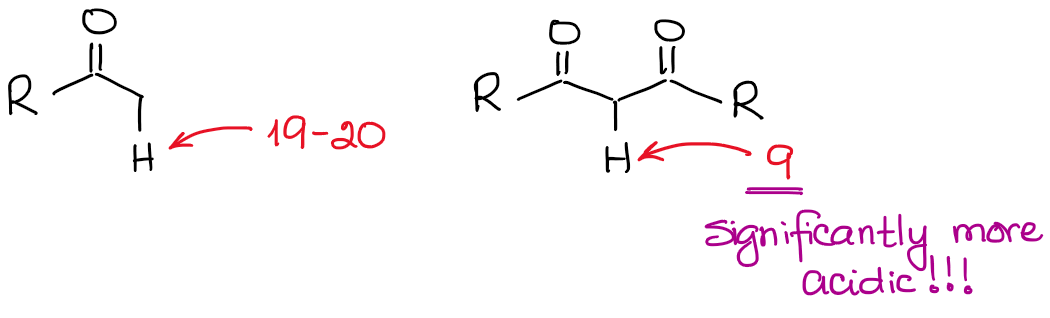
Als we de geconjugeerde basen in beide gevallen vergelijken, zien we dat de dicarbonyl een betere resonantiestabilisatie van de negatieve lading heeft door een uitgebreider geconjugeerd systeem.
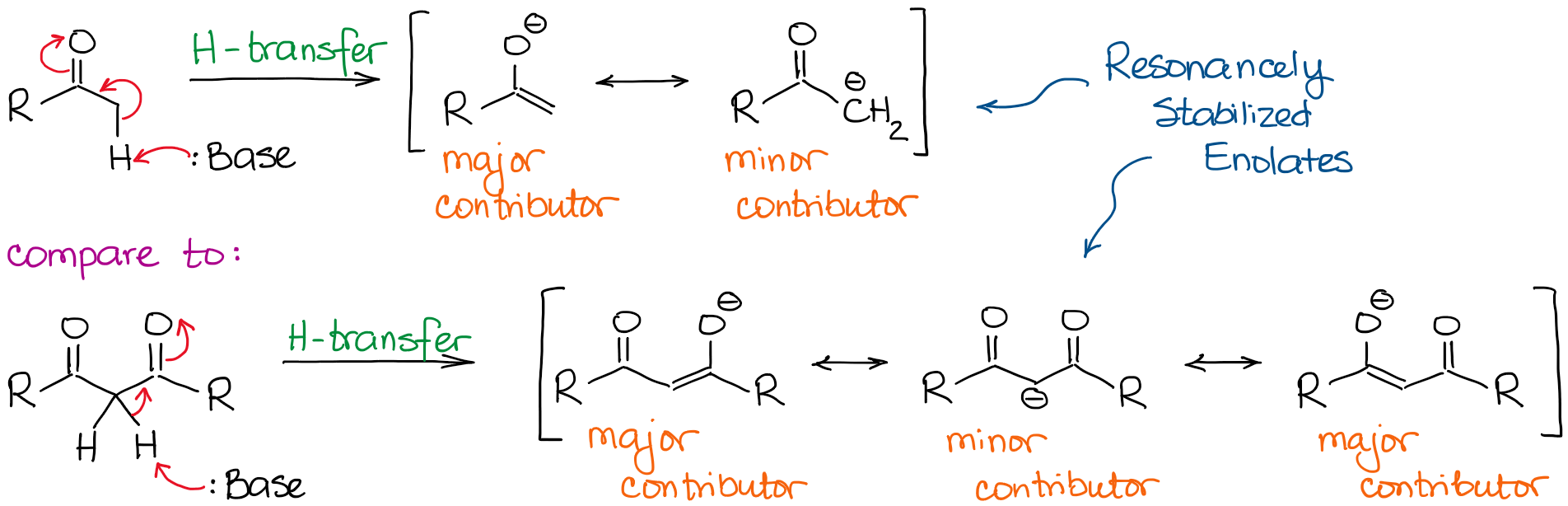
Een bijkomende belangrijke resonantiebijdrage in het dicarbonylanion maakt het molecuul ongeveer 100000000 keer zuurder! De aard van een keton of een aldehyde is hier dus vrij duidelijk: hoe meer C=O bindingen naast een waterstof, hoe zuurder het wordt.
Effect van een base op het enolisatie-evenwicht
Bases hebben zeer verschillende sterktes. De keuze van een base is dus belangrijk als je je evenwicht tot een goed einde wilt brengen. Laten we eens kijken naar een paar basen die we meestal zien in organische chemie reacties:
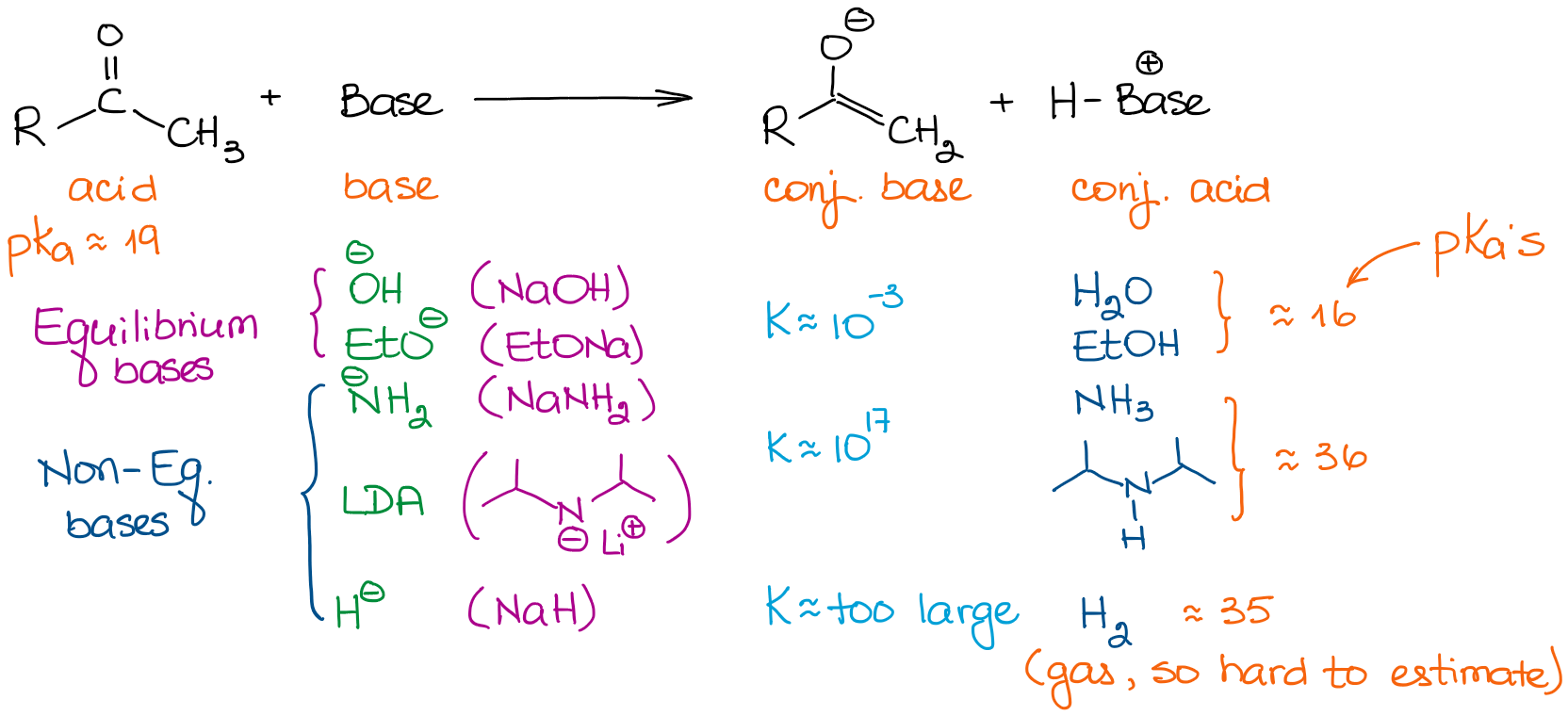
Wanneer we te maken hebben met de eenvoudige aldehyden en ketonen, kunnen we alle basen in twee categorieën indelen: evenwichtsbases en niet-evenwichtsbases. De evenwichtsbasen zijn relatief zwak. Dit betekent dat zij het evenwicht slechts in zeer geringe mate kunnen beïnvloeden. De werkelijke concentratie van een enolaat in de oplossing zal dus zeer klein zijn. De reactie zal ook in een constant evenwicht verlopen tussen de uitgangsstof en een enolaat. Deze basen bevorderen de vorming van meer thermodynamisch stabiele enolaten. Deze enolaten worden thermodynamische enolaten genoemd.
Niet-evenwichtsbases zijn echter zeer sterk. Dit leidt tot een protonoverdracht (zuur-base) reactie met zeer grote evenwichtsconstanten. Bij een evenwichtsconstante van meer dan 103 is het evenwicht vrijwel geheel verschoven in de richting van de producten. Dus, een enolisatie met een base zoals LDA geeft bijna 100% enolisatie. De concentratie van het oorspronkelijke aldehyde of keton is dus vrijwel nul.
Carbonyls met één C=O binding versus β-dicarbonyls
Zoals ik hierboven al zei, zijn β-dicarbonyls beduidend zuurder dan gewone aldehyden en ketonen. Laten we eens kijken naar een evenwichtsconstante in de volgende twee gevallen:
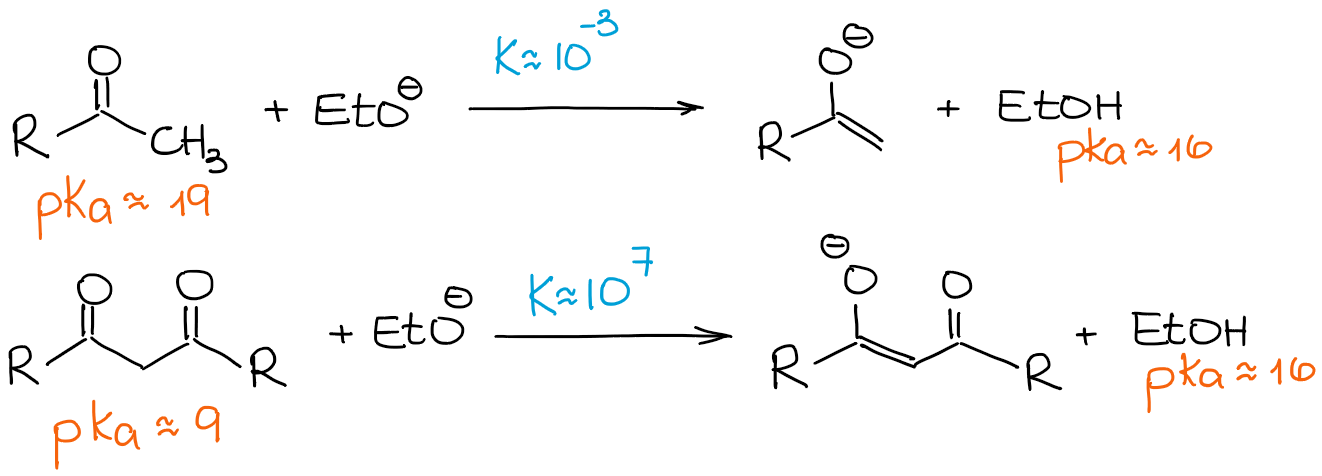
Omdat een β-dicarbonyl zo veel zuurder is dan een gewoon aldehyde of een keton, drijft zelfs een zwakke base het evenwicht naar de producten die 100% enolisatie geven. Dus gaan we elke enolisatie-reactie van de β-dicarbonyls zien als een 100% enolaat en 0% uitgangsmateriaal proces, ongeacht een base.
Waarom is de keuze van een base belangrijk?
Sommige reacties kunnen zeer gevoelig zijn voor wat er in de oplossing zit en wat de concentraties zijn van de reactanten. Zo zijn bijvoorbeeld aldehyden elektrofiel, terwijl enolaten nucleofiel zijn. Dus, als ik een zwakke niet-evenwichtsbasis gebruik die veel van het uitgangsmateriaal in de oplossing laat, kan ik een ongewenste reactie gaan zien tussen een enolaat en een oorspronkelijk aldehyde. In het algemeen zien we zwakke evenwichtsbasen alleen gebruikt worden als er niet veel competitie tussen de mogelijke producten te verwachten is. Als meerdere reacties mogelijk zijn en geen enkel belangrijk product het evenwicht domineert, zullen we altijd sterke niet-evenwichtsbasen gebruiken.
Bulky vs Small Bases
De grootte van een base kan een bepalende factor zijn in het enolisatieproces als meerdere enoliseerbare posities in een molecuul met elkaar concurreren. Laten we eens kijken naar de enolisatie van 2-methylbutanon door twee sterke basen:
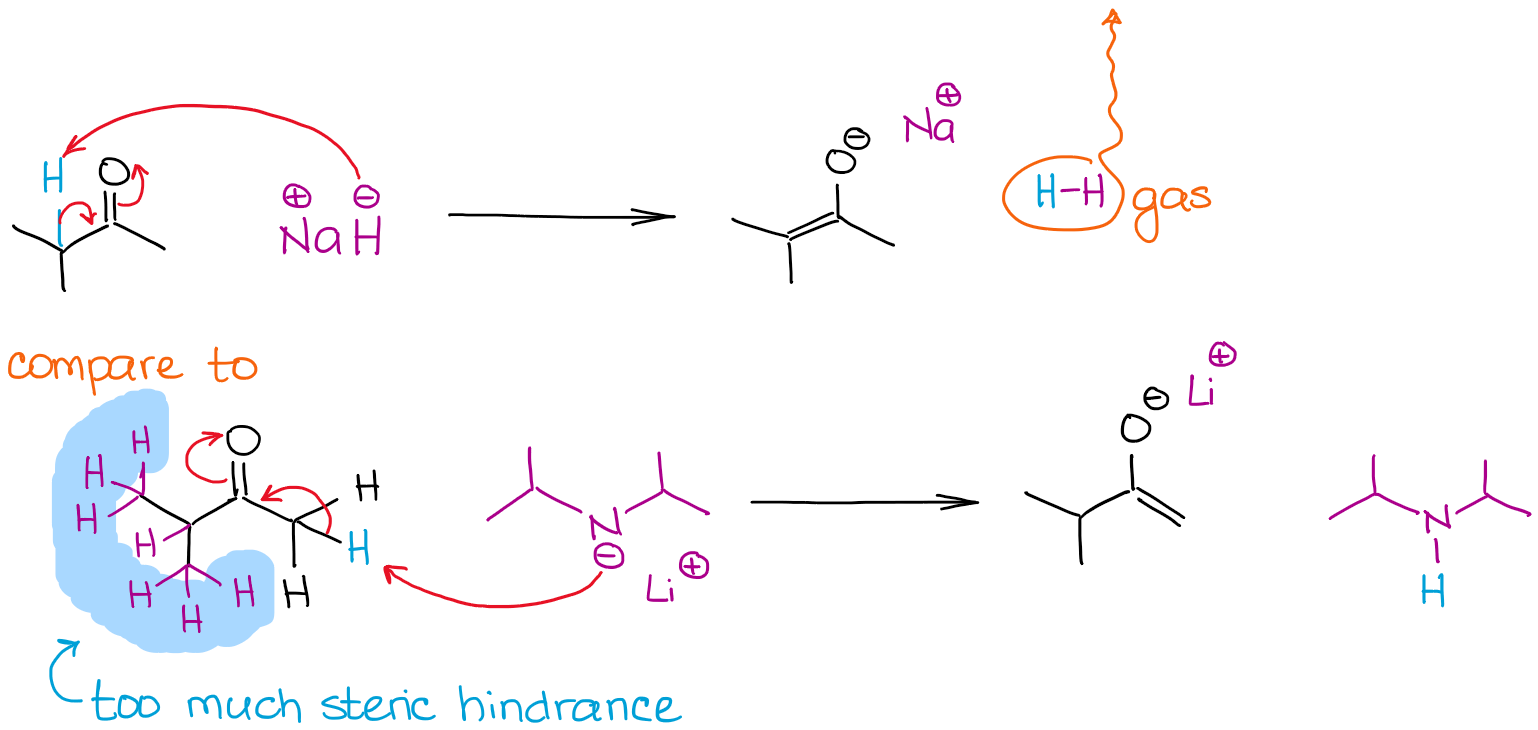
Beide reacties geven 100% enolisatie door het gebruik van zeer sterke niet-evenwichtsbasen. De reactie met natriumhydride (NaH) geeft echter een thermodynamisch stabieler enolaat. In tegenstelling tot LDA is het hydride-anion zeer klein, zodat het gemakkelijk een meer sterisch gehinderd proton kan bereiken en een thermodynamisch enolaat kan geven. LDA is erg volumineus en dus erg gevoelig voor sterische hindernissen. Dit betekent dat het achter minder sterisch gehinderde en meer toegankelijke enoliseerbare hydrogenen aangaat.
Het minder thermodynamisch stabiele enolaat zoals in de reactie met LDA noemen we een kinetisch enolaat. Dit is ook waar de volgorde van de reagensadditie relevant wordt. Om een kinetisch enolaat te krijgen, moet je altijd een carbonyl aan de base toevoegen, en niet andersom! Sommige docenten zijn daar kieskeurig in, dus houd daar rekening mee.
Thermodynamische vs Kinetische enolaten
Ik heb het nu een paar keer over thermodynamische en kinetische enolaten gehad, dus ik denk dat het een goed idee is om daar wat gedetailleerder op in te gaan.
Wat telt precies voor de thermodynamische stabiliteit van een enolaat?
De belangrijkste enolaatresonanten hebben een negatieve lading op het zuurstofatoom en een dubbele C=C binding.
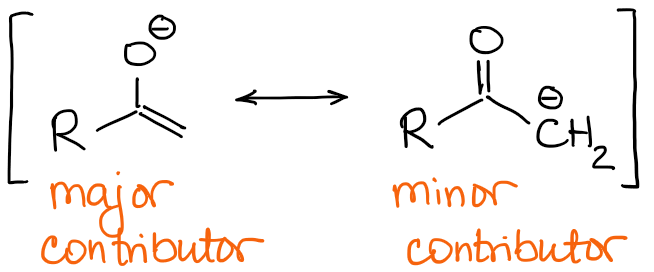
Daarom zal de aard van de dubbele binding het belangrijkste verschil zijn tussen de enolaten. Als we terugkijken naar het voorbeeld met 2-methylbutanon van hierboven, zien we dat de twee mogelijke enolaten een kwalitatief verschillende dubbele binding hebben:

Kijk altijd naar het aantal substituenten op je dubbele binding. Hoe meer substituenten je op een dubbele binding hebt, hoe stabieler deze is. Het thermodynamische enolaat zal dus altijd de drukste dubbele binding hebben.
Een kinetisch enolaat is het enolaat dat zich sneller vormt. Denk maar aan de reactie met LDA. LDA is een zeer sterke niet-evenwichts base. Zodra het het proton afpakt, geeft het het niet meer terug. Het is ook een zeer volumineuze base en het kan geen waterstof uit het midden van het molecuul pakken. Dus gaat hij achter de meer sterisch toegankelijke aan. Een base als LDA grijpt dus snel een proton, van een minder sterisch gehinderde plaats, en geeft het niet terug of laat het evenwicht toe waardoor een minder stabiel enolaat ontstaat.
Waarom is het belangrijk om een carbonyl aan een base toe te voegen om een kinetisch enolaat te maken?
Als je een kinetisch enolaat wilt, moet je base altijd in overmaat zijn. Enolaten zijn zelf basisch! Dus als je een overmaat aan carbonyl hebt, kan het enolaat daar snel een evenwicht mee bereiken.
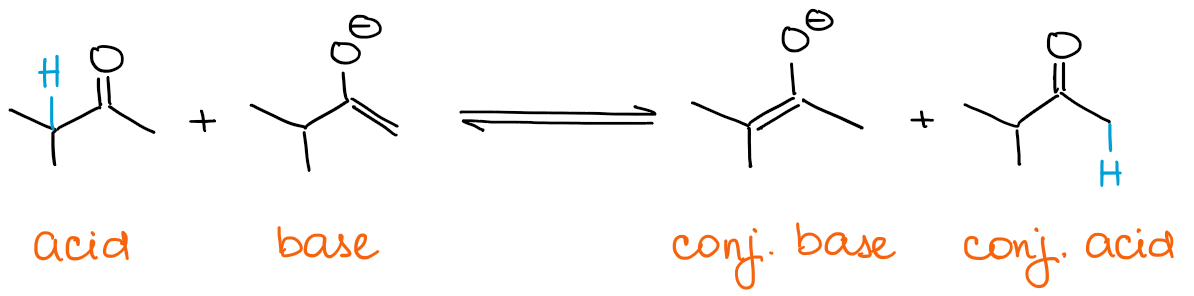
Elk evenwicht zal altijd de voorkeur geven aan thermodynamisch stabielere soorten. Dit betekent dat je altijd een thermodynamisch enolaat krijgt als je een overmaat aan een carbonyl hebt en geen base.
Dus, onthoud dat:
zwakke en kleine sterke basen = thermodynamisch enolaat
Stevige sterke basen = kinetisch enolaat
Door deze eenvoudige vuistregel te gebruiken, kun je bepalen welk enolaat je in je reactie zult hebben of moet maken.
Zuur-gekatalyseerde enolisatie
Aan het begin van dit artikel heb ik al gezegd dat enolisatie ook mogelijk is onder zure omstandigheden. Omdat aldehyden en ketonen niet bijzonder basisch zijn, moet je een zeer sterk zuur gebruiken om dit proces te katalyseren. Gewoonlijk gebruiken we zwavelzuur of tosylzuur als katalysator.
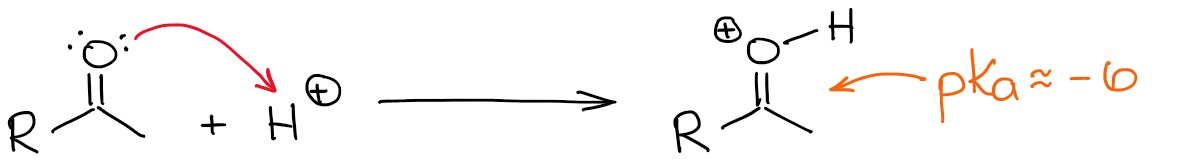
Het zuurste waterstof in een geprotoneerd carbonyl is natuurlijk het waterstof aan de zuurstof. Maar door een C=O binding meer gepolariseerd te maken door er een proton aan toe te voegen, wordt de α-positie ook zuurder. Het is nu dus wat gemakkelijker om de α-positie te deprotoneren en een enol te maken.
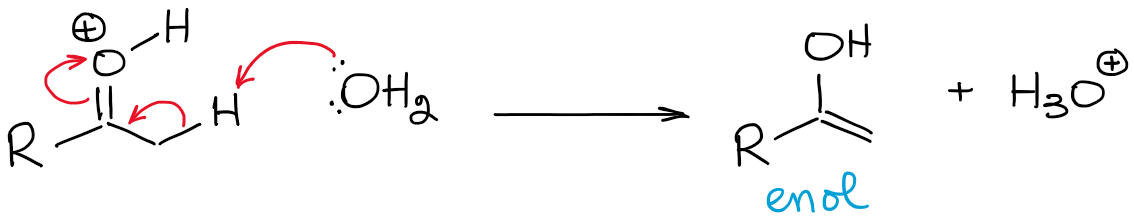
Dit evenwicht is enorm ongunstig en is in het algemeen in het voordeel van de carbonyl. Je zult dus nooit een hoge concentratie enol hebben in zure omstandigheden, tenzij er een soort stabilisatie-effect is dat enol gunstig maakt (zeldzaam).
Hoewel alle mogelijke enolproducten kunnen worden geproduceerd, zal deze reactie altijd de vorming van een thermodynamisch enol begunstigen.
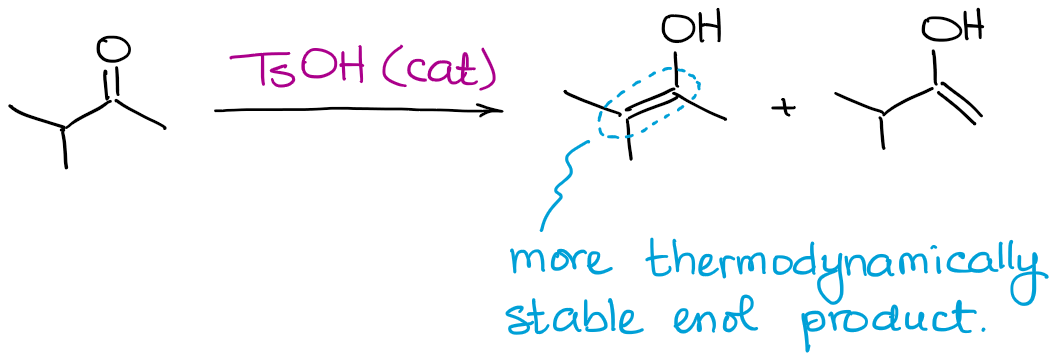
Net als in het geval van enolaten, is een thermodynamisch enol degene die meer substituenten op de dubbele binding heeft.
Welke factoren zijn van invloed op zuur-gekatalyseerde enolisatie?
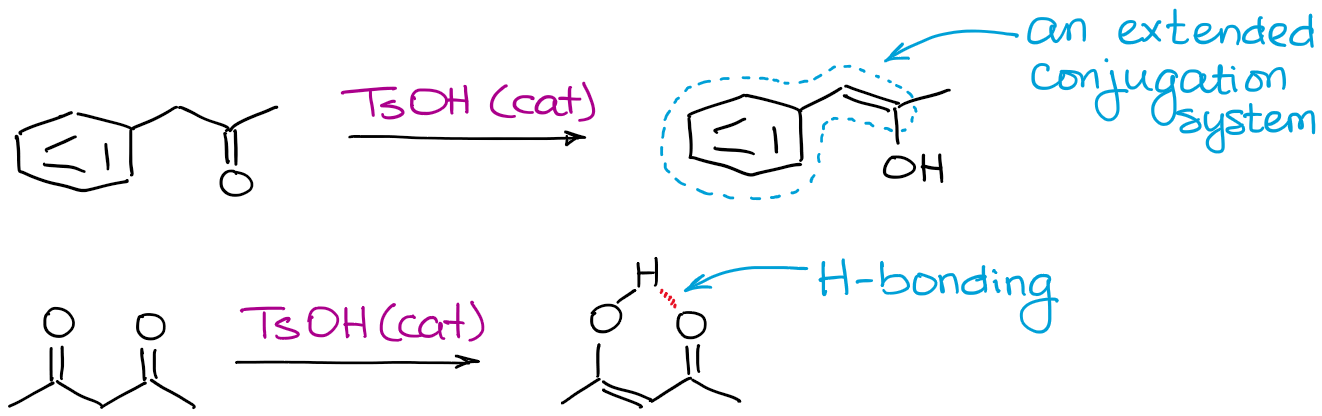
Alles wat een enol stabieler kan maken, komt het evenwicht ten goede. De meest voorkomende factoren zijn de waterstofbruggen en de verlengde conjugatie.
Waarom zure-gekatalyseerde enolisatie als er zoveel problemen mee zijn?
Jouw verbinding kan gevoelig zijn voor basen. Ook is het misschien gemakkelijker om meerdere stappen te combineren als ze onder dezelfde omstandigheden plaatsvinden. Wij combineren vaak zuur-gekatalyseerde enolisatie met andere stappen in een reactie die ook in zure omstandigheden plaatsvinden.
Je moet er wel rekening mee houden dat groepen die elektronen onttrekken in de buurt van een carbonyl het nog minder basisch maken dan het al is. Dus als je bijvoorbeeld een halogeen op de α-positie hebt, zal het heel moeilijk zijn om de vorming van een enol te forceren.

Controleer altijd of er EWG’s in de α-positie voordat u uitgaat van enolvorming! EWG’s die geen resonantiestabilisatie van de dubbele binding bieden, zullen het enolisatieproces sterk tegenwerken.
Wat kun je verwachten op het examen?
Professoren stellen zelden vragen die specifiek gericht zijn op de vorming van enolen of enolaten. Enolisatievragen zullen altijd vermomd zijn als iets anders. Enolisatievragen worden meestal geformuleerd als:
- Vind de zuurste waterstof in het volgende molecuul… of
- Teken het product… (de reactie zal een enol of een enolaat als tussenproduct hebben)
Natuurlijk kunnen ze een directe vraag stellen. Maar mijn ervaring is dat de keto-enol tautomerisatie en enolizaties meestal het onderliggende concept zijn dat een bepaalde vraag aanstuurt.