Eiwit van de maand
November 2006
Meer over het PROTEÏNT van deze MAAND |
|
ANDERE PROTEÏNEN VAN BELANGRIJK |
|
Molecuul van de maand: Fibrine |
|
ExPASy Protein Spotlight |
Bloedstolling, of stolling, is een snelle reactie op weefselschade, waarbij de blootstelling van weefselfactor-bevattende cellen aan de bloedbaan door beschadiging van de vaatwanden een snel cascadesysteem in gang zet. Deze enzymencascade maakt gebruik van een reeks enzymen die snel na elkaar werken om een kleine reactie te versterken tot een grote reactie op de plaats van de beschadiging (zie figuur 1). Eenmaal geactiveerd bindt weefselfactor (TF) zich aan factor VII (FVII) en activeert deze, waardoor de cascade in gang wordt gezet. TF/FVII wordt geactiveerd door auto-cleavage tot TF/FVIIa, dat samen met cofactor FVIIIa FIX omzet in FIXa; FXa kan dan FX omzetten in FXa, dat samen met cofactor FVa FII (protrombine) omzet in FIIa (trombine); tenslotte zet FIIacon fibrinogeen om in fibrine, wat leidt tot fibrineafzetting en de activering van bloedplaatjes om bloedklonters te vormen. De activering van FXIII tot FXIIIa kan deze bloedstolsels stabiliseren door ze te verknopen.
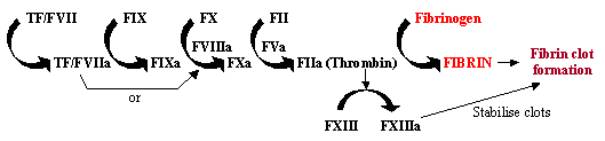
Figuur 1. Bloedstollingscascade
Fibrinogeen,Afronding van de stollingscascade
Fibrinogeen werd voor het eerst geïsoleerd uit paardenplasma door Hammarsten in 1876, hoewel een inactieve voorloper van fibrine al in 1859 door Deni deCommercy werd voorgesteld. Fibrinogeen kan een merkbare transformatie ondergaan van oplosbare monomeren (fibrogeen) tot een onoplosbare polymeergel (gepolymeriseerd fibrine).
Fibrinogeen is een in de lever gesynthetiseerd plasmaglycoproteïne dat essentieel is voor hemostase (het stoppen van bloedverlies uit beschadigde weefsels), wondgenezing, fibrinolyse, ontsteking, angiogenese, cellulaire en matrixinteracties en neoplasie. Deze processen omvatten de omzetting van fibrinogeen in fibrine, en vaak de interactie van fibrine(ogen) met verschillende eiwitten en cellen. Mensen hebben gewoonlijk ongeveer 2,5 g fibrinogeen/L bloed, maar de concentratie van fibrinogeen kan in fysiologische stressperioden met 200-400% toenemen (vooral door de werking van interleukine-6, dat van macrofagen afkomstig is).
Fibrinogeen is een groot, complex glycoproteïne dat bestaat uit drie paren polypeptiden: twee Aa’s, twee Bb’s en twee g’s. Deze polypeptiden zijn met elkaar verbonden door 29 disulfidebindingen, waarvan er enkele zijn afgebeeld in figuur 2 hieronder. De polypeptiden zijn zo georiënteerd dat alle zes N-terminale uiteinden samenkomen om het centrale E-domein te vormen. Twee regio’s van opgerolde alfa-helixen strekken zich uit aan weerszijden van het E-domein, elk bestaande uit één Aa, één Bb en één gpolypeptide. Elk spiraalvormig gebied eindigt in een bolvormig D-domein dat bestaat uit de C-terminale uiteinden van Bb en g, alsmede een deel van Aa. Het C-terminale uiteinde van Aa steekt dan uit elk D-domein als een lange streng; deze Aa-uitsteeksels kunnen met elkaar en met het E-domein interageren tijdens de cross-linking van de fibrinestolsel. Zowel het E- als het D-domein bevatten belangrijke bindingsplaatsen voor de omzetting van fibrinogeen in fibrine, voor fibrine-assemblage en cross-linking, en voor bloedplaatjesaggregatie. Gebonden calciumionen zijn belangrijk om de structuur van fibrinogeen in stand te helpen houden.
De N-terminale uiteinden van zowel de Aa als de Bb polypeptiden worden door trombine gesplitst om oplosbaar fibrinogeen om te zetten in gel-vormend fibrine. Eenmaal van fibrinogeen gesplitst, staan de N-terminale uiteinden bekend als fibrinopeptide A (van Aapolypeptide) en fibrinopeptide B (van Bbpolypeptide).
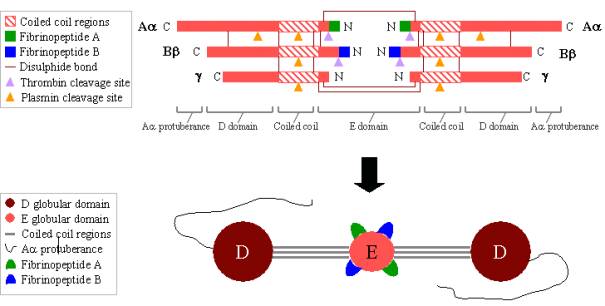
Figuur 2. Fibrinogeen:
TOP – polypeptide organisatie van fibrinogeen.
BOTTOM – domein organisatie van fibrinogeen.
Bloedstolselvorming
Om een bloedstolsel te vormen, moet fibrinogeen eerst worden gesplitst door trombine om de fibrinopeptiden te verwijderen. Door de verwijdering van de fibrinopeptiden A en B van de N-terminale uiteinden van Aa en Bb komen ‘noppen’ op het E-domein vrij, die kunnen interageren met de ‘gaten’ die altijd aanwezig zijn op de D-domeinen. Fibrinemoleculen kunnen aan elkaar worden gekoppeld door de interactie van het E-domein op één fibrinemolecuul met de D-domeinen op vier andere fibrinemoleculen, waardoor polymerisatie optreedt en oligomeren ontstaan die zich ophopen tot protofibrillen. Naarmate de fibrine-oligomeren aggregeren, worden deze protofibrillen langer en vormen lange vezels die zich om elkaar heen kunnen wikkelen tot meerstrengige, dikke bundels, en die zich kunnen vertakken tot een driedimensionaal netwerk van verstrengelde vezels, de fibrinestolsel. De fibrinestolsel wordt vervolgens gestabiliseerd door Factor XIIIa, een transglutaminase, waarbij de zymogeenvorm van Factor XIII wordt omgezet in actieve Factor XIIIa door de werking van trombine (zie figuur 1). Factor XIII bindt de glutamine residuen op een fibrine molecuul aan de lysine residuen op een ander fibrine molecuul door sterke isopeptide bindingen te vormen. Deze cross-linking vindt plaats tussen de C-terminale uiteinden (Aa-uitsteeksels) van de Aa-polypeptiden, alsmede (langzamer) op andere plaatsen, zoals tussen de C-terminale uiteinden van g-ketens. Deze cross-links helpen de fibrinestolsel te versterken, waardoor het beter bestand is tegen fysieke en chemische schade.
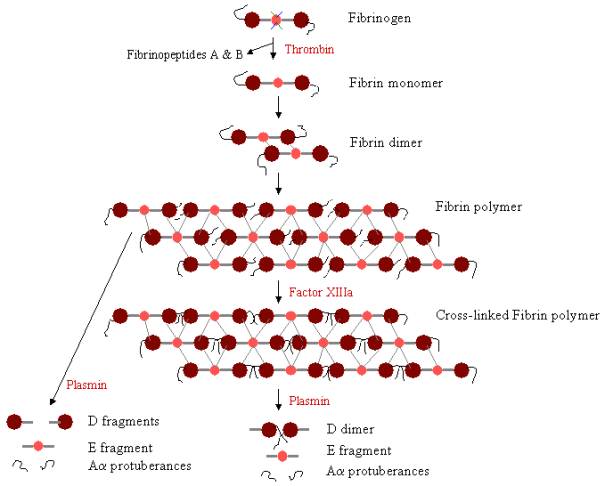
Figuur 3. Polymerisatie en lysis van fibrine: Baan van fibrinepolymerisatie en afbraak. De noppen op het E-domein binden zich aan de gaten op maximaal vier D-domeinen (grijze lijnen), waardoor een lang, vezelig rasterwerk wordt gevormd. De klonter wordt vervolgens gestabiliseerd door cross-linking. Het stolsel kan worden afgebroken, waarbij verschillende afbraakproducten ontstaan als het is verknoopt.