Massaspectrometrie is een analysetechniek waarbij monsters worden geïoniseerd tot geladen moleculen en de verhouding tussen hun massa en lading (m/z) kan worden gemeten. In MALDI-TOF-massaspectrometrie is de ionenbron matrix-assisted laser desorption/ionization (MALDI), en de massa-analysator is time-of-flight (TOF) analyzer.
MALDI
MALDI is een zachte ionisatie waarbij een laser een matrix van kleine moleculen treft om de analytmoleculen in de gasfase te brengen zonder ze te fragmenteren of te ontleden. Sommige biomoleculen zijn te groot en kunnen ontleden bij verhitting, en traditionele technieken zullen macromoleculen fragmenteren of vernietigen. MALDI is geschikt voor de analyse van biomoleculen zoals peptiden, lipiden, sachariden of andere organische macromoleculen.
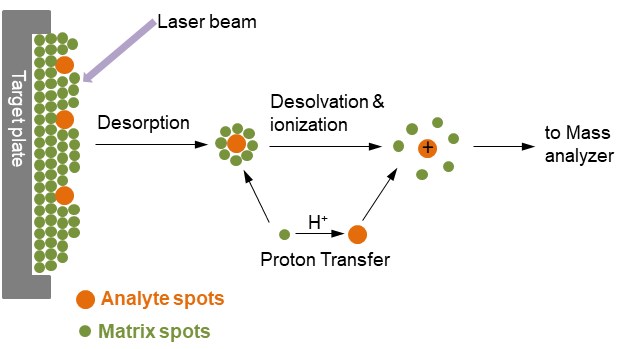
Figuur 1. Ionisatie van analyten door MALDI
- Het principe van MALDI
In figuur 1 is de analyt ingebed in een zeer grote overmaat van een matrixverbinding die is afgezet op een vast oppervlak dat een target wordt genoemd, meestal gemaakt van een geleidend metaal en voorzien van spots voor verschillende aan te brengen monsters. Na een zeer korte laserpuls wordt de bestraalde plek snel verhit en trilling geëxciteerd. De matrixmoleculen die energetisch van het oppervlak van het monster worden weggeslingerd, absorberen de laserenergie en brengen de analytmoleculen ook in de gasfase. Tijdens het ablatieproces worden de analytmoleculen gewoonlijk geïoniseerd door protonering of deprotonering met de nabijgelegen matrixmoleculen. Het meest gebruikelijke MALDI-ionisatieformaat is dat de analysemoleculen een enkele positieve lading dragen.
- Soorten lasers die gewoonlijk in MALDI worden gebruikt
Lasers van zowel ultraviolette (UV) als infrarode (IR) golflengten worden gebruikt, maar UV-lasers zijn verreweg de belangrijkste lichtbronnen in analytische MALDI. Daaronder zijn stikstoflasers en frequentie-verdrievoudigde of -viervoudige Nd: Yag-lasers vaak geschikt voor de meeste toepassingen. IR-MALDI wordt gedomineerd door Er:Yag-lasers, terwijl TEA-CO2-lasers zelden worden gebruikt.
- Gewoonlijk gebruikte MALDI-matrixstof
Aangenomen wordt dat de eerste functie van de matrix in wezen is de analytmoleculen te verdunnen en van elkaar te isoleren. Dit gebeurt tijdens de verdamping van het oplosmiddel en de gelijktijdige vorming van een vaste oplossing. Vervolgens fungeert de matrix bij bestraling door de laser als bemiddelaar voor de energieabsorptie. De keuze van de juiste matrix is de sleutel tot het succes bij MALDI. In het algemeen, zeer polaire analyten beter werken met zeer polaire matrices, en niet polaire analyten worden bij voorkeur gecombineerd met niet polaire matrices. Zoals blijkt uit tabel 1, verschillende matrices zijn gezocht en op grote schaal gebruikt. Momenteel zijn de meest gebruikte matrices zijn α-cyano-4-hydroxycinnamzuur, 2,5-dihydroxybenzoëzuur, 3,5-dimethoxy-4-hydroxycinnamzuur, en 2,6-dihydroxyacetofenon.
Tabel 1. UV-MALDI-matrices (Gross J. H., 2006)
| Compound | Acronym | Toepassing op |
|---|---|---|
| Nicotinezuur | NA | Peptiden, eiwitten |
| Picolinezuur | PA | Oligonucleotiden, DNA |
| 3-Hydroxypicolinezuur | HPA, 3-HPA | Oligonucleotiden, DNA |
| 3-Aminopicolininezuur | 3-APA | Oligonucleotiden, DNA |
| 6-Aza-2-thiothymine | ATT | Oligonucleotiden, DNA |
| 2,5-Dihydroxybenzoëzuur | DHB | Proteïnen, oligosacchariden |
| mengsels op basis van DHB | DHB/XY en super-DHB | Proteïnen, oligosacchariden |
| 3-Aminoquinoline | 3-AQ | Oligosacchariden |
| α-Cyano-4-hydroxycinnamzuur | α-CHC, α-CHCA, 4-HCCA, CHCA | Peptiden, kleinere eiwitten, triacylglycerolen, talrijke andere verbindingen |
| 4-Chloro-α-cyano-kaneelzuur | ClCCA | Peptiden |
| 3,5-Dimethoxy-4-hydroxycinnamzuur | SA | Proteïnen |
| 2-(4-Hydroxyfenylazo)benzoëzuur | HABA | Peptiden, eiwitten, glycoproteïnen, polystyreen |
| 2-Mercaptobenzothiazool | MBT | Peptiden, eiwitten, synthetische polymeren |
| 5-Chloro-2-mercaptobenzothiazole | CMBT | Glycopeptiden, fosfopeptiden, en eiwitten |
| 2,6-Dihydroxyacetofenon | DHAP | Glycopeptiden, fosfopeptiden, eiwitten |
| 2,4,6-Trihydroxyacetofenon | THAP | Vaste-ondersteunde oligonucleotiden |
| Dithranol (1,8,9-anthracenetriol) | Nee | Synthetische polymeren |
| 9-Nitroanthraceen | 9-NA | Fullerenen en derivaten |
| Benzopyreen | Neen | Fullerenen en derivaten |
| 2-malonitril | DCTB | Oligomeren, polymeren, dendrimeren, kleine moleculen |
Time of Flight (TOF) analyzer
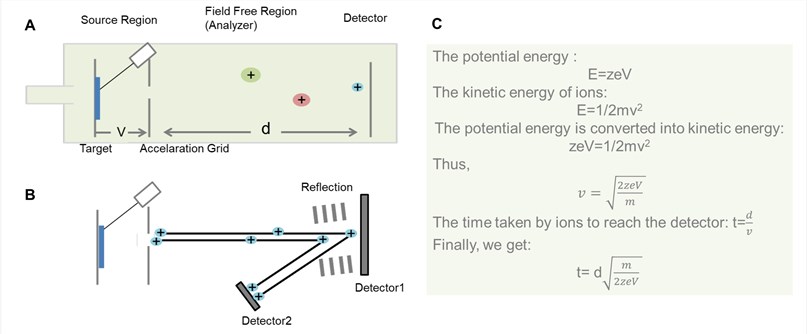
Figuur 2. Algemeen schema voor TOF-analysator. (A) Liner TOF-analysator; (B) Reflector TOF-analysator; (C) Het afleidingsproces van de tijd dat ionen door het veldvrije gebied in de liner TOF-analysator passeren.
- Het principe van TOF
Zoals in figuur 2 is te zien, is het basisprincipe van TOF dat ionen met verschillende m/z tijdens hun vlucht over een veldvrij driftpad van bekende lengte in de tijd worden verspreid. Op voorwaarde dat alle ionen hun reis op hetzelfde tijdstip beginnen of ten minste binnen een voldoende kort tijdsinterval, zullen de lichtere ionen eerder bij de detector aankomen dan de zwaardere.
- Liner TOF-analysator en reflectron TOF-analysator
Theoretisch krijgen alle ionen dezelfde initiële kinetische energie, zodat na het driften langs het veldvrije gebied de ionen met dezelfde m/z op hetzelfde tijdstip bij de detector zijn. In de praktijk wordt de puls echter niet door alle ionen met dezelfde intensiteit gevoeld, zodat niet alle ionen met dezelfde m/z-waarden hun ideale snelheid bereiken. Om dit probleem te corrigeren wordt aan het eind van de driftzone vaak een reflectron aangebracht. Het reflectron bestaat uit een reeks ringelektroden met een hoge spanning, die de ionen langs de vluchtbuis kunnen terugstoten, meestal onder een licht verplaatste hoek.
Ionen met verschillende kinetische energie dringen tot verschillende diepten in het reflectron door voordat zij uit het reflectron in de tegenovergestelde richting worden uitgestoten. Snellere ionen met meer kinetische energie zullen een langere weg afleggen dan langzamere, en dus meer tijd in het reflectron doorbrengen dan langzamere ionen met minder energie. Op die manier ontvangt de detector ionen met dezelfde massa op (ongeveer) hetzelfde moment. Daardoor heeft dit ontwerp voor TOF-massa-analysatoren hun resolutie aanzienlijk verhoogd. Reflectron TOF analyzer is echter niet geschikt voor analyten die niet stabiel genoeg zijn om het elektrische veld te overleven.
Het proces van MALDI-TOF massaspectrometrie
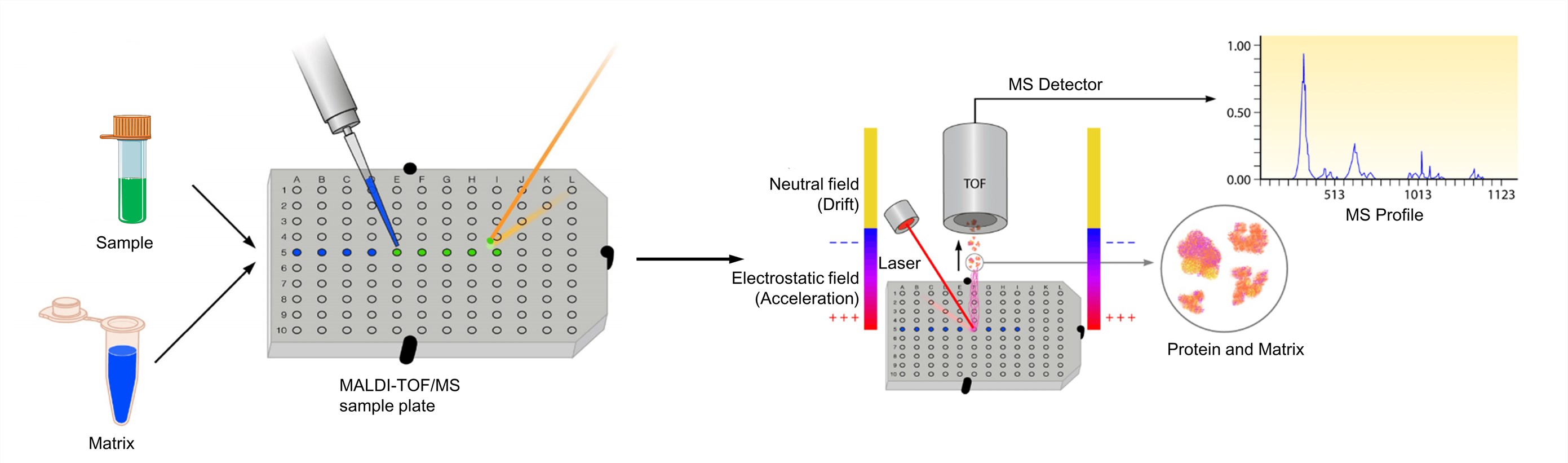
Figuur 3. Het proces van MALDI-TOF-massaspectrometrie (Clark A. E., et al.; 2013)
De analyt moet oplosbaar zijn tot ten minste ongeveer 0,1 mg/ml in een of ander oplosmiddel. En de matrix wordt opgelost om een verzadigde oplossing of een concentratie van ongeveer 10 mg/ml te verkrijgen. De oplossing van de analyt wordt vervolgens bij die van de matrix gevoegd. Voor geoptimaliseerde MALDI-spectra wordt de molaire matrix/analyt-verhouding normaal gesproken zo ingesteld dat deze tussen 1000:1 en 100.000:1 ligt. Vervolgens wordt het mengsel voor analyse op een metalen richtplaat gespot. Na het drogen kristalliseert het mengsel van monster en matrix en vormt het een vaste afzetting van het monster dat in de matrix is ingebed. De plaat wordt vervolgens in het MALDI-TOF-instrument geladen en geanalyseerd door software die bij het desbetreffende systeem hoort. De MALDI leidt tot de sublimatie en ionisatie van zowel het monster als de matrix. Deze gegenereerde ionen worden afhankelijk van m/z gescheiden door een TOF-analysator, en een spectrale weergave van deze ionen wordt gegenereerd en geanalyseerd door de MS-software, waardoor een MS-profiel wordt gegenereerd.
Toepassing van MALDI-TOF-massaspectrometrie
- Intacte massabepaling
De intacte massabepaling is fundamenteel en belangrijk voor eiwitkarakterisering, omdat het juiste molecuulgewicht van een eiwit de intacte structuur kan aangeven. MALDI, een zachte ionisatietechniek, is geschikt voor eiwitten die de neiging hebben kwetsbaar te zijn en te fragmenteren wanneer ze met andere ionisatiemethoden worden geïoniseerd. De prestaties van MALDI-TOF MS wordt minder beïnvloed door buffercomponenten, detergenten en verontreinigingen. Bovendien maakt het mogelijk intact eiwit massa bepaling met voldoende nauwkeurigheid (≤ 500 ppm) voor sequentie validatie. Na eiwit digestie, kan MALDI-TOF MS ook worden gebruikt om de verkregen peptiden te analyseren voor verdere primaire sequentie bevestiging door peptide mass fingerprinting.
- Peptide mass fingerprinting (PMF)
MALDI-TOF massaspectrometrie heeft een eenvoudige bediening, goede massanauwkeurigheid, alsmede een hoge resolutie en gevoeligheid. Daarom wordt deze techniek op grote schaal toegepast in de proteomica om eiwitten uit eenvoudige mengsels te identificeren met behulp van een methode die peptide mass fingerprinting wordt genoemd en die vaak wordt gebruikt in combinatie met tweedimensionale gelelektroforese (2-DE). In deze benadering worden peptiden gegenereerd door eiwitten van belang te verteren met een sequentie-specifiek enzym zoals trypsine. Vervolgens worden de peptiden geanalyseerd met MALDI-TOF massaspectrometrie om de peptidemassa’s te verkrijgen. De experimentele massa’s worden vergeleken met een database met theoretische peptidemassa’s van een bepaald organisme met hetzelfde sequentiespecifieke protease.
- Post source decay (PSD) MALDI-TOF analyse
MALDI-TOF massaspectrometers die zijn uitgerust met reflectronen kunnen fragmentionen analyseren die worden geproduceerd uit precursorionen die tijdens de vlucht spontaan uiteenvallen. Dergelijke ionen worden over het algemeen metastabiele ionen genoemd, en het proces van ontleding in het veldvrije gebied tussen de ionenbron en het reflectron wordt over het algemeen PSD genoemd. PSD-fragmentionen worden in het veldvrije gebied gevormd voordat zij het reflectron ingaan. PSD fragmentionen kunnen worden gescheiden, verzameld en opgenomen op de detector door continu de reflectorspanning te veranderen om een PSD massaspectrum te vormen dat zeer rijke en effectieve structurele informatie geeft voor de primaire structuur van peptiden en eiwitten. In het proteomics-onderzoek kunnen sommige 2DE-gescheiden eiwitmonsters niet door PMF worden geïdentificeerd of de resultaten van de identificatie zijn niet duidelijk. De PSD sequencing functie kan worden toegepast voor de identificatie van deze eiwitten. Met behulp van PSD-spectroscopie, gecombineerd met een database-zoekopdracht, kunnen eiwitten snel en met hoge specificiteit worden geïdentificeerd.
- Oligonucleotidenanalyse
Met de ontwikkeling van moleculaire biologietechnieken en antisense-nucleotidetechnologieën zijn er steeds meer oligonucleotidefragmenten gesynthetiseerd die worden gebruikt als primers, probes en antisense-medicijnen. Het is absoluut noodzakelijk deze fragmenten snel te detecteren om te bepalen of de synthese voltooid is en of de gesynthetiseerde sequentie correct is. Massaspectrometrie, met inbegrip van MALDI-TOF-MS, is veruit het beste middel om dit te doen. Oligonucleotide-analyse met behulp van MALDI-TOF-MS is eenvoudig, snel, nauwkeurig en gevoelig, zodat de volledige oligonucleotide-sequentie kan worden bepaald.
- MALDI-beeldvorming
De MALDI-TOF kan worden gebruikt bij de profilering en beeldvorming van eiwitten rechtstreeks uit dunne weefselcoupes, bekend als MALDI-beeldvormende massaspectrometrie (MALDI-IMS). Het levert specifieke informatie over de lokale moleculaire samenstelling, de relatieve abundantie en de ruimtelijke distributie van peptiden en eiwitten in de geanalyseerde sectie. MALDI-IMS kan analyseren meerdere onbekende verbindingen in biologisch weefsel secties tegelijk door middel van een enkele meting die molecuul beeldvorming van het weefsel kan verkrijgen met behoud van de integriteit van cellen en moleculen in weefsels.
MALDI-TOF massaspectrometrie kan analyseren een breed scala van biomoleculen, zoals peptiden, eiwitten, koolhydraten, oligonucleotide, enzovoort. Doordat gevormde ionen een lage inwendige energie hebben, is een groot voordeel van MALDI-TOF dat het proces van zachte ionisatie observatie van geïoniseerde moleculen met weinig fragmentatie van analyten mogelijk maakt, waardoor de moleculaire ionen van analyten kunnen worden geïdentificeerd, zelfs binnen mengsels. Bovendien is het gemakkelijk te gebruiken en te onderhouden met snelle gegevensverwerving. De keuze van de juiste matrixstof is belangrijk voor succesvolle MALDI-TOF massaspectrometrie.
Bij Creative Proteomics kunnen we verschillende diensten leveren op basis van onze geavanceerde MALDI-TOF massaspectrometrie platforms, waaronder:
- Moleculaire Massabepaling
- Peptide Mass Fingerprinting (PMF)
- Imaging Mass Spectrometry (IMS)
1. Gross J H. Massaspectrometrie: een leerboek. Springer Science & Business Media, 2006.
2. Boesl U. Tijd – van – vlucht massaspectrometrie: Inleiding tot de basisprincipes. Massaspectrometrie reviews, 2017, 36(1): 86-109.
3. Guerrera I C, Kleiner O. Toepassing van massaspectrometrie in proteomics. Bioscience Reports, 2005, 25(1-2): 71-93.
4. Fuchs B, Schiller J. Toepassing van MALD – TOF massaspectrometrie in lipidomics. European Journal of Lipid Science and Technology, 2009, 111(1): 83-98.
5. Duncan M W, Roder H, Hunsucker S W. Kwantitatieve matrix-geassisteerde laser desorptie/ionisatie massaspectrometrie. Briefings in functional genomics and proteomics, 2008, 7(5): 355-370.
6. Kenny D J, Brown J M, Palmer M E, et al. A parallel approach to post source decay MALDI-TOF analysis. Journal of the American Society for Mass Spectrometry, 2006, 17(1): 60-66.