Motiliteit is het vermogen van een organisme om zichzelf voort te bewegen door middel van propellorachtige flagellen die uniek zijn voor bacteriën of door speciale fibrillen die een glijdende vorm van motiliteit produceren. Motiele bacteriën bewegen zich voort met behulp van flagella, draadvormige voortbewegingsaanhangsels die zich naar buiten uitstrekken vanuit het plasmamembraan en de celwand, hetzij met een enkel flagellum, hetzij met meerdere flagella. Motiliteit wordt al lang erkend als een belangrijk taxonomisch hulpmiddel en een biologisch kenmerk van micro-organismen. De aanwezigheid van flagellen komt vooral voor bij bacillen, maar er zijn ook enkele gevlagelleerde cocci, zodat motiliteit een zeer belangrijk identificatiemiddel is in de familie van de Enterobacteriaceae. Vanaf het begin van de microbiologie is het vermogen van bacteriën om zich te verplaatsen gebruikt als middel om organismen te onderscheiden en te classificeren.
Doel
- De beweeglijkheid van bacteriën bepalen.
- Het onderscheid maken tussen beweeglijke en niet-beweeglijke bacteriën.
Uitgangspunt
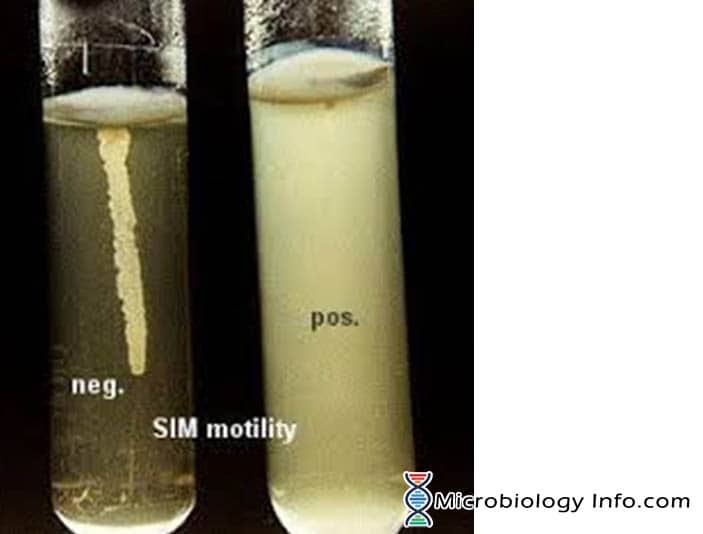
De beweeglijkheid van bacteriën wordt meestal aangetoond in een semivaste agarbodem. In halfvaste agar-media ‘zwermen’ beweeglijke bacteriën en geven een diffuse spreidende groei die gemakkelijk met het blote oog kan worden herkend. Het medium dat hoofdzakelijk voor dit doel wordt gebruikt is SIM-medium (Sulphide Indole Motility medium) dat een gecombineerd differentieel medium is dat drie verschillende parameters test, namelijk zwavelreductie, indoolproductie en beweeglijkheid. Dit medium heeft een zeer zachte consistentie waardoor beweeglijke bacteriën gemakkelijk kunnen migreren en troebel worden. Het inoculum wordt in het midden van een halfvaste agardiepte gestoken. De beweeglijkheid van de bacteriën blijkt uit een diffuse groeizone die zich uitstrekt vanaf de inoculatielijn. Sommige organismen groeien in het gehele medium, terwijl andere kleine gebieden of knobbeltjes vertonen die vanaf de inoculatielijn naar buiten groeien. De niet-motiele bacteriën groeien alleen in de zachte agarbuis en alleen in het gebied waar zij zijn geïnoculeerd.
Media:
SIM Medium
Pancreatisch digest van caseïne 20,0g, Peptisch digest van dierlijk weefsel 6,1g, Agar 3,5g, Fe(NH4)2(SO4)2-6H2O 0.2g, Na2S2O3-5H2O 0.2g, pH 7.3 ± 0.2 bij 25°C
Methode
- Raak met een rechte naald een kolonie van een jonge (18 tot 24 uur) kweek aan die op agarmedium groeit.
- Stok eenmaal tot een diepte van slechts 1/3 tot ½ inch in het midden van het buisje. Zorg ervoor dat de naald in dezelfde lijn blijft als waarin hij is gestoken wanneer hij uit het medium wordt verwijderd.
- Incubeer bij 35°-37°C en onderzoek dagelijks gedurende maximaal 7 dagen.
- Zoek naar een diffuse groeizone die uitwaaiert vanaf de inoculatielijn.
Verwachte resultaten
- Positief: Diffuse, wazige groei die zich over het hele medium verspreidt, waardoor het licht ondoorzichtig wordt.
- Negatief: Groei die beperkt is tot de steeklijn, met scherp omlijnde randen en die het omringende medium duidelijk transparant laat.
Toepassingen
- Het wordt gebruikt voor de differentiatie van micro-organismen op basis van beweeglijkheid in een laboratoriumomgeving.
- Het wordt uitgevoerd om taxonomische classificatie aan organismen toe te kennen.
- Motiliteitstests zijn belangrijk bij de karakterisering van pathogenen.
- De tests worden vaak gebruikt in identificatieprotocollen in de familie Enterobacteriaceae
- Motiliteitstest wordt ook gebruikt voor de soortendifferentiatie van grampositieve cocci, Enterococci. Enterococcus faecium en E. faecalis zijn niet beweeglijk, terwijl E. gallinarum en E. casseliflavus/E. flavescens in het algemeen wel beweeglijk zijn.
Beperkingen
- Sommige organismen zullen in dit medium niet voldoende groei vertonen om een nauwkeurige bepaling te doen, en extra vervolgonderzoek is vereist.
- Het verdient aanbeveling biochemische, immunologische, moleculaire of massaspectrometrische tests uit te voeren op kolonies uit reincultuur voor een volledige identificatie.
- Vals-negatieve reacties kunnen optreden als bacteriële flagella’s zijn beschadigd door verhitting, schudden of ander trauma. Een dergelijke omgevingsschok zal het organisme niet-motiel maken.
- Organismen die zwak beweeglijk zijn, kunnen vals-negatieve reacties geven.
- Bij het enten van halfvaste media is het belangrijk dat de entnaald precies langs dezelfde lijn wordt verwijderd als bij het enten van het medium. Een uitwaaierende beweging kan leiden tot groei langs de steeklijn die kan resulteren in vals-positieve interpretatie.
- Tille, P. M., & Forbes, B. A. (2014). Bailey & Scott’s diagnostische microbiologie (Dertiende druk.). St. Louis, Missouri: Elsevier.
- Cappuccino J.G. and Sherman N. 2008. Microbiologie: A Laboratory Manual, 8e ed. Pearson Benjamin Cummings, San Francisco, CA, USA.
- vlab.amrita.edu/?sub=3&brch=73&sim=697&cnt=1
- www.asmscience.org/content/education/protocol/protocol.3658
- https://catalog.hardydiagnostics.com/cp_prod/Content/hugo/MotilityTestMedia.htm