Soorten aminenEdit
Aminen kunnen primair, secundair of tertiair zijn, afhankelijk van het aantal koolstofhoudende groepen dat er aan vastzit. Als er slechts één koolstofhoudende groep is (zoals in het molecuul CH3NH2), dan wordt dat amine als primair beschouwd. Twee koolstofhoudende groepen maakt een amine secundair, en drie groepen maakt het tertiair. Gebruikmakend van het lone elektronenpaar van stikstof, is het soms energetisch gunstig om de stikstof als nucleofiel te gebruiken en zo een vierde koolstofhoudende groep aan het amine te binden. In dit geval zou het een quaternair ammoniumion genoemd kunnen worden.
Primair amine:
 |
Secundair amine:
 |
Tertiaire amine:
 |
Een organische verbinding met meerdere aminegroepen wordt een diamine genoemd, triamine, tetraamine enzovoort, gebaseerd op het aantal aminegroepen (ook wel aminogroepen genoemd) dat aan het molecuul vastzit. De chemische formule voor methyleendiamine (ook diaminomethaan genoemd), bijvoorbeeld, zou als volgt zijn H2N-CH2-NH2
Aromatische aminenEdit
Aromatische aminen hebben het stikstofatoom direct verbonden met een aromatische ringstructuur. Door zijn elektrononttrekkende eigenschappen vermindert de aromatische ring de basische werking van het amine sterk – en dit effect kan worden versterkt of tenietgedaan, afhankelijk van de substituenten op de ring en op de stikstof. De aanwezigheid van het eenzame elektronenpaar van de stikstof heeft het tegenovergestelde effect op de aromatische ring zelf; omdat het stikstofatoom elektronendichtheid aan de ring kan “lenen”, wordt de ring zelf veel reactiever voor andere soorten chemie.
NaamgevingsconventiesEdit
Voor primaire aminen, waarbij het amine niet de voornaamste kenmerkende groep is, wordt het voorvoegsel “amino-” gebruikt. Bijvoorbeeld: 4-aminobenzoëzuur, waarbij het carboxylzuur het hoofdkenmerk is. In andere gevallen wordt het achtervoegsel “-amine” gebruikt met hetzij de hybride van de oudergroep, hetzij de naam van de R-groepsubstituent. Voorbeeld: ethanamine of ethylamine. Als alternatief kan het achtervoegsel “-azaan” worden toegevoegd aan de naam van de R-groepsubstituent: voorbeeld: propylazaan.
Voor secundaire, tertiaire en kwartnaire aminen is de naamgevingsconventie een beetje anders, maar de achtervoegsels zijn hetzelfde. Voor symmetrische aminen wordt het voorvoegsel “di” of “tri” gebruikt, afhankelijk van het feit of er 2 of 3 substituenten zijn. Zo is dipropylamine een secundair amine, en trifenylamine een tertiair amine. Voor asymmetrische aminen krijgt de moederketen het achtervoegsel “-amine”. Deze naam wordt dan voorafgegaan door “N-” (ter aanduiding van de stikstofverbinding) en de naam van de substituentgroep, voor elke substituent, in alfabetische volgorde voor tertiaire amiden. Bijvoorbeeld: N-ethyl-N-methyl-propylamine, niet N-methyl-N-ethyl-propylamine.
Om samen te vatten:
- als voorvoegsel: “amino-“
- als achtervoegsel: “-amine”
- het voorvoegsel “N-” duidt op substitutie op het stikstofatoom (in het geval van secundaire, tertiaire en quaternaire aminen)
Systematische namen voor enkele veelvoorkomende aminen:
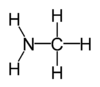
methylamine
- Primaire aminen: ethanamine of ethylamine.
- secundaire aminen: dimethylamine
- Tertiaire aminen: trimethylamine
Fysische eigenschappenEdit
Zoals te verwachten is, heeft de aanwezigheid van een heteroatoom als stikstof in verder uitsluitend koolstof- en waterstofmoleculen een grote invloed op de eigenschappen van aminen in vergelijking met alkanen.
Algemene eigenschappenEdit
Hydrogenering beïnvloedt de eigenschappen van primaire en secundaire aminen en de geprotoneerde derivaten van alle aminen aanzienlijk. Zo ligt het kookpunt van aminen hoger dan dat van de overeenkomstige fosfines (fosforhoudende verbindingen), maar in het algemeen lager dan dat van de overeenkomstige alcoholen. Alcoholen, of alkanolen, lijken op aminen maar hebben een -OH groep in plaats van NR2. Aangezien zuurstof elektronegatiever is dan stikstof, is RO-H doorgaans zuurder dan de verwante verbinding R2N-H.
Methyl-, dimethyl-, trimethyl-, en ethylaminen zijn gassen onder standaardomstandigheden. De meeste gangbare alkylaminen zijn vloeistoffen, en aminen met een hoog molecuulgewicht zijn bij standaardtemperatuur uiteraard vaste stoffen. Bovendien hebben gasvormige aminen een karakteristieke ammoniakgeur, terwijl vloeibare aminen een kenmerkende “visachtige” geur hebben.
De meeste alifatische aminen zijn enigszins oplosbaar in water, wat wijst op hun vermogen waterstofbruggen te vormen. De oplosbaarheid neemt relatief evenredig af met de toename van het aantal koolstofatomen in het molecuul – vooral wanneer het aantal koolstofatomen groter is dan zes. Alifatische aminen vertonen ook een aanzienlijke oplosbaarheid in organische oplosmiddelen, vooral in polaire organische oplosmiddelen. Primaire amines reageren echter gemakkelijk met ketonverbindingen (zoals aceton), en de meeste amines zijn onverenigbaar met chloroform en ook met tetrachloorkoolstof als oplosmiddel.
Aromatische amines hebben hun eenpaarelektronen geconjugeerd (“gedeeld”) in de benzeenring, zodat hun neiging om waterstofbruggen aan te gaan enigszins is verminderd. Het kookpunt van deze moleculen ligt daarom meestal wat hoger dan dat van andere, kleinere amines, omdat ze meestal groter zijn. Ze zijn ook vaak minder goed oplosbaar in water, hoewel ze wel oplosbaar blijven in andere organische oplosmiddelen.
Aromatisch geconjugeerde amines zijn vaak behoorlijk giftig en kunnen gemakkelijk door de huid worden geabsorbeerd, en moeten dus altijd als “gevaarlijk” worden behandeld.
Chiraliteit
Tertiaire aminen van het type NHRR’ en NRR’R” zijn niet chiraal: hoewel het stikstofatoom vier verschillende substituenten heeft waarbij het eenzame paar meetelt, kan het eenzame elektronenpaar over het stikstofatoom “spiegelen” en de andere moleculen omkeren. De energiebarrière voor een dergelijke Walden-inversie van het stereocentrum met een eenzaam elektronenpaar is betrekkelijk laag, bijvoorbeeld ~7 kcal/mol voor een trialkylamine, en daarom is het moeilijk om met tertiaire aminen betrouwbare chirale producten te verkrijgen. Vanwege deze lage barrière kunnen amines zoals NHRR’ niet optisch worden opgelost en kan NRR’R” alleen worden opgelost wanneer de R-, R’- en R’-groepen in cyclische structuren zijn ingeperkt. Quaternaire aminestructuren, bijvoorbeeld H3C-N+-RR’R”, zijn chiraal en kunnen gemakkelijk optisch worden opgelost.
Eigenschappen als basenEdit
Zoals ammoniak fungeren aminen als basen en zijn ze redelijk sterk (zie de gegeven tabel voor enkele voorbeelden van geconjugeerde zure Ka-waarden). De basischiteit van aminen varieert per molecuul, en hangt grotendeels af van:
- De beschikbaarheid van het lone elektronenpaar van stikstof
- De elektronische eigenschappen van de toegevoegde substituentgroepen (bijv, alkylgroepen verhogen de basiteit, arylgroepen verlagen die, enz.)
- De mate van oplosbaarheid van het geprotoneerde amine, die vooral afhangt van het oplosmiddel dat bij de reactie wordt gebruikt
Het stikstofatoom van een typisch amine heeft een lone elektronenpaar dat een waterstofion (H+) kan binden om een ammoniumion — R3NH+ – te vormen. De oplosbaarheid van eenvoudige amines in water is grotendeels te danken aan de waterstofbruggen die kunnen ontstaan tussen de protonen op de watermoleculen en deze elektronenparen.
- Inductief effect van alkylgroepen
| Ionen van verbinding | Kb |
|---|---|
| ammoniak NH3 | 1.8-10-5 M |
| methylamine CH3NH2 | 4.4-10-4 M |
| propylamine CH3CH2CH2NH2 | 4,7-10-4 M |
| 5,3-10-4 M | |
| diethylamine (CH3)2NH2 | 9.6-10-4 M |
+I-effect van alkylgroepen verhoogt de energie van het eenzame elektronenpaar, waardoor de basiciteit toeneemt.
- Mesomerisch effect van aromatische systemen
| Ionen van verbinding | Kb |
|---|---|
| ammoniak NH3 | 1.8-10-5 M |
| aniline C6H5NH2 | 3.8-10-10 M |
| 4-methylfenylamine 4-CH3C6H4NH2 | 1,2-10-9 M |
+M effect van aromatische ring delokaliseert het lone-pair elektron in de ring, wat leidt tot een verminderde basiciteit.
De mate van protonering van geprotoneerde aminen:
| Ionen van verbinding | Maximaal aantal H-binding |
|---|---|
| NH4+ | 4 Zeer goed oplosbaar in H2O |
| RNH3+ | 3 |
| R2NH2+ | 2 |
| R3NH+ | 1 Minst oplosbaar in H2O |