
Het huidige model van de atomaire structuur is het kwantummechanische model. De traditionele scheikunde begint met de studie van elementaire deeltjes, atomen, moleculen, stoffen, metalen, kristallen en andere aggregaten van materie. Materie kan worden bestudeerd in vaste, vloeibare, gas- en plasmatoestanden, afzonderlijk of in combinatie. De interacties, reacties en transformaties die in de chemie worden bestudeerd, zijn meestal het resultaat van interacties tussen atomen, die leiden tot herschikkingen van de chemische bindingen die atomen bij elkaar houden. Dergelijke gedragingen worden bestudeerd in een scheikundelaboratorium.
In het scheikundelaboratorium wordt stereotiep gebruik gemaakt van verschillende vormen van laboratoriumglaswerk. Glaswerk staat echter niet centraal in de chemie, en een groot deel van de experimentele (en ook de toegepaste/industriële) chemie wordt zonder glaswerk uitgevoerd.

Een chemische reactie is een omzetting van een aantal stoffen in een of meer andere stoffen. De basis van zo’n chemische omzetting is de herschikking van elektronen in de chemische bindingen tussen atomen. De reactie kan symbolisch worden weergegeven door middel van een chemische vergelijking, waarbij meestal atomen als onderwerp worden gebruikt. Het aantal atomen links en rechts in de vergelijking voor een chemische omzetting is gelijk. (Wanneer het aantal atomen aan beide zijden ongelijk is, wordt de omzetting een kernreactie of radioactief verval genoemd). Het soort chemische reacties dat een stof kan ondergaan en de energieveranderingen die daarmee gepaard kunnen gaan, worden beperkt door bepaalde basisregels, die bekend staan als chemische wetten.
Energie- en entropie-overwegingen zijn onveranderlijk belangrijk in bijna alle chemische studies. Chemische stoffen worden geclassificeerd in termen van hun structuur, fase en chemische samenstelling. Zij kunnen worden geanalyseerd met behulp van de instrumenten van de chemische analyse, b.v. spectroscopie en chromatografie. Wetenschappers die zich bezighouden met chemisch onderzoek worden scheikundigen genoemd. De meeste scheikundigen zijn gespecialiseerd in een of meer subdisciplines. Verschillende begrippen zijn essentieel voor de studie van de chemie; enkele daarvan zijn:
Materie
In de scheikunde wordt materie gedefinieerd als alles wat rustmassa en volume heeft (het neemt ruimte in) en uit deeltjes bestaat. De deeltjes waaruit materie is opgebouwd hebben ook rustmassa – niet alle deeltjes hebben rustmassa, zoals het foton. Materie kan een zuivere chemische stof zijn of een mengsel van stoffen.
Atoom

Het atoom is de basiseenheid van de scheikunde. Het bestaat uit een dichte kern, de atoomkern, omgeven door een ruimte die wordt ingenomen door een elektronenwolk. De kern bestaat uit positief geladen protonen en ongeladen neutronen (samen nucleonen genoemd), terwijl de elektronenwolk bestaat uit negatief geladen elektronen die in een baan om de kern cirkelen. In een neutraal atoom compenseren de negatief geladen elektronen de positieve lading van de protonen. De kern is dicht; de massa van een nucleon is ongeveer 1.836 maal die van een elektron, maar de straal van een atoom is ongeveer 10.000 maal die van zijn kern.
Het atoom is ook de kleinste entiteit waarvan kan worden aangenomen dat zij de chemische eigenschappen van het element behoudt, zoals elektronegativiteit, ionisatiepotentiaal, voorkeursoxidatietoestand(en), coördinatiegetal, en de voorkeursbindingen die moeten worden gevormd (bijv, metaal, ionisch, covalent).
Element
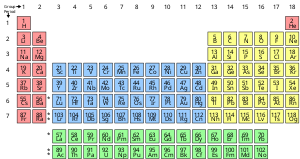
Een chemisch element is een zuivere stof die is samengesteld uit één soort atoom, gekenmerkt door een bepaald aantal protonen in de atoomkernen, bekend als het atoomnummer en weergegeven door het symbool Z. Het massagetal is de som van het aantal protonen en neutronen in een atoomkern. Hoewel alle kernen van alle atomen die tot een element behoren hetzelfde atoomnummer zullen hebben, zullen zij niet noodzakelijk hetzelfde massagetal hebben; atomen van een element die verschillende massagetallen hebben, worden isotopen genoemd. Alle atomen met 6 protonen in hun kern zijn bijvoorbeeld atomen van het chemische element koolstof, maar koolstofatomen kunnen een massagetal van 12 of 13 hebben.
De standaardpresentatie van de chemische elementen is in het periodiek systeem, dat de elementen rangschikt naar atoomnummer. Het periodiek systeem is gerangschikt in groepen (kolommen) en perioden (rijen). Het periodiek systeem is nuttig bij het identificeren van periodieke trends.
Compound

Een verbinding is een zuivere chemische stof die uit meer dan één element bestaat. De eigenschappen van een verbinding vertonen weinig gelijkenis met die van haar elementen. De standaardnomenclatuur van de verbindingen wordt vastgesteld door de Internationale Unie voor Zuivere en Toegepaste Chemie (IUPAC). Organische verbindingen krijgen hun naam volgens het systeem van de organische nomenclatuur. De namen voor anorganische verbindingen worden gemaakt volgens het anorganische nomenclatuursysteem. Wanneer een verbinding meer dan één component heeft, dan worden zij in twee klassen verdeeld, de elektropositieve en de elektronegatieve componenten. Daarnaast heeft de Chemical Abstracts Service een methode bedacht om chemische stoffen te indexeren. In dit schema is elke chemische stof identificeerbaar door een nummer dat bekend staat als het CAS-registratienummer.
Molecuul

Een molecuul is het kleinste ondeelbare deel van een zuivere chemische stof met zijn unieke reeks chemische eigenschappen, d.w.z. zijn vermogen om een bepaalde reeks chemische reacties met andere stoffen te ondergaan. Deze definitie werkt echter alleen goed voor stoffen die zijn opgebouwd uit moleculen, wat niet geldt voor veel stoffen (zie hieronder). Moleculen zijn meestal een verzameling atomen die aan elkaar gebonden zijn door covalente bindingen, zodat de structuur elektrisch neutraal is en alle valentie-elektronen gepaard zijn met andere elektronen, hetzij in bindingen of in eenzame paren.
Dus bestaan moleculen als elektrisch neutrale eenheden, in tegenstelling tot ionen. Wanneer deze regel wordt gebroken, waardoor het “molecuul” een lading krijgt, wordt het resultaat soms een moleculair ion of een polyatomisch ion genoemd. De discrete en gescheiden aard van het moleculaire concept vereist echter meestal dat moleculaire ionen alleen in goed gescheiden vorm aanwezig zijn, zoals een gerichte bundel in een vacuüm in een massaspectrometer. Geladen polyatomische verzamelingen die in vaste stoffen verblijven (bijvoorbeeld gewone sulfaat- of nitraationen) worden in de chemie over het algemeen niet als “moleculen” beschouwd. Sommige moleculen bevatten een of meer ongepaarde elektronen, waardoor radicalen ontstaan. De meeste radicalen zijn betrekkelijk reactief, maar sommige, zoals stikstofmonoxide (NO) kunnen stabiel zijn.

De “inerte” of edelgaselementen (helium, neon, argon, krypton, xenon en radon) bestaan uit eenzame atomen als kleinste afzonderlijke eenheid, maar de andere geïsoleerde chemische elementen bestaan uit moleculen of netwerken van atomen die op de een of andere manier aan elkaar zijn gebonden. Identificeerbare moleculen vormen bekende stoffen zoals water, lucht, en veel organische verbindingen zoals alcohol, suiker, benzine, en de verschillende geneesmiddelen.
Niet alle stoffen of chemische verbindingen bestaan echter uit afzonderlijke moleculen, en de meeste vaste stoffen waaruit de vaste korst, mantel, en kern van de aarde bestaan zijn chemische verbindingen zonder moleculen. Deze andere soorten stoffen, zoals ionische verbindingen en netwerkvaste stoffen, zijn zodanig georganiseerd dat zij niet bestaan uit identificeerbare moleculen op zich. In plaats daarvan worden deze stoffen besproken in termen van formule-eenheden of eenheidscellen als de kleinste zich herhalende structuur binnen de stof. Voorbeelden van dergelijke stoffen zijn minerale zouten (zoals tafelzout), vaste stoffen zoals koolstof en diamant, metalen, en de bekende siliciumdioxide- en silicaatmineralen zoals kwarts en graniet.
Een van de belangrijkste kenmerken van een molecuul is de geometrie, die vaak de structuur wordt genoemd. Terwijl de structuur van diatomische, triatomische of tetraatomische moleculen triviaal kan zijn, (lineair, hoekig piramidevormig enz.) kan de structuur van polyatomische moleculen, die uit meer dan zes atomen (van verschillende elementen) bestaan, van cruciaal belang zijn voor de chemische aard ervan.
Substantie en mengsel






Voorbeelden van zuivere chemische stoffen. Van links naar rechts: de elementen tin (Sn) en zwavel (S), diamant (een allotroop van koolstof), sucrose (zuivere suiker), en natriumchloride (zout) en natriumbicarbonaat (zuiveringszout), die beide ionische verbindingen zijn.
Een chemische stof is een soort materie met een bepaalde samenstelling en een reeks eigenschappen. Een verzameling van stoffen wordt een mengsel genoemd. Voorbeelden van mengsels zijn lucht en legeringen.
Mol en hoeveelheid stof
De mol is een meeteenheid die een hoeveelheid stof aanduidt (ook wel chemische hoeveelheid genoemd). Een mol bevat precies 6,02214076×1023 deeltjes (atomen, moleculen, ionen of elektronen), waarbij het aantal deeltjes per mol bekend staat als de Avogadro-constante. De molaire concentratie is de hoeveelheid van een bepaalde stof per volume oplossing, en wordt meestal uitgedrukt in mol/dm3.
Fase

Naast de specifieke chemische eigenschappen die de verschillende chemische classificaties onderscheiden, kunnen chemische stoffen in verschillende fasen bestaan. Voor het grootste deel zijn de chemische indelingen onafhankelijk van deze bulk-fase-indelingen; sommige meer exotische fasen zijn echter onverenigbaar met bepaalde chemische eigenschappen. Een fase is een verzameling toestanden van een chemisch systeem die vergelijkbare structurele bulkeigenschappen hebben, over een reeks van omstandigheden, zoals druk of temperatuur.
Fysische eigenschappen, zoals dichtheid en brekingsindex hebben de neiging binnen waarden te vallen die karakteristiek zijn voor de fase. De fase van materie wordt gedefinieerd door de faseovergang, die plaatsvindt wanneer energie die in het systeem wordt gebracht of eruit wordt gehaald, wordt gebruikt om de structuur van het systeem te herschikken, in plaats van de bulkcondities te veranderen.
Soms kan het onderscheid tussen fasen continu zijn in plaats van een discrete grens te hebben” in dit geval wordt de materie beschouwd als in een superkritische toestand. Wanneer drie toestanden op basis van de voorwaarden samenkomen, staat dit bekend als een drievoudig punt en aangezien dit invariant is, is het een handige manier om een reeks voorwaarden te definiëren.
De bekendste voorbeelden van fasen zijn vaste stoffen, vloeistoffen, en gassen. Veel stoffen vertonen meerdere vaste fasen. Zo zijn er bijvoorbeeld drie fasen van vast ijzer (alfa, gamma en delta) die variëren op basis van temperatuur en druk. Een belangrijk verschil tussen de vaste fasen is de kristalstructuur, of rangschikking, van de atomen. Een andere fase die men in de scheikunde vaak tegenkomt is de waterfase, dat is de toestand van stoffen opgelost in een waterige oplossing (dat wil zeggen in water).
Minder bekende fasen zijn plasma’s, Bose-Einstein condensaten en fermionische condensaten en de paramagnetische en ferromagnetische fasen van magnetische materialen. Hoewel de meeste bekende fasen betrekking hebben op driedimensionale systemen, is het ook mogelijk om analogieën te definiëren in tweedimensionale systemen, wat aandacht heeft gekregen vanwege de relevantie voor systemen in de biologie.
Binding

Atomen die in moleculen of kristallen aan elkaar kleven, worden geacht met elkaar verbonden te zijn. Een chemische binding kan worden gevisualiseerd als het veelpolige evenwicht tussen de positieve ladingen in de kernen en de negatieve ladingen die daaromheen oscilleren. Meer dan eenvoudige aantrekking en afstoting, karakteriseren de energieën en verdelingen de beschikbaarheid van een elektron om zich aan een ander atoom te binden.
Een chemische binding kan een covalente binding zijn, een ionische binding, een waterstofbinding of alleen door Van der Waals kracht. Aan elk van deze soorten bindingen wordt een potentiaal toegeschreven. Deze potentiëlen creëren de interacties die atomen bij elkaar houden in moleculen of kristallen. In veel eenvoudige verbindingen kunnen de valentiebindingstheorie, het Valence Shell Electron Pair Repulsion model (VSEPR) en het begrip oxidatiegetal worden gebruikt om de moleculaire structuur en samenstelling te verklaren.
Een ionische binding wordt gevormd wanneer een metaal een of meer van zijn elektronen verliest, waardoor het een positief geladen kation wordt, en de elektronen worden dan gewonnen door het niet-metaalatoom, waardoor het een negatief geladen anion wordt. De twee tegengesteld geladen ionen trekken elkaar aan, en de ionische binding is de elektrostatische aantrekkingskracht tussen hen. Bijvoorbeeld, natrium (Na), een metaal, verliest een elektron en wordt een Na+ kation, terwijl chloor (Cl), een niet-metaal, dit elektron krijgt en Cl- wordt. De ionen worden bij elkaar gehouden door elektrostatische aantrekkingskracht, en de verbinding natriumchloride (NaCl), of gewoon tafelzout, wordt gevormd.

In een covalente binding worden een of meer valentie-elektronenparen gedeeld door twee atomen: de resulterende elektrisch neutrale groep van gebonden atomen wordt een molecuul genoemd. Atomen delen hun valentie-elektronen zodanig dat voor elk atoom een edelgas-elektronenconfiguratie (acht elektronen in hun buitenste schil) ontstaat. Van atomen die de neiging hebben zodanig te combineren dat zij elk acht elektronen in hun valentieschil hebben, wordt gezegd dat zij de octetregel volgen. Sommige elementen, zoals waterstof en lithium, hebben echter slechts twee elektronen in hun buitenste schil nodig om deze stabiele configuratie te bereiken; van deze atomen wordt gezegd dat zij de duet-regel volgen, en op deze manier bereiken zij de elektronenconfiguratie van het edelgas helium, dat twee elektronen in zijn buitenste schil heeft.
Op soortgelijke wijze kunnen theorieën uit de klassieke natuurkunde worden gebruikt om veel ionische structuren te voorspellen. Voor ingewikkelder verbindingen, zoals metaalcomplexen, is de valentiebindingstheorie minder bruikbaar en worden meestal alternatieve benaderingen gebruikt, zoals de moleculaire orbitaaltheorie. Zie diagram over elektronische orbitalen.
Energie
In de context van de chemie is energie een eigenschap van een stof als gevolg van zijn atomaire, moleculaire of aggregaatstructuur. Aangezien een chemische omzetting gepaard gaat met een verandering in een of meer van deze soorten structuren, gaat zij steevast gepaard met een toe- of afname van de energie van de betrokken stoffen. Een deel van de energie wordt in de vorm van warmte of licht overgedragen tussen de omgeving en de reactanten van de reactie; de producten van een reactie kunnen dus meer of minder energie hebben dan de reactanten.
Een reactie wordt exergonisch genoemd als de eindtoestand lager op de energieschaal ligt dan de begintoestand; in het geval van endergonische reacties is de situatie omgekeerd. Een reactie is exotherm als de reactie warmte afgeeft aan de omgeving; in het geval van endotherme reacties absorbeert de reactie warmte uit de omgeving.
Chemische reacties zijn onveranderlijk niet mogelijk tenzij de reactanten een energiebarrière overwinnen die bekend staat als de activeringsenergie. De snelheid van een chemische reactie (bij een gegeven temperatuur T) is gerelateerd aan de activeringsenergie E, door de populatiefactor van Boltzmann e – E / k T {Displaystyle e^{-E/kT}}

– dat is de kans dat een molecuul een energie heeft groter dan of gelijk aan E bij de gegeven temperatuur T. Deze exponentiële afhankelijkheid van een reactiesnelheid van de temperatuur staat bekend als de Arrhenius-vergelijking.De activeringsenergie die nodig is om een chemische reactie te laten plaatsvinden kan de vorm aannemen van warmte, licht, elektriciteit of mechanische kracht in de vorm van ultrageluid.
Het verwante begrip vrije energie, waarin ook entropieoverwegingen zijn verwerkt, is een zeer nuttig middel om de haalbaarheid van een reactie te voorspellen en de evenwichtstoestand van een chemische reactie te bepalen, in de chemische thermodynamica. Een reactie is alleen uitvoerbaar als de totale verandering in de vrije energie van Gibbs negatief is, Δ G ≤ 0 {\displaystyle \Delta G \leq 0 \,}

; als deze gelijk is aan nul, is de chemische reactie zogenaamd in evenwicht.
Er zijn slechts beperkte energietoestanden mogelijk voor elektronen, atomen en moleculen. Deze worden bepaald door de regels van de kwantummechanica, die kwantisering van de energie van een gebonden systeem voorschrijven. Van de atomen/moleculen in een hogere energietoestand wordt gezegd dat ze aangeslagen zijn. De moleculen/atomen van een stof in een aangeslagen energietoestand zijn vaak veel reactiever; dat wil zeggen, vatbaarder voor chemische reacties.
De fase van een stof wordt onveranderlijk bepaald door zijn energie en de energie van zijn omgeving. Wanneer de intermoleculaire krachten van een stof zodanig zijn dat de energie van de omgeving niet voldoende is om deze te overwinnen, komt de stof in een meer geordende fase zoals een vloeistof of een vaste stof, zoals het geval is met water (H2O); een vloeistof bij kamertemperatuur omdat de moleculen gebonden zijn door waterstofbruggen. Terwijl waterstofsulfide (H2S) een gas is bij kamertemperatuur en standaarddruk, omdat de moleculen gebonden zijn door zwakkere dipool-dipoolinteracties.
De overdracht van energie van de ene chemische stof naar de andere hangt af van de grootte van de energiequanta die door de ene stof worden uitgezonden. Warmte-energie wordt echter vaak gemakkelijker van bijna elke stof naar een andere overgebracht, omdat de fononen die verantwoordelijk zijn voor de trillings- en rotatie-energieniveaus in een stof veel minder energie hebben dan de fotonen die voor de elektronische energieoverdracht worden gebruikt. Omdat de trillings- en rotatie-energieniveaus dichter bij elkaar liggen dan de elektronische energieniveaus, wordt warmte gemakkelijker tussen stoffen overgedragen dan bij licht of andere vormen van elektronische energie. Zo wordt bijvoorbeeld ultraviolette elektromagnetische straling niet zo doeltreffend van de ene stof naar de andere overgebracht als thermische of elektrische energie.
Het bestaan van karakteristieke energieniveaus voor verschillende chemische stoffen is nuttig voor hun identificatie door de analyse van spectraallijnen. Bij chemische spectroscopie worden vaak verschillende soorten spectra gebruikt, b.v. IR, microgolf, NMR, ESR, enz. Spectroscopie wordt ook gebruikt om de samenstelling van objecten op afstand – zoals sterren en verre melkwegstelsels – te bepalen door hun stralingsspectra te analyseren.

De term chemische energie wordt vaak gebruikt om het vermogen van een chemische stof aan te duiden om een transformatie te ondergaan door middel van een chemische reactie of om andere chemische stoffen te transformeren.
Reactie

Wanneer een chemische stof wordt getransformeerd als gevolg van de interactie met een andere stof of met energie, wordt gezegd dat er een chemische reactie heeft plaatsgevonden. Een chemische reactie is dus een begrip dat betrekking heeft op de “reactie” van een stof wanneer deze in nauw contact komt met een andere stof, hetzij in de vorm van een mengsel of een oplossing, hetzij door blootstelling aan een of andere vorm van energie, of beide. Zij resulteert in een of andere vorm van energie-uitwisseling tussen de bestanddelen van de reactie, alsmede met de omgeving van het systeem, die kan bestaan uit ontworpen vaten – vaak laboratoriumglaswerk.
Chemische reacties kunnen resulteren in de vorming of dissociatie van moleculen, d.w.z. moleculen die uit elkaar vallen om twee of meer moleculen te vormen, of in een herschikking van atomen binnen of tussen moleculen. Chemische reacties gaan meestal gepaard met het maken of verbreken van chemische bindingen. Oxidatie, reductie, dissociatie, zuur-base neutralisatie en moleculaire herschikking zijn enkele van de meest gebruikte soorten chemische reacties.
Een chemische reactie kan symbolisch worden weergegeven door middel van een chemische vergelijking. Terwijl bij een niet-nucleaire chemische reactie het aantal en het soort atomen aan beide zijden van de vergelijking gelijk zijn, geldt dit bij een nucleaire reactie alleen voor de kerndeeltjes, nl. protonen en neutronen.
De opeenvolging van stappen waarin de reorganisatie van chemische bindingen in de loop van een chemische reactie kan plaatsvinden, wordt het mechanisme ervan genoemd. Men kan zich voorstellen dat een chemische reactie verloopt in een aantal stappen, die elk een verschillende snelheid kunnen hebben. Tijdens een reactie kunnen dus talrijke tussenproducten met variabele stabiliteit worden verwacht. Reactiemechanismen worden voorgesteld om de kinetiek en de relatieve productmix van een reactie te verklaren. Vele fysisch-chemici zijn gespecialiseerd in het onderzoeken en voorstellen van de mechanismen van verschillende chemische reacties. Verschillende empirische regels, zoals de Woodward-Hoffmann regels komen vaak van pas bij het voorstellen van een mechanisme voor een chemische reactie.
Volgens het IUPAC gouden boek, is een chemische reactie “een proces dat resulteert in de interconversie van chemische species”. Bijgevolg kan een chemische reactie een elementaire reactie of een stapsgewijze reactie zijn. Een extra voorbehoud wordt gemaakt, in die zin dat deze definitie ook gevallen omvat waarin de omzetting van conformers experimenteel kan worden waargenomen. Bij dergelijke waarneembare chemische reacties gaat het normaliter om reeksen moleculaire entiteiten, zoals in deze definitie wordt aangegeven, maar het is vaak conceptueel handig om de term ook te gebruiken voor veranderingen waarbij afzonderlijke moleculaire entiteiten betrokken zijn (d.w.z. “microscopische chemische gebeurtenissen”).
Ionen en zouten

Een ion is een geladen soort, een atoom of een molecuul, dat een of meer elektronen heeft verloren of gewonnen. Wanneer een atoom een elektron verliest en dus meer protonen dan elektronen heeft, is het atoom een positief geladen ion of kation. Wanneer een atoom een elektron wint en dus meer elektronen dan protonen heeft, is het atoom een negatief geladen ion of anion. Kationen en anionen kunnen een kristallijn rooster van neutrale zouten vormen, zoals de Na+ en Cl- ionen die natriumchloride, of NaCl vormen. Voorbeelden van polyatomische ionen die zich bij zuur-basereacties niet splitsen zijn hydroxide (OH-) en fosfaat (PO43-).
Plasma bestaat uit gasvormige materie die volledig geïoniseerd is, meestal door hoge temperatuur.
Zuur en basisch

Een stof kan vaak worden ingedeeld als zuur of base. Er zijn verschillende theorieën die het gedrag van zuren en basen verklaren. De eenvoudigste is de Arrhenius-theorie, die stelt dat een zuur een stof is die hydronium-ionen produceert wanneer hij in water wordt opgelost, en een base een stof is die hydroxide-ionen produceert wanneer hij in water wordt opgelost. Volgens de Brønsted-Lowry zuur-base theorie zijn zuren stoffen die een positief waterstofion afstaan aan een andere stof in een chemische reactie; bij uitbreiding, een base is de stof die dat waterstofion ontvangt.
Een derde veel voorkomende theorie is de Lewis zuur-base theorie, die is gebaseerd op de vorming van nieuwe chemische bindingen. De Lewis-theorie legt uit dat een zuur een stof is die in staat is een elektronenpaar van een andere stof te aanvaarden tijdens het proces van bindingsvorming, terwijl een base een stof is die een elektronenpaar kan leveren om een nieuwe binding te vormen. Volgens deze theorie zijn de cruciale zaken die worden uitgewisseld ladingen. Er zijn verschillende andere manieren waarop een stof als zuur of base kan worden geclassificeerd, zoals blijkt uit de geschiedenis van dit concept.
Zuursterkte wordt gewoonlijk gemeten met twee methoden. De ene meting, gebaseerd op de Arrhenius-definitie van zuurtegraad, is de pH, die een meting is van de hydroniumion-concentratie in een oplossing, uitgedrukt op een negatieve logaritmische schaal. Oplossingen met een lage pH hebben dus een hoge hydroniumionconcentratie en kunnen zuurder worden genoemd. De andere maat, gebaseerd op de Brønsted-Lowry-definitie, is de zuurdissociatieconstante (Ka), die het relatieve vermogen van een stof meet om zich als een zuur te gedragen volgens de Brønsted-Lowry-definitie van een zuur. Dat wil zeggen dat stoffen met een hogere Ka meer kans hebben om waterstofionen af te staan in chemische reacties dan die met lagere Ka-waarden.
Redox
Redox (reductie-oxidatie) reacties omvatten alle chemische reacties waarbij de oxidatietoestand van atomen verandert door ofwel elektronen te winnen (reductie) of elektronen te verliezen (oxidatie). Stoffen die het vermogen hebben andere stoffen te oxideren worden oxidatief genoemd en staan bekend als oxidatiemiddelen, oxidanten of oxidatiemiddelen. Een oxidans onttrekt elektronen aan een andere stof. Evenzo worden stoffen die het vermogen hebben om andere stoffen te reduceren reductief genoemd en staan bekend als reductiemiddelen, reductiemiddelen, of reductiemiddelen.
Een reductiemiddel draagt elektronen over aan een andere stof en wordt dus zelf geoxideerd. En omdat het elektronen “doneert” wordt het ook wel een elektronendonor genoemd. Oxidatie en reductie verwijzen eigenlijk naar een verandering in oxidatiegetal – de feitelijke overdracht van elektronen mag nooit plaatsvinden. Daarom kan oxidatie beter worden gedefinieerd als een toename van het oxidatiegetal, en reductie als een afname van het oxidatiegetal.
Evenwicht
Hoewel het begrip evenwicht in alle wetenschappen wordt gebruikt, ontstaat het in de context van de chemie telkens wanneer een aantal verschillende toestanden van de chemische samenstelling mogelijk zijn, zoals bijvoorbeeld in een mengsel van verschillende chemische verbindingen die met elkaar kunnen reageren, of wanneer een stof in meer dan één soort fase aanwezig kan zijn.
Een systeem van chemische stoffen in evenwicht is, ook al heeft het een onveranderlijke samenstelling, meestal niet statisch; moleculen van de stoffen blijven met elkaar reageren, zodat een dynamisch evenwicht ontstaat. Het begrip beschrijft dus de toestand waarin de parameters, zoals de chemische samenstelling, in de tijd onveranderd blijven.
Chemische wetten
Chemische reacties worden beheerst door bepaalde wetten, die fundamentele concepten in de chemie zijn geworden. Enkele daarvan zijn:
- Avogadro’s wet
- Beer-Lambert wet
- Wet van Boyle (1662, relateert druk en volume)
- De wet van Charles (1787, relateert volume en temperatuur)
- De diffusiewetten van Fick
- De wet van Gay-Lussac (1809, relateert druk en temperatuur)
- Henry’s wet
- Hess’s wet
- Wet van behoud van energie leidt tot de belangrijke begrippen evenwicht, thermodynamica en kinetica.
- De wet van behoud van massa blijft behouden in geïsoleerde systemen, zelfs in de moderne natuurkunde. De speciale relativiteit laat echter zien dat door massa-energie-equivalentie, telkens wanneer niet-materiële “energie” (warmte, licht, kinetische energie) uit een niet-geïsoleerd systeem wordt verwijderd, daarmee ook wat massa verloren gaat. Hoge energieverliezen resulteren in verlies van weegbare hoeveelheden massa, een belangrijk onderwerp in de nucleaire chemie.
- Wet van de bepaalde samenstelling, hoewel in veel systemen (met name biomacromoleculen en mineralen) de verhoudingen meestal grote getallen vereisen, en vaak als een breuk worden weergegeven.
- Wet van de meervoudige verhoudingen
- Wet van Raoult