Umiejętności do rozwinięcia
- Opisać, jak elektrony są pogrupowane w atomach.
Chociaż omówiliśmy ogólne rozmieszczenie cząstek subatomowych w atomach, powiedzieliśmy niewiele o tym, jak elektrony zajmują przestrzeń wokół jądra. Czy poruszają się one wokół jądra w sposób przypadkowy, czy też istnieją w jakimś uporządkowanym układzie?
Nowoczesna teoria zachowania elektronów nazywana jest mechaniką kwantową. Zawiera ona następujące stwierdzenia dotyczące elektronów w atomach:
- Elektrony w atomach mogą mieć tylko pewne określone energie. Mówimy, że energie elektronów są skwantowane.
- Elektrony są zorganizowane zgodnie z ich energiami w zbiory zwane powłokami. Ogólnie rzecz biorąc, im wyższa energia powłoki, tym dalej jest ona (średnio) od jądra. Powłoki nie mają określonych, stałych odległości od jądra, ale elektron w powłoce o wyższej energii będzie spędzał więcej czasu dalej od jądra niż elektron w powłoce o niższej energii.
- Powłoki są dalej podzielone na podzbiory elektronów zwane podpowłokami. Pierwsza powłoka ma tylko jedną podpowłokę, druga powłoka ma dwie podpowłoki, trzecia powłoka ma trzy podpowłoki, i tak dalej. Podpowłoki każdej powłoki są oznaczone, w kolejności, literami s, p, d i f. Tak więc, pierwsza powłoka ma tylko podpowłoki s, druga powłoka ma podpowłoki s i p, trzecia powłoka ma podpowłoki s, p i d, i tak dalej.
- Różne podpowłoki mają różną maksymalną liczbę elektronów. Każda podpowłoka s może pomieścić do 2 elektronów; p suppowłoka do 6 elektronów; d podpowłoka do 10; i f podpowłoka do 14.
To właśnie rozmieszczenie elektronów w powłokach ma największy wpływ na właściwości chemiczne, więc skupimy się tutaj głównie na powłokach.
Używamy liczb, aby wskazać, w której powłoce znajduje się elektron. Pierwsza powłoka, najbliżej jądra i z elektronami o najniższej energii, to powłoka 1. Ta pierwsza powłoka ma tylko jedną podpowłokę (oznaczoną jako 1s) i może pomieścić maksymalnie 2 elektrony. To dlatego w pierwszym rzędzie układu okresowego znajdują się dwa pierwiastki (H & He).
Ponieważ pierwsza powłoka może pomieścić tylko maksymalnie 2 elektrony, trzeci elektron musi przejść do drugiej powłoki. Dlatego lit (Li), który ma trzy całkowite elektrony, będzie miał dwa elektrony w pierwszej powłoce i jeden elektron w drugiej powłoce. Zauważ, że lit jest pierwszym elementem w drugim rzędzie układu okresowego.
Druga powłoka ma dwie podpowłoki (oznaczone 2s i 2p). W podpowłoce 2s mieści się maksymalnie 2 elektrony, a w podpowłoce 2p mieści się maksymalnie 6 elektronów. Oznacza to, że w drugiej powłoce może znajdować się maksymalnie osiem elektronów (2+6=8). Zauważ, że w drugim rzędzie układu okresowego znajduje się osiem pierwiastków.
Tylko elektrony w najbardziej zewnętrznej powłoce, zwanej powłoką WARTOŚCIOWĄ, mają tendencję do reagowania (są zdobywane, tracone lub dzielone). Można sobie wyobrazić, że jeśli dwa atomy wpadną na siebie, to zewnętrzne elektrony będą oddziaływać jako pierwsze. Poniżej znajduje się lista całkowitych elektronów, elektronów w powłoce i elektronów walencyjnych dla pierwszych 10 pierwiastków.
- Hydrogen ma 1 elektron w pierwszej powłoce (więc jeden elektron walencyjny).
- Hel ma 2 elektrony — oba w pierwszej powłoce (więc dwa elektrony walencyjne).
- Lit ma 3 elektrony — 2 w pierwszej powłoce i 1 w drugiej (więc jeden elektron walencyjny).
- Beryl ma 4 elektrony — 2 w pierwszej powłoce i 2 w drugiej (więc dwa elektrony walencyjne).
- Boron ma 5 elektronów — 2 w pierwszej powłoce i 3 w drugiej powłoce (więc trzy elektrony walencyjne).
- Węgiel ma 6 elektronów — 2 w pierwszej powłoce i 4 w drugiej (więc cztery elektrony walencyjne).
- Nitrogen ma 7 elektronów — 2 w pierwszej powłoce i 5 w drugiej (więc pięć elektronów walencyjnych).
- Tlen ma 8 elektronów — 2 w pierwszej powłoce i 6 w drugiej (więc sześć elektronów walencyjnych).
- Fluor ma 9 elektronów — 2 w pierwszej powłoce i 7 w drugiej (więc siedem elektronów walencyjnych).
- Neon ma 10 elektronów — 2 w pierwszej powłoce i 8 w drugiej (więc osiem elektronów walencyjnych).
Na rysunku 2.6.1 poniżej podano liczbę atomową dla pierwiastków grupy głównej. Liczba atomowa określa liczbę protonów w jądrze każdego atomu. Dla atomów obojętnych, liczba dodatnich protonów będzie równa całkowitej liczbie ujemnych elektronów (zerowy ładunek netto). Na przykład, brom (Br) ma 35 protonów i 35 elektronów. W układach okresowych zawsze podawana jest liczba atomowa.

Rysunek 2.6.1 – Liczba atomowa dla każdego z pierwiastków grupy głównej
Liczbę elektronów walencyjnych dla każdego pierwiastka grupy głównej można określić na podstawie kolumny lub grupy, którą zajmuje w układzie okresowym. Tabela 2.6.2 poniżej podsumowuje liczbę elektronów walencyjnych dla każdej kolumny grupy głównej pierwiastków. Na przykład, elementy w pierwszej kolumnie (czasami oznaczane jako IA), wszystkie mają jeden elektron walencyjny. Druga kolumna (IIA) ma dwa elektrony walencyjne. Pomijamy krótki blok dziesięciu elementów w środku, ponieważ jest to miejsce, w którym podpowłoka wypełnia się poza kolejnością. Pierwiastki w kolumnach IIIA, IVA, VA, VIA, VIIA i VIIIA* mają odpowiednio trzy, cztery, pięć, sześć, siedem i osiem* elektronów walencyjnych.
*Zauważ, że hel (He) ma tylko dwa elektrony walencyjne. Niektóre układy okresowe umieszczają hel w kolumnie IIA, inne w VIIIA, a jeszcze inne w obu tych miejscach.
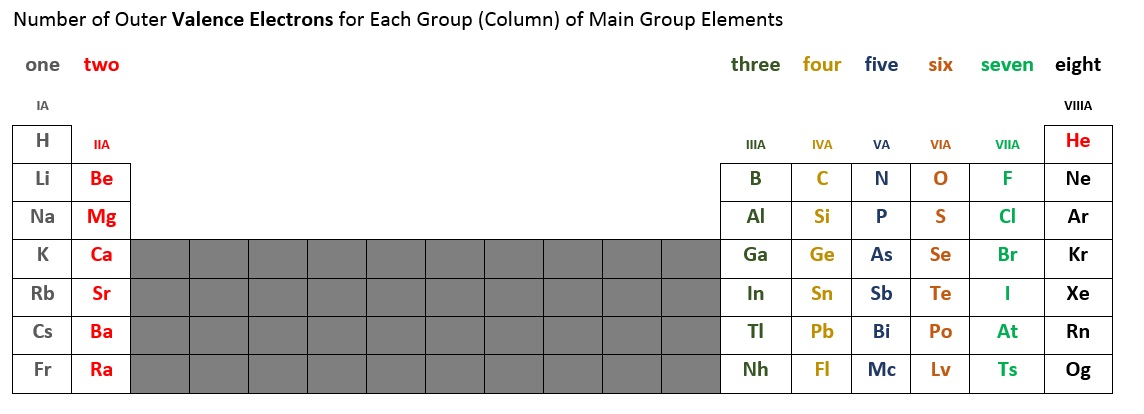
Figure 2.6.2 – Number of Valence Electrons for Main Group Elements
Przykład: Elektrony atomów fosforu
Ile elektronów całkowitych i walencyjnych znajduje się w obojętnym atomie fosforu?
ROZWIĄZANIE
Obojętny atom fosforu ma 15 elektronów całkowitych. Dwa elektrony mogą przejść do pierwszej powłoki, osiem do drugiej powłoki i ma jeszcze pięć elektronów w trzeciej powłoce. Trzecia powłoka jest zewnętrzną powłoką walencyjną, więc ma 5 elektronów walencyjnych.
Liczba elektronów w każdej powłoce staje się bardziej skomplikowana, ponieważ więcej elektronów jest dodawanych, ponieważ jest więcej podpowłok, które są używane i ponieważ powłoka zaczyna wypełniać się poza kolejnością. Dla pierwiastków o większej liczbie atomowej niż 20 (poza wapniem), skupimy się tylko na tym ile elektronów jest całkowitych i ile elektronów walencyjnych, a nie na liczbie w każdej powłoce. Stwierdziliśmy, że elektrony zewnętrznej powłoki nazywane są walencyjnymi. Wewnętrzne (niewalencyjne) powłoki i elektrony są często nazywane rdzeniem.
Przykład: Liczenie elektronów całkowitych i walencyjnych w atomach ksenonu
Ile elektronów całkowitych, walencyjnych i rdzeniowych znajduje się w obojętnym atomie ksenonu?
ROZWIĄZANIE
Ksenon ma 54 elektrony całkowite, 8 walencyjnych i 46 rdzeniowych.
Ćwiczenia sprawdzające pojęcia
- Jak zorganizowane są elektrony w atomach?
- Jaka jest maksymalna liczba elektronów, które mogą zmieścić się w dwóch pierwszych powłokach atomu?
- Jaka jest różnica pomiędzy elektronami rdzeniowymi a elektronami walencyjnymi?
Odpowiedzi
- Elektrony są zorganizowane w powłoki i podpowłoki wokół jąder.
- Pierwsza powłoka może pomieścić maksymalnie dwa, a druga maksymalnie osiem elektronów.
- Elektrony walencyjne znajdują się w powłoce o najwyższym numerze (zewnętrznej); wszystkie inne elektrony są elektronami rdzeniowymi.
Key Takeaway
- Elektrony są zorganizowane w powłoki i podpowłoki wokół jądra atomu.
Wykonawcy
-
Anonim
- iv