Basicity of heterocyclic amines
Gdy atom azotu jest włączony bezpośrednio do pierścienia aromatycznego, jego zasadowość zależy od kontekstu wiązania. W pierścieniu pirydynowym, na przykład, samotna para azotu zajmuje orbital sp2-hybrydowy i nie jest częścią sekstetu aromatycznego – jest to w zasadzie azot iminowy. Jego para elektronowa jest dostępna do tworzenia wiązania z protonem, a zatem atom azotu pirydyny jest nieco zasadowy.

W pierścieniu pirrolu, w przeciwieństwie do tego, samotna para azotu jest częścią sekstetu aromatycznego. Oznacza to, że elektrony te są bardzo stabilne właśnie tam, gdzie są (w układzie aromatycznym), i są znacznie mniej dostępne do wiązania się z protonem (a jeśli podniosą proton, układ aromatyczny zostaje zniszczony). Z tych powodów, nitrogeny pyrrolu nie są silnie zasadowe.

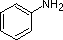
Przykłady aniliny, pirydyny i pyrrolu są dobrymi modelami do przewidywania reaktywności atomów azotu w bardziej złożonych układach pierścieniowych (których ogromna różnorodność występuje w przyrodzie). Łańcuch boczny tryptofanu, na przykład, zawiera nie-podstawowy azot „pyrrolopodobny”, podczas gdy adenina (baza DNA/RNA) zawiera wszystkie trzy typy.


Samotna para elektronów na azocie nitrylu znajduje się w orbitalu hybrydowym sp. Charakter 50% s orbitali hybrydowych sp oznacza, że elektrony znajdują się blisko jądra i dlatego nie są znacząco zasadowe.
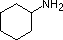
Przegląd podstawowych pojęć kwasowo-zasadowych powinien być pomocny w poniższej dyskusji. Podobnie jak amoniak, większość amin to zasady Brønsteda i Lewisa, ale ich siła zasady może być bardzo zmieniona przez podstawniki. Powszechne jest ilościowe porównywanie zasadowości poprzez użycie pKa ich sprzężonych kwasów, a nie ich pKb. Ponieważ pKa + pKb = 14, im wyższe pKa tym silniejsza zasada, w przeciwieństwie do zwykłej odwrotnej zależności pKa od kwasowości. Większość prostych amin alkilowych ma pKa w zakresie 9,5 do 11,0, a ich roztwory wodne są zasadowe (mają pH 11 do 12, w zależności od stężenia). Pierwsze cztery związki w poniższej tabeli, w tym amoniak, należą do tej kategorii.
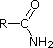
Pięć ostatnich związków (kolorowe komórki) to znacznie słabsze zasady, co jest konsekwencją trzech czynników. Pierwszym z nich jest hybrydyzacja azotu. W pirydynie azot jest zhybrydyzowany sp2, a w nitrylach (ostatnia pozycja) azot zhybrydyzowany sp jest częścią wiązania potrójnego. W każdym z tych związków (zacieniowanych na czerwono) niewiążąca para elektronowa jest zlokalizowana na atomie azotu, ale wzrost znaku s przybliża ją do jądra azotu, zmniejszając jej skłonność do wiązania się z protonem.
|
Związek |
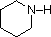 |
 |
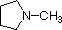 |
NH3 |  |
 |
 |
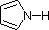 |
 |
CH3C≡N |
|---|---|---|---|---|---|---|---|---|---|---|
| pKa | 11.0 | 10.7 | 10.7 | 9.3 | 5.2 | 4.6 | 1.0 | 0.0 | -1.0 | -10. |
Zasadowość pospolitych amin (pKa sprzężonych jonów amonowych)
Wreszcie, bardzo niska zasadowość pirrolu (zacieniowana na niebiesko) odzwierciedla wyjątkową delokalizację pary elektronowej azotu związaną z jego wbudowaniem w pierścień aromatyczny. Indol (pKa = -2) i imidazol (pKa = 7.0), patrz wyżej, również mają podobne heterocykliczne pierścienie aromatyczne. Imidazol jest ponad milion razy bardziej zasadowy niż pyrrol, ponieważ azot sp2, który jest częścią jednego podwójnego wiązania jest strukturalnie podobny do pirydyny i ma porównywalną zasadowość.
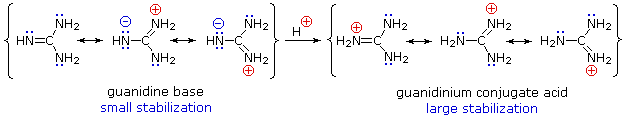
Ale delokalizacja rezonansowa generalnie zmniejsza zasadowość amin, dramatyczny przykład odwrotnego efektu można znaleźć w związku guanidyny (pKa = 13,6). Tutaj, jak pokazano poniżej, rezonansowa stabilizacja zasady jest niewielka, ze względu na separację ładunku, podczas gdy sprzężony kwas jest silnie stabilizowany przez delokalizację ładunku. W związku z tym wodne roztwory guanidyny są prawie tak samo zasadowe jak roztwory wodorotlenku sodu.