Synteza, Nomenklatura, i Właściwości Amidowej Grupy Funkcyjnej
W tym poście postaramy się przedstawić szeroki przegląd amidów. Przedstawimy krótki przegląd nomenklatury amidów, dwie ważne właściwości amidów, które znacznie różnią się od amin, oraz omówimy trzy kluczowe strategie syntezy amidów.
Table of Contents
- Nomenklatura amidowej grupy funkcyjnej: Primary, Secondary, And Tertiary Amides
- Amides vs Amines: Less Basic, More Acidic
- Synthesis of Amides, Part 1. Nucleophilic Acyl Substitution of Acyl Halides (Or Anhydrides) With Amines
- Synthesis of Amides, Part 2: Partial Hydrolysis Of Nitriles
- Synthesis of Amides, Part 3: Use Of A Dehydrating Reagent (Such As DCC)
- Summary: Three Effective Methods For the Synthesis of Amides
- Let Us Briefly Consider A Fourth, Less Important Method: Brute Force
- Notes
- Quiz Yourself!
- (Advanced) References and Further Reading
1. Nomenklatura Amidowej Grupy Funkcyjnej: Primary, Secondary, and Tertiary Amides
„Amidy” są tym, co nazywamy aminami, które mają pojedynczą dołączoną grupę karbonylową. Amidowa grupa funkcyjna jest dla amin tym, czym estry są dla alkoholi.
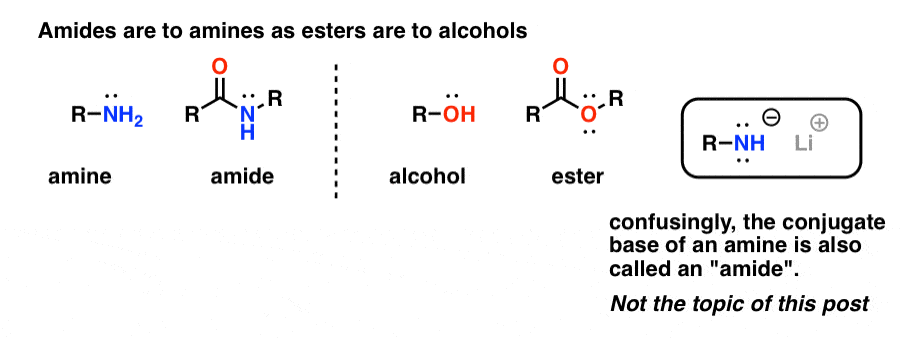
Konfliktowo, słowo „amid” jest również używane w odniesieniu do sprzężonych zasad amin, takich jak amid sodu (NaNH2) i di-izopropyloamid litu (LDA). Te ostatnie są czasami rozróżniane przez odniesienie do nich jako „zasady amidowe”. Inni używają nieco innej wymowy dla rozróżnienia tych dwóch (ayyy-myde i aaah-midd). Tak jak w przypadku każdego innego homonimu, kluczem jest kontekst.
Tak jak w przypadku amin, nazewnictwo stosowane dla amidu zależy od liczby węgli przyłączonych do azotu.
Amid pierwszorzędowy (1°) ma azot przyłączony do pojedynczego węgla; amid drugorzędowy (2°) ma azot przyłączony do dwóch węgli; amid trzeciorzędowy (3°) ma azot przyłączony do trzech węgli. Amid cykliczny nazywany jest laktamem.
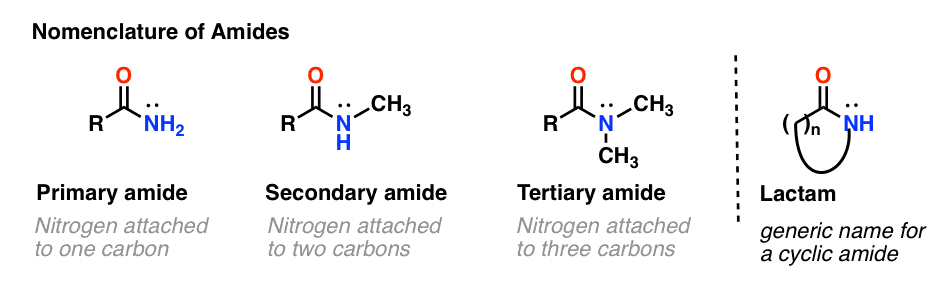
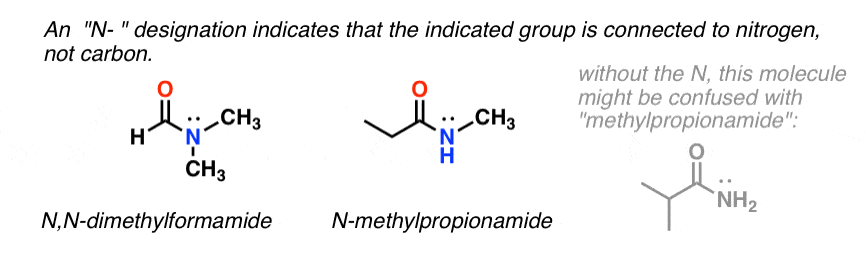
Gdy azot amidowy ma podstawniki inne niż wodór, określamy je za pomocą przedrostka N-, aby uniknąć pomyłek. Na przykład, N-metylopropionamid określa przyłączenie grupy metylowej do azotu; bez przedrostka N-, można by założyć, że grupa metylowa jest przyłączona do węgla, co byłoby zupełnie inną cząsteczką.
Amidy vs Aminy: Less Basic, More Acidic
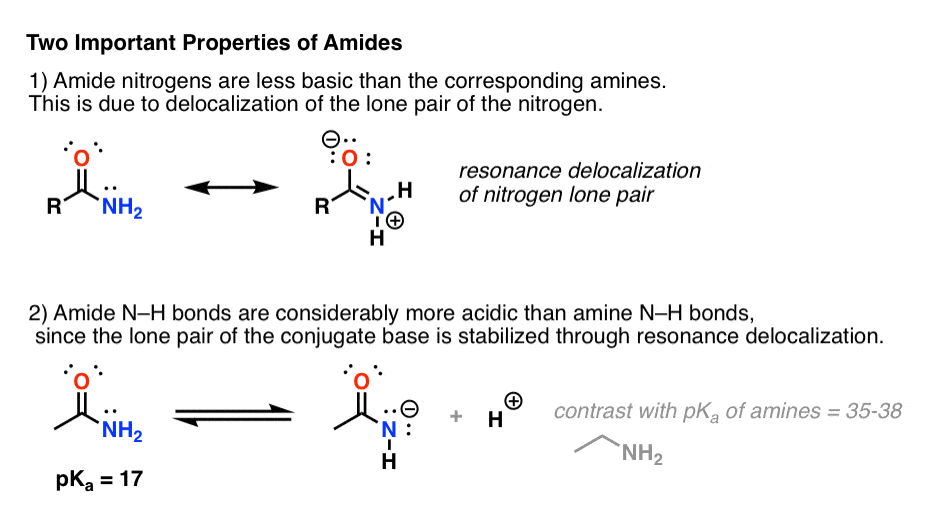
Dołączenie grupy karbonylowej do aminy ma dwa drastyczne efekty na właściwości azotu.
- Po pierwsze, azotrony amidowe są znacznie mniej zasadowe niż azotrony aminowe. Wynika to głównie z delokalizacji samotnej pary azotu do wiązania pi karbonylu. W rzeczywistości, najbardziej podstawową pozycją amidu nie jest azot, ale tlen (!).
- Po drugie, wiązania N-H amidów są znacznie bardziej kwaśne niż wiązania N-H amin. Dlaczego? Delokalizacji ponownie. Dołączona grupa karbonylowa pozwala na delokalizację samotnej pary sprzężonej zasady poprzez rezonans. PKa acetamidu (17) jest około 20 rzędów wielkości bardziej kwaśne niż amoniaku (38).
Trzecią, bardziej subtelną właściwością amidów jest to, że zazwyczaj mają one ograniczoną rotację wokół wiązania C-N. Forma rezonansowa, w której występuje wiązanie C-N, wnosi tak znaczący wkład do hybrydy rezonansowej, że można myśleć o wiązaniu C-N jako o posiadającym „częściowy charakter wiązania podwójnego”.
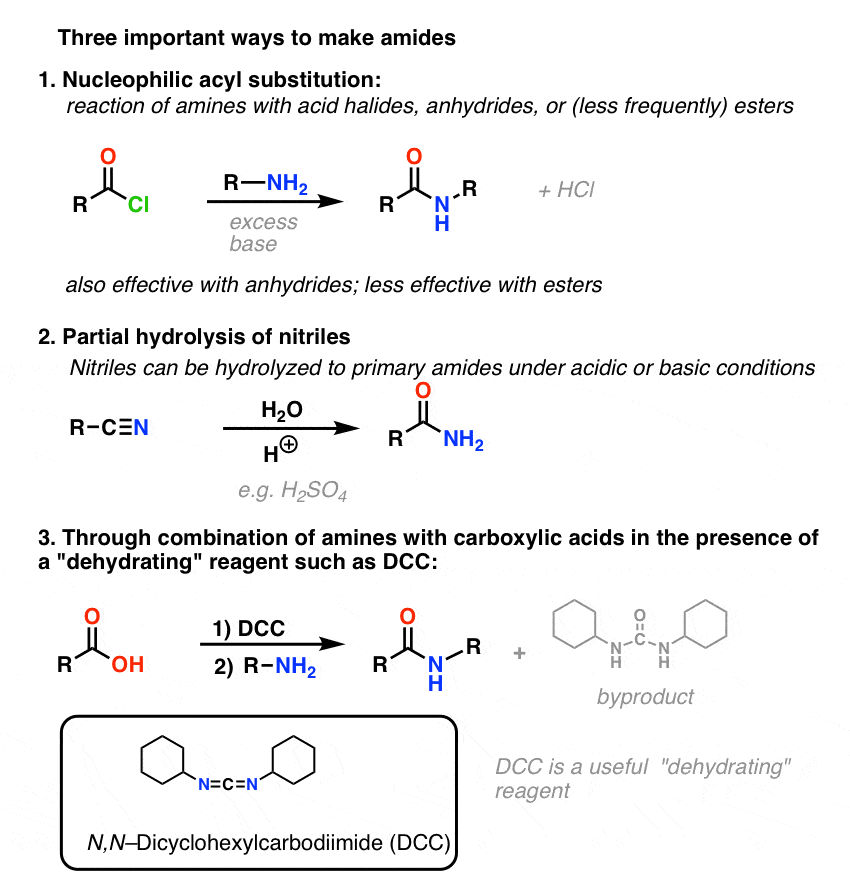
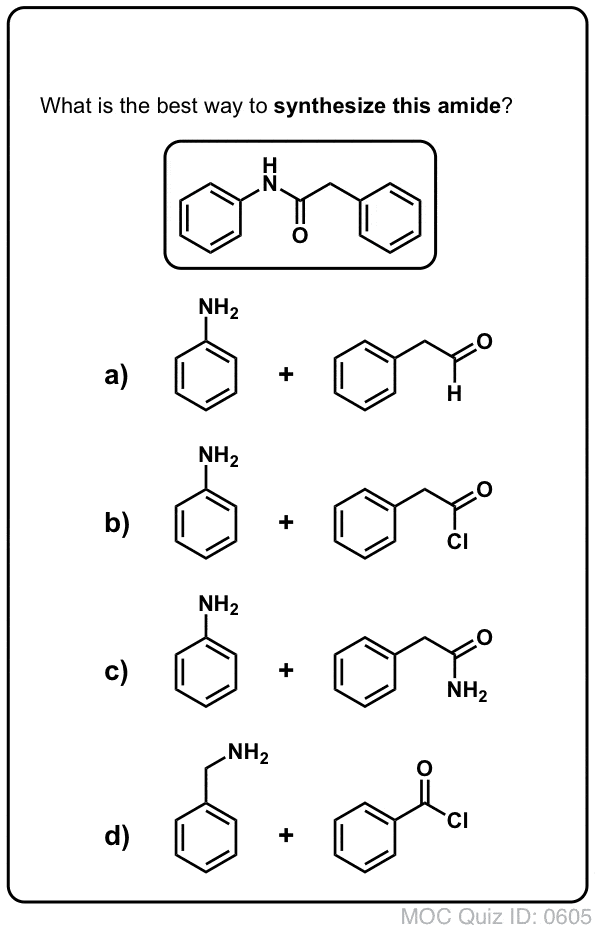
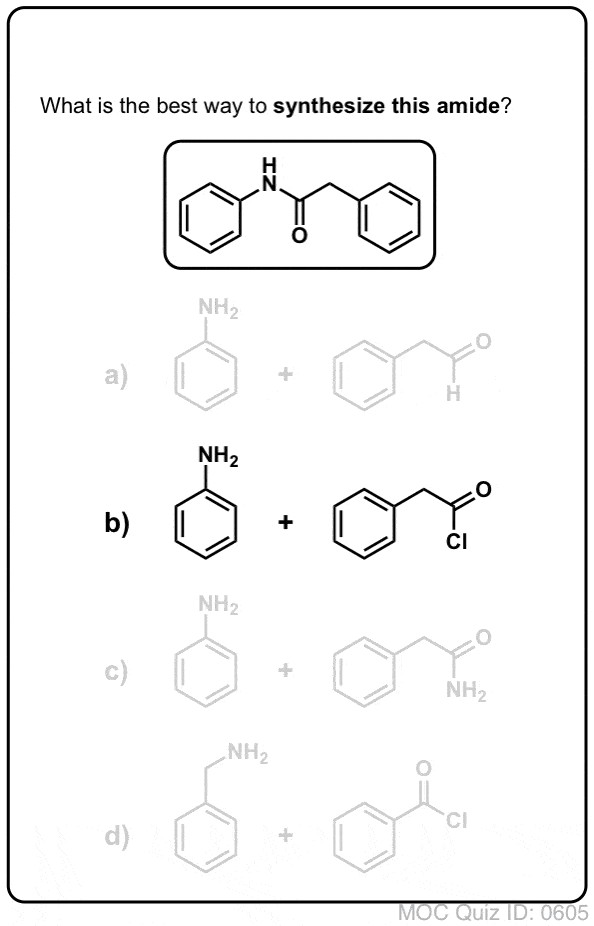
Synteza amidów, część 1. Nukleofilowa substytucja acylowa halogenków (lub bezwodników) aminami
Grupy acylowe przyłączone do dobrej grupy opuszczającej, takiej jak chlorki lub bezwodniki kwasów, mogą łatwo ulegać nukleofilowej substytucji acylowej nukleofilami aminowymi.
Jeśli na początek dostępny jest tylko kwas karboksylowy, użycie odczynnika takiego jak chlorek tionylu (SOCl2) do przekształcenia kwasu karboksylowego w chlorek kwasu jest dobrym pierwszym krokiem w przekształcaniu kwasu karboksylowego w amid. (PCl3, PCl5, chlorek oksalilu i wiele innych odczynników może również działać). Alternatywnie, traktowanie kwasu karboksylowego halogenkiem acylowym dostarczy bezwodnika, który również może być skuteczny.
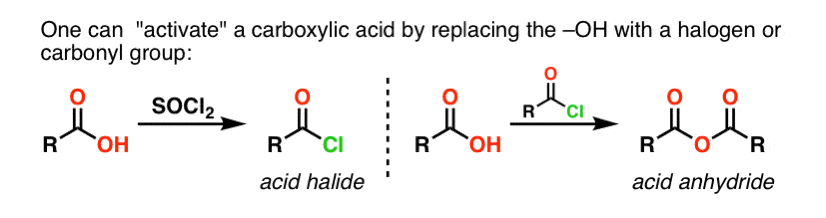
Halogenki (np. Cl- ) i karboksylany (RCO2- ) są znacznie słabszymi zasadami, a zatem znacznie lepszymi grupami opuszczającymi niż HO-. Tak więc dodając aminę do halogenku acylowego lub bezwodnika kwasowego, nukleofilowe podstawienie acylowe może zachodzić w znacznie łagodniejszych warunkach, dając w efekcie nasz pożądany amid.
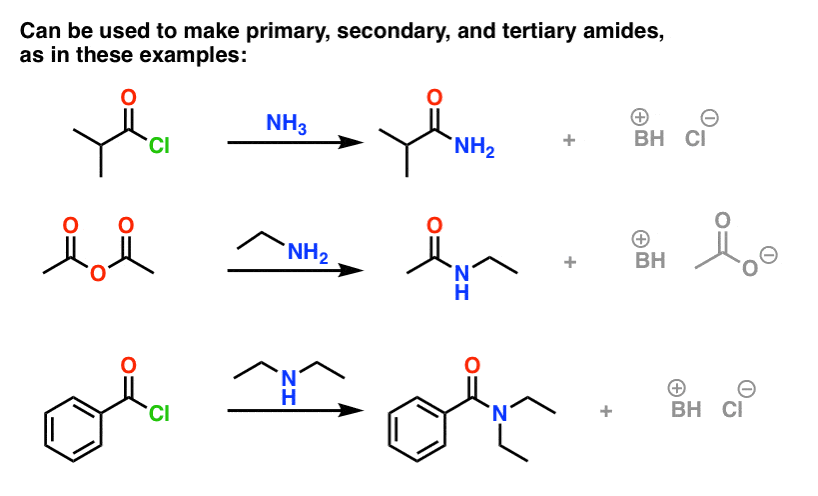
(Można otrzymać amidy poprzez reakcję estrów z aminami, ale biorąc pod uwagę, że alkoksydy są gorszymi grupami opuszczającymi niż halogenki lub karboksylany, ta metoda wymaga bardziej wymuszonych warunków. )
Jedną rzeczą, na którą należy zwrócić uwagę w przypadku halogenków kwasowych jest to, że proces generuje jeden równoważnik HCl jako produkt uboczny. W przypadku braku dodatkowej zasady, maksymalna wydajność procedury wynosiłaby 50%, ponieważ HCl protonowałby każdą aminę i uczyniłby z niej nie-nukleofilową sól amonową.
Jednym ze sposobów zapewnienia, że reakcja przebiega do końca jest dodanie drugiego równoważnika aminy. Istnieją inne praktyczne sposoby rozwiązania tego problemu, które przeniosłem do przypisu.
Jeśli potrzebujesz odświeżenia mechanizmu nukleofilowej substytucji acylowej, najedź tutaj, aby uzyskać wyskakujący obraz lub otwórz link obrazu tutaj:
.
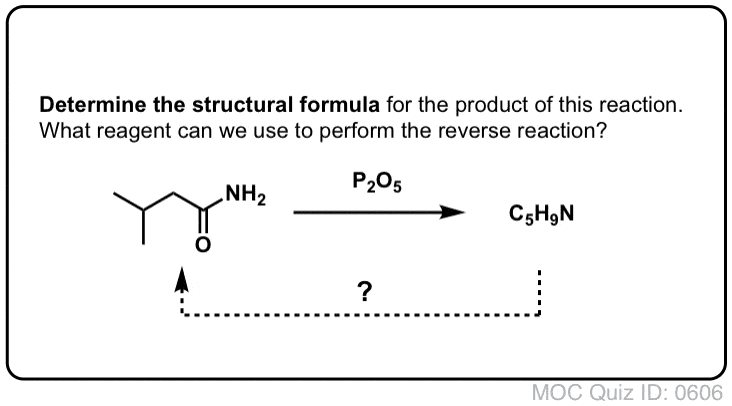
Synteza amidów, Część 2: Częściowa hydroliza nitryli
Jednym ze sposobów myślenia o nitrylach jest to, że są one zamaskowanymi kwasami karboksylowymi. Jeśli potraktuje się je wodnym kwasem i dużą ilością ciepła – w warunkach młota kowalskiego – można je zhydrolizować do kwasów karboksylowych.
Jednym z produktów pośrednich w tym procesie jest amid pierwszorzędowy.
Jeśli więc użyjemy nieco łagodniejszej techniki młota kowalskiego, czasami możliwe jest uratowanie amidu z naszej mieszaniny reakcyjnej, zanim zostanie on zhydrolizowany do kwasu karboksylowego.
Poniższy obrazek pokazuje, jak można zsyntetyzować amid z prekursora halogenku alkilu, poprzez reakcję good-ol' SN2:
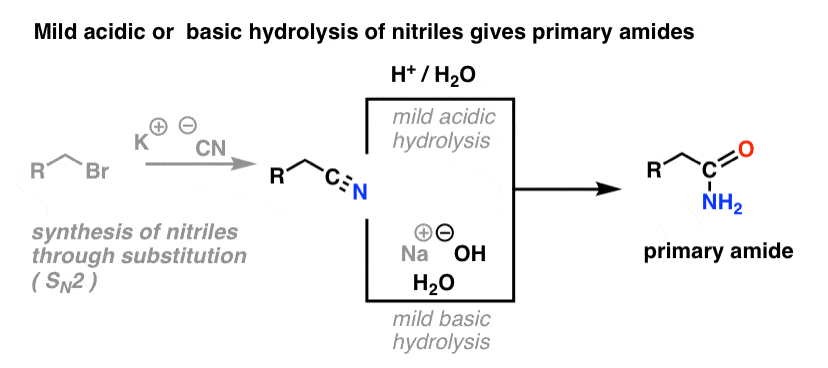
Co oznacza „łagodna” ? Jeden zestaw warunków dla hydrolizy fenyloacetamidu (PhCH2CN) do PhCH2CONH2 podaje warunki reakcji jako „HCl, H2O, 40-50°C, 1h”.
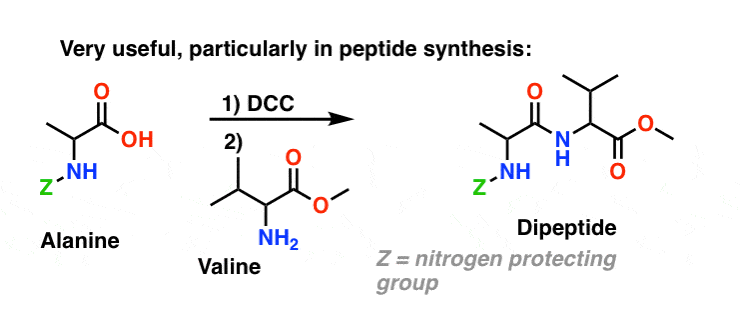
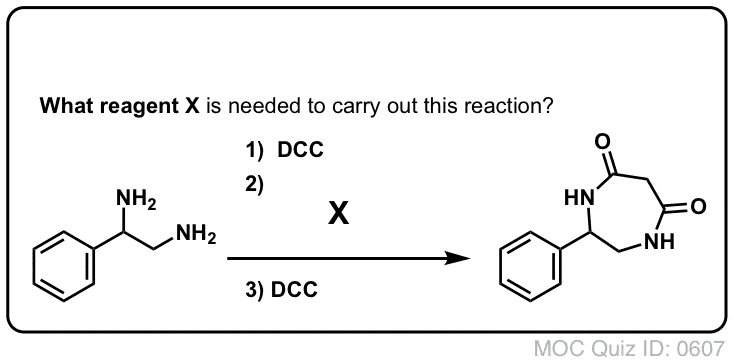
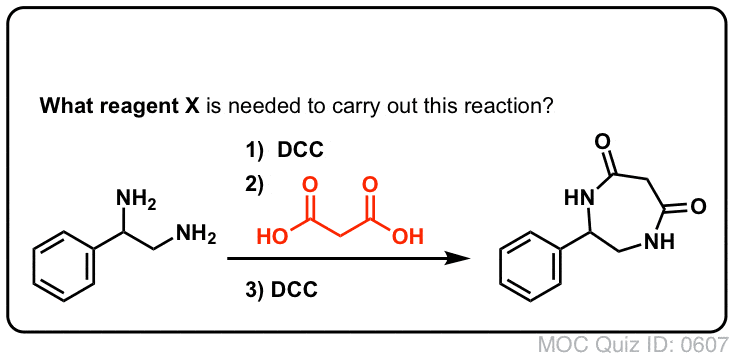
Synteza amidów, część 3: użycie odczynnika odwadniającego (takiego jak DCC)
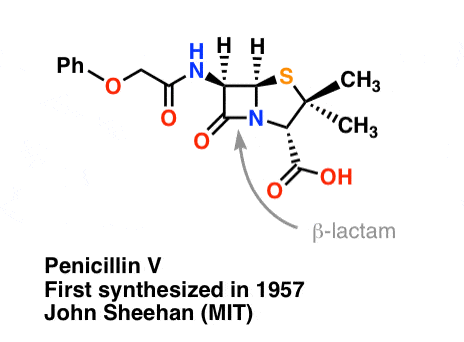
Synteza penicyliny V w 1957 r. przez grupę Johna Sheehana z MIT jest jednym z heroicznych osiągnięć powojennej chemii organicznej. Kluczowym problemem było skonstruowanie cyklicznego amidu (pierścienia β-laktamowego), który jest niezwykle niestabilny w środowisku kwaśnym. Miało to niebagatelne znaczenie, gdyż β-laktam jest również kluczowy dla mechanizmu działania penicyliny: zaburza syntezę ściany komórkowej bakterii. Próby wytworzenia tego cyklicznego amidu poprzez przekształcenie kwasu karboksylowego w halogenek acylowy za pomocą SOCl2, PCl3, PCl5 i wielu innych metod zakończyły się niepowodzeniem.
W odpowiedzi, grupa Sheehana sprytnie wynalazła bardzo łagodny odczynnik odwadniający: N, N'-dicykloheksylokarbodiimid (DCC), który pozwalał na tworzenie amidów w bardzo łagodnych warunkach przy neutralnym pH.
Dzisiaj DCC (i jego bardziej praktyczny (uwaga) kuzyn, EDC ) są szeroko stosowane do syntezy wrażliwych amidów – w szczególności peptydów – w bardzo łagodnych warunkach.
Pod wpływem warunków reakcji, tlen karboksylanowy przyłącza się do elektrofilowego węgla DCC, tworząc to, co nazywamy „aktywnym estrem” – innymi słowy, ester, który faktycznie ma przyzwoitą grupę opuszczającą (w przeciwieństwie do większości estrów, które nie mają). Aktywny ester jest następnie atakowany przez aminę w klasycznym nukleofilowym podstawieniu acylowym, co prowadzi do powstania amidu.
Patrząc na produkt uboczny, zauważ, że są tam dwa hydrogeny (każdy związany z azotem) i tlen (związany z centralnym węglem). To jest miejsce, gdzie H2O zniknęło!
Ponieważ ten post robi się absurdalnie długi, zapisałem mechanizm dla tego wyskakującego obrazka.
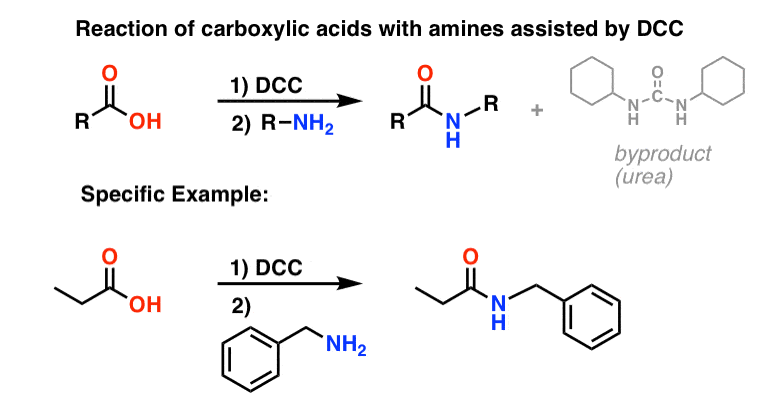
Ponieważ reakcja ta zachodzi w warunkach obojętnych, jest ona niezwykle przydatna w syntezie peptydów, które mogą ulegać racemizacji (właściwie epimeryzacji) zarówno w warunkach zasadowych, jak i kwasowych.
Podsumowanie: Trzy Efektywne Metody Syntezy Amidów
Zakończmy podsumowaniem tych trzech ważnych (ale w żadnym wypadku nie wyczerpujących) sposobów na otrzymanie amidów:
To kończy nasz post na temat głównych punktów nomenklatury amidów, właściwości i syntezy. Aby zapoznać się z dodatkową metodą syntezy amidów, czytaj dalej.
Let Us Briefly Consider A Fourth, Less Important Method: Brute Force
Ponieważ jest ona zwykle omawiana w podręcznikach, zakończmy rozważania rozważając czwartą możliwość – najprostszą jaką można sobie wyobrazić. Co jeśli weźmiemy kwas karboksylowy i połączymy go z aminą, mając nadzieję, że powstanie amid. Co się stanie?
Aminy to zasady, a kwasy karboksylowe to, cóż, kwasy. Dodaj je do siebie, a otrzymasz niewinną sól.
Czasami można wytworzyć amidy poprzez podgrzanie soli w zamkniętej probówce, wyrzucając z niej równowartość wody. Metoda ta nazywa się piroliza.
Metoda ta nie jest niczym innym, jak bezpośrednią i ma wszystkie subtelności haubicy.
Problem z pirolizą polega na tym, że grupa HO- kwasu karboksylowego jest okropną grupą opuszczającą.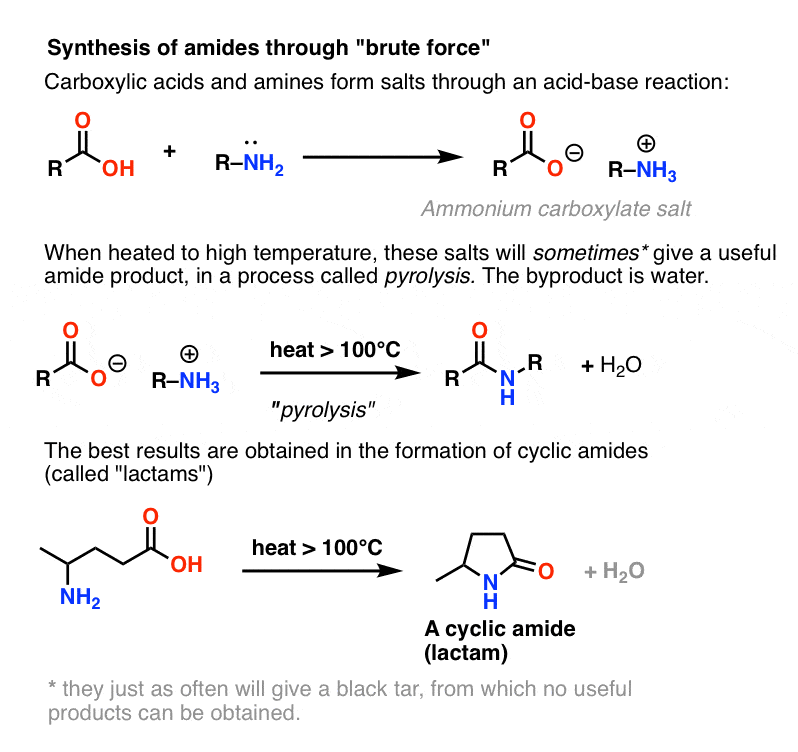
Aby utworzyć amid z tego gatunku, tlen karboksylanowy (O- ) musi w jakiś sposób odejść. Nie jest to łatwe, gdyż zasadą sprzężoną z O- jest anion podwójny O2- . Na każdej liście grup odchodzących, O2- uplasowałby się gdzieś pomiędzy, „gówniane” i „f&cking okropne”.
Jednakże, jeśli uderzy się w tę sól chemicznym odpowiednikiem młota Thora: brutalną siłą, wysoką temperaturą, może nastąpić seria przeniesień protonów z soli amonowej. ostatecznie uwalniając H2O i tworząc wiązanie C-N.
Ten proces nazywa się pirolizą (pyro = ogień, lysis = łamanie).
W niektórych przypadkach, zwłaszcza prostych amidów, a także przy tworzeniu prostych laktamów, proces ten może być zadowalający.
W wielu innych przypadkach prowadzi jednak do powstania czarnej smoły na dnie kolby, z której nie można otrzymać żadnego użytecznego produktu.
Jak każdy chemik organiczny może Ci powiedzieć, istnieje wiele różnych sposobów tworzenia trudnych do opanowania czarnych smół na dnie kolby, a to jest tylko jedna z metod. Pomyśl, jak wiele masz jeszcze do odkrycia!

„Hammer of Thor” Google Image Search był związany z chemią, ale zaskakująco NSFW.
Notatki
Zabawny, powiązany artykuł: Amides: Humble But Useful (z Chemical & Engineering News).
Jest też efekt indukcyjny, w którym elektronegatywny tlen (elektronegatywność 3.44) przyciąga elektrony przyłączonego węgla, który z kolei przyciąga elektrony azotu.
Uwaga 2. Bardzo powszechnym sposobem przeprowadzania tej reakcji jest zastosowanie tzw. warunków Schotten-Baumanna, w których pobiera się reagenty w rozpuszczalniku, takim jak eter dietylowy lub dichorometan, i dodaje wodny roztwór NaOH, w wyniku czego powstaje mieszanina dwufazowa. Powstałe sole amonowe mogą rozpuścić się w fazie wodnej, po czym są neutralizowane przez nadmiar zasady i wracają do fazy organicznej. Aminy są na ogół znacznie bardziej nukleofilowe niż jony wodorotlenkowe, więc hydroliza chlorku kwasu w celu otrzymania kwasu karboksylowego nie stanowi na ogół problemu.
Uwaga 3.
„W czasie mojej udanej syntezy penicyliny V w 1957 roku, porównałem problem próby syntezy penicyliny metodami klasycznymi do próby naprawy sprężyny głównej doskonałego zegarka za pomocą kowadła, młotka i szczypiec kowala” – John C. Sheehan
Uwaga 4. Problem z użyciem DCC polega na tym, że produkt uboczny, DCU, jest ogromnym wrzodem na tyłku, którego trzeba się pozbyć. Większość produktów ubocznych można łatwo usunąć za pomocą chromatografii kolumnowej. Nie DCU. Nie zwracając uwagi na polarność rozpuszczalnika, DCU wyłania się z kolumny powoli, kroplami i strużkami, zanieczyszczając każdą frakcję. EDC jest odmianą DCC, która posiada jednostkę trzeciorzędowej aminy; w ten sposób proste przemycie kwasem podczas obróbki usunie cały mocznik, oszczędzając wiele czasu i bólu głowy.
Następujący obraz pokazuje ostatni etap syntezy Sheehana przy użyciu DCC.
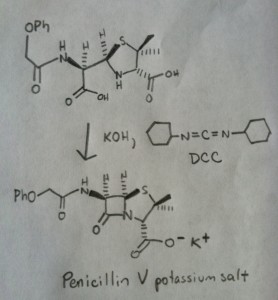
Obraz: Carmen Drahl/Chemical & Engineering News
Zapytaj się!
 Kliknij, aby przewrócić
Kliknij, aby przewrócić 
 Kliknij, aby przerzucić
Kliknij, aby przerzucić 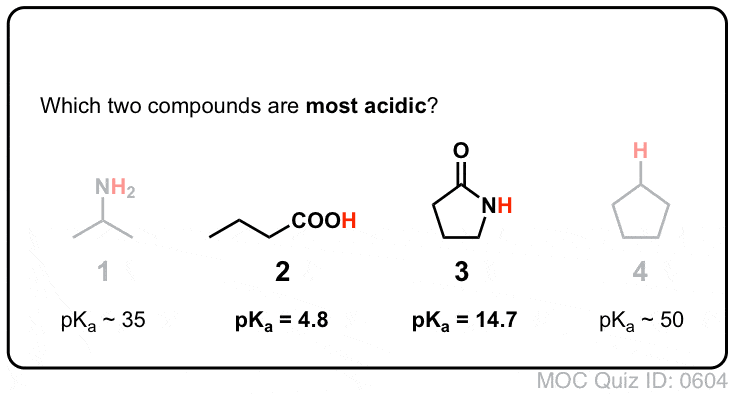
 Kliknij, aby przerzucić
Kliknij, aby przerzucić 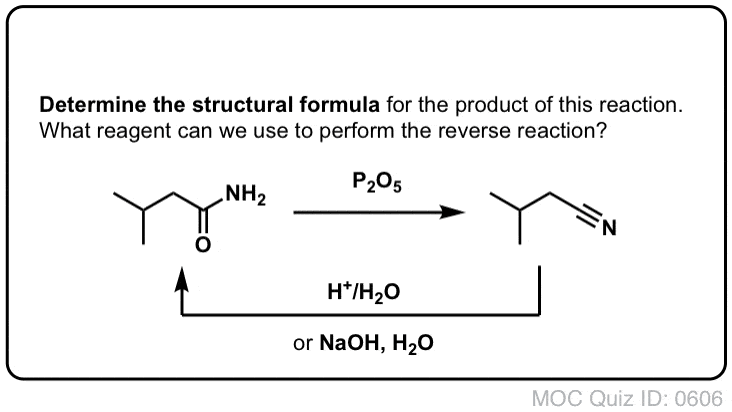
(Advanced) References and Further Reading
Hydroliza nitrylowa:
- PHENYLACETAMIDE
Wilhelm Wenner
Org Synth. 1952, 32, 92
DOI: 10.15227/orgsyn.032.0092
Warunki stosowane tutaj do hydratacji nitrylu do amidu są raczej łagodne – wykorzystuje się temperaturę 40 °C przez około 1 godz. - Halide-directed nitrile hydrolysis
James M. Photis
Tetrahedron Lett. 1980, 21 (37), 3539-3540
DOI: 10.1016/0040-4039(80)80228-0
Jest to przydatna procedura do selektywnej hydrolizy nitryli do pierwszorzędowych amidów, szczególnie w przypadku cyjanków aroilowych (np. PhCOCN). - Facile and Highly Selective Conversion of Nitriles to Amides via Indirect Acid-Catalyzed Hydration Using TFA or AcOH-H2SO4
Jarugu Narasimha Moorthy and Nidhi Singhal
The Journal of Organic Chemistry 2005, 70 (5), 1926-1929
DOI: 10.1021/jo048240aReakcja Schotten-Bauman:
#4 i #5 to oryginalne prace Schottena i Baumanna dotyczące prostej dwufazowej syntezy amidów. - Ueber die Oxydation des Piperidins
Schotten, C.
Ber. 1884, 17 (2), 2544-2547
DOI: 10.1002/cber.188401702178 - Ueber eine einfache Methode der Darstellung von Benzoësäureäthern
Baumann, E.
Ber. 1886, 19 (2), 3218-3222
DOI: 10.1002/cber.188601902348 - Enancjoselektywna całkowita synteza (-)-Kibdelonu C
John R. Butler, Chao Wang, Jianwei Bian, and Joseph M. Ready
Journal of the American Chemical Society 2011, 133 (26), 9956-9959
DOI: 1021/ja204040k
Skromna reakcja Schotten-Baumanna jest wykorzystywana nawet w wymagających syntezach totalnych – w tym przypadku służy do wytworzenia laktamu w 4 z 5 i 6! - BENZOYL PIPERIDINE
Marvel, C. S.; Lazier, W. A.
Org. Synth. 1929, 9, 16
DOI: 10.15227/orgsyn.009.0016
Ta procedura z Organic Syntheses, źródła niezależnie przetestowanych i powtarzalnych syntetycznych procedur laboratorium organicznego, jest klasyczną syntezą amidu Schotten-Baumanna. - A High-Throughput Process for Valsartan
Ulrich Beutler, Matthias Boehm, Peter C. Fuenfschilling, Thomas Heinz, Jean-Paul Mutz, Ulrich Onken, Martin Mueller, and Werner Zaugg
Organic Process Research & Development 2007, 11 (5), 892-898
DOI: 1021/op700120n
Organic Process & Research Development („OPRD”) jest doskonałym czasopismem dla chemii procesowej lub skalowania. W artykule pokazano, że reakcja Schotten-Baumanna (4 do 3) jest preferowana dla reakcji na dużą skalę, ponieważ jest prosta, solidna, łatwa do przeprowadzenia i nie ma dużych egzoterm (w przeciwieństwie do reakcji Grignarda, na przykład). - Sztuczka z nylonową liną: Demonstracja polimeryzacji kondensacyjnej
Paul W. Morgan i Stephanie L. Kwolek
Journal of Chemical Education 1959, 36 (4), 182
DOI: 1021/ed036p182
Klasyczna „sztuczka z liną nylonową”, w której wyciąga się sznurek nylonu z dwufazowej mieszaniny heksametylenodiaminy i chlorku sebacoilu, może być uważana za rodzaj reakcji Schotten-Baumanna, w tym sensie, że tworzy poliamid! Po raz pierwszy zostało to opracowane przez Stephanie Kwolek, która była wybitnym chemikiem w DuPont przez ponad 40 lat i była odpowiedzialna za odkrycie Kevlaru i rozwój chemii aramidów i innych materiałów o wysokiej wytrzymałości na rozciąganie.DCC: - A New Method of Forming Peptide Bonds
John C. Sheehan and George P. Hess
Journal of the American Chemical Society 1955, 77 (4), 1067-1068
DOI: 1021/ja01609a099
Oryginalna praca na temat syntezy wiązań peptydowych/wiązań amidowych przy użyciu DCC.DeTar opublikował serię prac badających mechanizm reakcji tworzenia wiązań z udziałem DCC i innych karbodiimidów, a oto dwie pierwsze: - Reakcje karbodiimidów. I. The Mechanisms of the Reactions of Acetic Acid with Dicyclohexylcarbodiimide
DeLos F. DeTar and Richard Silverstein
Journal of the American Chemical Society 1966, 88 (5), 1013-1019
DOI: 10.1021/ja00957a027 - Reactions of Carbodiimides. II. The Reactions of Dicyclohexylcarbodiimide with Carboxylic Acids in the Presence of Amines and Phenols
DeLos F. DeTar i Richard Silverstein
Journal of the American Chemical Society 1966, 88 (5), 1020-1023
DOI:1021/ja00957a028 - The Chemistry of Carbodiimides.
G. Khorana
Chemical Reviews 1953, 53 (2), 145-166
DOI: 10.1021/cr60165a001
Stara recenzja prof. Har Gobinda Khorany, który później otrzymał Nagrodę Nobla w dziedzinie medycyny za pracę wykazującą, że nukleotydy w DNA i RNA kodują syntezę białek. - ESTRYFIKACJA KWASÓW KARBOXYLOWYCH Z DICYCLOHEXYLCARBODIIMIDE/4-DIMETHYLAMINOPYRIDINE: tert-BUTYL ETHYL FUMARATE
Neises i Wolfgang Steglich
Org. Synth. 1985, 63, 183
DOI: 10.15227/orgsyn.063.0183
Jest to procedura selektywnej estryfikacji przy użyciu DCC – pozwala to na uniknięcie transestryfikacji, która zachodziłaby w zwykłych warunkach estryfikacji Fischera. Procedura ta pochodzi z Organic Syntheses, źródła wiarygodnych, niezależnie przetestowanych syntetycznych reakcji organicznych. - Synteza peptydów w fazie stałej. I. The Synthesis of a Tetrapeptide
B. Merrifield
Journal of the American Chemical Society 1963, 85 (14), 2149-2154
DOI: 10.1021/ja00897a025
Jest to jedna z najczęściej cytowanych prac w JACS, nie bez powodu – w zasadzie kładzie ona podwaliny pod SPPS i to, co jest teraz przemysłem wartym miliardy dolarów. Praca ta doprowadziła do przyznania Nagrody Nobla w dziedzinie chemii dla jej autora, Prof. R. Bruce Merrifielda (Rockefeller U.). Sprzężenia peptydów są wykonywane przy użyciu nikogo innego niż DCC. - Uwagi – Wygodna synteza rozpuszczalnych w wodzie karbodiimidów.
John Sheehan, Philip Cruickshank, and Gregory Boshart
The Journal of Organic Chemistry 1961, 26 (7), 2525-2528
DOI:1021/jo01351a600
Główną wadą DCC jest to, że oddzielenie DCU (dicykloheksylomocznika) w ten sposób wytworzonego może być kłopotliwe. Opracowano więc inne odczynniki, takie jak EDC (1-Etylo-3-(3′-dimetyloaminopropylo)karbodiimid), dla których powstający mocznik jest rozpuszczalny w wodzie i łatwo usuwany przez ekstrakcję. - Całkowita synteza antybiotyku z monocyklicznym laktonem peptydowym, etamycyny
John C. Sheehan i Stephen L. Ledis
Journal of the American Chemical Society 1973, 95 (3), 875-879
DOI:1021/ja00784a041
EDC został użyty do większości sprzężeń peptydowych w syntezie tego peptydu, który jest jednym z pierwszych cyklicznych peptydów, które zostały syntetycznie wytworzone.
.