
Obecnym modelem budowy atomu jest model kwantowo-mechaniczny. Tradycyjna chemia zaczyna się od badania cząstek elementarnych, atomów, molekuł, substancji, metali, kryształów i innych agregatów materii. Materia może być badana w stanie stałym, ciekłym, gazowym i plazmowym, w izolacji lub w połączeniu. Interakcje, reakcje i przemiany, które są badane w chemii są zwykle wynikiem oddziaływań między atomami, co prowadzi do zmiany układu wiązań chemicznych, które trzymają atomy razem. Takie zachowania są badane w laboratorium chemicznym.
Laboratorium chemiczne stereotypowo używa różnych form szkła laboratoryjnego. Jednak szkło nie jest kluczowym elementem chemii, a wiele eksperymentalnych (jak również stosowanych/przemysłowych) eksperymentów chemicznych odbywa się bez niego.

Reakcja chemiczna to przemiana pewnych substancji w jedną lub więcej różnych substancji. Podstawą takiej przemiany chemicznej jest zmiana rozmieszczenia elektronów w wiązaniach chemicznych między atomami. Można ją symbolicznie przedstawić za pomocą równania chemicznego, w którym podmiotem są zwykle atomy. Liczba atomów po lewej i prawej stronie w równaniu przemiany chemicznej jest równa. (Gdy liczba atomów po obu stronach jest nierówna, przemiana jest określana jako reakcja jądrowa lub rozpad promieniotwórczy). Rodzaj reakcji chemicznych, jakim może ulegać substancja, oraz zmiany energii, jakie mogą im towarzyszyć, są ograniczone pewnymi podstawowymi zasadami, zwanymi prawami chemicznymi.
Rozważania dotyczące energii i entropii są niezmiennie ważne w prawie wszystkich badaniach chemicznych. Substancje chemiczne są klasyfikowane pod względem ich struktury, fazy, a także składu chemicznego. Mogą być one analizowane przy użyciu narzędzi analizy chemicznej, np. spektroskopii i chromatografii. Naukowcy zajmujący się badaniami chemicznymi są znani jako chemicy. Większość chemików specjalizuje się w jednej lub kilku subdyscyplinach. Kilka pojęć jest niezbędnych do studiowania chemii; niektóre z nich to:
Materia
W chemii, materia jest definiowana jako wszystko, co ma masę spoczynkową i objętość (zajmuje przestrzeń) i jest zbudowane z cząstek. Cząstki tworzące materię mają również masę spoczynkową – nie wszystkie cząstki mają masę spoczynkową, jak np. foton. Materia może być czystą substancją chemiczną lub mieszaniną substancji.
Atom

Atom jest podstawową jednostką chemii. Składa się z gęstego jądra zwanego jądrem atomowym otoczonego przestrzenią zajmowaną przez chmurę elektronów. Jądro zbudowane jest z dodatnio naładowanych protonów i nienaładowanych neutronów (zwanych razem nukleonami), natomiast chmura elektronowa składa się z ujemnie naładowanych elektronów, które krążą wokół jądra. W atomie obojętnym ujemnie naładowane elektrony równoważą dodatni ładunek protonów. Jądro jest gęste; masa nukleonu jest w przybliżeniu 1,836 razy większa od masy elektronu, ale promień atomu jest około 10,000 razy większy od promienia jego jądra.
Atom jest również najmniejszą jednostką, która może być przewidziana do zachowania właściwości chemicznych pierwiastka, takich jak elektronegatywność, potencjał jonizacji, preferowany stan utlenienia, liczba koordynacyjna i preferowane rodzaje wiązań (np, metaliczne, jonowe, kowalencyjne).
Pierwiastek
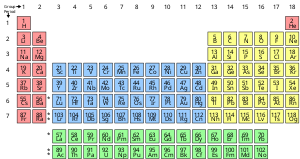
Pierwiastek chemiczny to czysta substancja, która składa się z jednego typu atomu, charakteryzującego się określoną liczbą protonów w jądrach swoich atomów, zwaną liczbą atomową i przedstawianą za pomocą symbolu Z. Liczba masowa jest sumą liczby protonów i neutronów w jądrze. Chociaż wszystkie jądra wszystkich atomów należących do jednego pierwiastka będą miały tę samą liczbę atomową, nie muszą mieć tej samej liczby masowej; atomy danego pierwiastka, które mają różne liczby masowe, nazywamy izotopami. Na przykład wszystkie atomy posiadające 6 protonów w jądrze są atomami pierwiastka chemicznego węgla, ale atomy węgla mogą mieć liczbę masową 12 lub 13.
Standardowa prezentacja pierwiastków chemicznych znajduje się w układzie okresowym, który porządkuje pierwiastki według liczby atomowej. Układ okresowy jest ułożony w grupy, czyli kolumny, i okresy, czyli wiersze. Układ okresowy jest przydatny do identyfikacji trendów okresowych.
Związki chemiczne

Związek chemiczny to czysta substancja chemiczna składająca się z więcej niż jednego pierwiastka. Właściwości związku wykazują niewielkie podobieństwo do właściwości jego pierwiastków. Standardowa nomenklatura związków chemicznych jest ustalana przez Międzynarodową Unię Chemii Czystej i Stosowanej (IUPAC). Związki organiczne są nazywane zgodnie z systemem nomenklatury organicznej. Nazwy dla związków nieorganicznych tworzone są zgodnie z systemem nomenklatury nieorganicznej. Gdy związek ma więcej niż jeden składnik, wtedy są one podzielone na dwie klasy, składnik elektropozytywny i składnik elektronegatywny. Ponadto Chemical Abstracts Service opracował metodę indeksowania substancji chemicznych. W tym systemie każda substancja chemiczna jest identyfikowalna przez numer znany jako jej numer rejestru CAS.
Molekuła

Cząsteczka to najmniejsza niepodzielna część czystej substancji chemicznej, która ma swój unikalny zestaw właściwości chemicznych, czyli potencjał do przechodzenia pewnego zestawu reakcji chemicznych z innymi substancjami. Jednak ta definicja sprawdza się tylko w przypadku substancji, które składają się z cząsteczek, co nie jest prawdą w przypadku wielu substancji (patrz poniżej). Molekuły są zazwyczaj zbiorem atomów połączonych ze sobą wiązaniami kowalencyjnymi, takimi, że struktura jest elektrycznie obojętna, a wszystkie elektrony walencyjne są sparowane z innymi elektronami albo w wiązaniach, albo w samotnych parach.
Tak więc molekuły istnieją jako elektrycznie obojętne jednostki, w przeciwieństwie do jonów. Kiedy ta reguła zostaje złamana, dając „cząsteczce” ładunek, wynik jest czasami nazywany jonem molekularnym lub jonem poliaminowym. Jednakże, dyskretna i oddzielna natura koncepcji molekularnej zazwyczaj wymaga, aby jony molekularne były obecne tylko w dobrze odseparowanej formie, takiej jak wiązka skierowana w próżni w spektrometrze mas. Naładowane zbiory polatomowe rezydujące w ciałach stałych (na przykład powszechne jony siarczanowe lub azotanowe) nie są na ogół uważane za „cząsteczki” w chemii. Niektóre cząsteczki zawierają jeden lub więcej niesparowanych elektronów, tworząc rodniki. Większość rodników jest stosunkowo reaktywna, ale niektóre, takie jak tlenek azotu (NO), mogą być stabilne.

Pierwiastki „obojętne” lub gazy szlachetne (hel, neon, argon, krypton, ksenon i radon) składają się z samotnych atomów jako ich najmniejszych dyskretnych jednostek, ale inne izolowane elementy chemiczne składają się albo z cząsteczek, albo z sieci atomów połączonych ze sobą w jakiś sposób. Identyfikowalne cząsteczki tworzą znane substancje, takie jak woda, powietrze i wiele związków organicznych, takich jak alkohol, cukier, benzyna i różne farmaceutyki.
Jednakże nie wszystkie substancje lub związki chemiczne składają się z dyskretnych cząsteczek i rzeczywiście większość substancji stałych, które tworzą stałą skorupę, płaszcz i jądro Ziemi, to związki chemiczne bez cząsteczek. Te inne rodzaje substancji, takie jak związki jonowe i sieciowe ciała stałe, są zorganizowane w taki sposób, że nie ma w nich identyfikowalnych cząsteczek per se. Zamiast tego, substancje te są omawiane w kategoriach jednostek wzoru lub komórek jednostkowych jako najmniejszej powtarzającej się struktury w ramach substancji. Przykładami takich substancji są sole mineralne (takie jak sól kuchenna), ciała stałe, takie jak węgiel i diament, metale oraz znane krzemionki i minerały krzemianowe, takie jak kwarc i granit.
Jedną z głównych cech cząsteczki jest jej geometria, często nazywana strukturą. Podczas gdy struktura cząsteczek dwuatomowych, trójatomowych lub czteroatomowych może być banalna (liniowa, kątowa piramidalna itp.), struktura cząsteczek wieloatomowych, które składają się z więcej niż sześciu atomów (kilku pierwiastków) może być kluczowa dla jej charakteru chemicznego.
Substancja i mieszanina






Przykłady czystych substancji chemicznych. Od lewej do prawej: pierwiastki cyna (Sn) i siarka (S), diament (alotrop węgla), sacharoza (czysty cukier) oraz chlorek sodu (sól) i wodorowęglan sodu (soda oczyszczona), które są związkami jonowymi.
Substancja chemiczna to rodzaj materii o określonym składzie i zestawie właściwości. Zbiór substancji nazywany jest mieszaniną. Przykładami mieszanin są powietrze i stopy.
Mol i ilość substancji
Mol to jednostka miary oznaczająca ilość substancji (zwaną również ilością chemiczną). Jeden mol zawiera dokładnie 6,02214076×1023 cząsteczek (atomów, molekuł, jonów lub elektronów), gdzie liczba cząsteczek na mol jest znana jako stała Avogadro. Stężenie molowe to ilość danej substancji na objętość roztworu, i jest powszechnie podawane w mol/dm3.
Faza

Oprócz specyficznych właściwości chemicznych, które wyróżniają różne klasyfikacje chemiczne, substancje chemiczne mogą występować w kilku fazach. W przeważającej części, klasyfikacje chemiczne są niezależne od tych masowych klasyfikacji faz; jednak niektóre bardziej egzotyczne fazy są niezgodne z pewnymi właściwościami chemicznymi. Faza jest zbiorem stanów układu chemicznego, które mają podobne właściwości strukturalne, w pewnym zakresie warunków, takich jak ciśnienie lub temperatura.
Właściwości fizyczne, takie jak gęstość i współczynnik załamania światła, mają tendencję do mieszczenia się w wartościach charakterystycznych dla danej fazy. Faza materii jest definiowana przez przejście fazowe, które ma miejsce, gdy energia wprowadzona do lub usunięta z układu idzie na zmianę struktury układu, zamiast na zmianę warunków masowych.
Czasami rozróżnienie między fazami może być ciągłe zamiast mieć dyskretną granicę' w tym przypadku materia jest uważana za znajdującą się w stanie nadkrytycznym. Kiedy trzy stany spotykają się na podstawie warunków, jest to znane jako punkt potrójny, a ponieważ jest to niezmienne, jest to wygodny sposób na określenie zestawu warunków.
Najbardziej znane przykłady faz to ciała stałe, ciecze i gazy. Wiele substancji wykazuje wiele faz stałych. Na przykład, istnieją trzy fazy żelaza w stanie stałym (alfa, gamma i delta), które różnią się w zależności od temperatury i ciśnienia. Podstawową różnicą pomiędzy fazami stałymi jest struktura krystaliczna, czyli układ atomów. Inną fazą powszechnie spotykaną w nauce chemii jest faza wodna, która jest stanem substancji rozpuszczonych w roztworze wodnym (czyli w wodzie).
Mniej znane fazy obejmują plazmy, kondensaty Bosego-Einsteina i kondensaty fermionowe oraz paramagnetyczne i ferromagnetyczne fazy materiałów magnetycznych. Podczas gdy większość znanych faz dotyczy układów trójwymiarowych, możliwe jest również zdefiniowanie analogów w układach dwuwymiarowych, co zyskało uwagę ze względu na swoje znaczenie dla układów w biologii.
Wiązanie

O atomach przylegających do siebie w cząsteczkach lub kryształach mówi się, że są ze sobą związane. Wiązanie chemiczne można zobrazować jako wielobiegunową równowagę między ładunkami dodatnimi w jądrach i oscylującymi wokół nich ładunkami ujemnymi. Więcej niż proste przyciąganie i odpychanie, energie i rozkłady charakteryzują dostępność elektronu do wiązania z innym atomem.
Wiązanie chemiczne może być wiązaniem kowalencyjnym, jonowym, wodorowym lub tylko z powodu siły Van der Waalsa. Każdemu z tych rodzajów wiązań przypisany jest jakiś potencjał. Potencjały te tworzą oddziaływania, które utrzymują atomy razem w cząsteczkach lub kryształach. W wielu prostych związkach, teoria wiązań walencyjnych, model odpychania par elektronów w powłoce walencyjnej (VSEPR) i koncepcja liczby utlenienia mogą być użyte do wyjaśnienia struktury i składu cząsteczek.
Wiązanie jonowe powstaje, gdy metal traci jeden lub więcej swoich elektronów, stając się dodatnio naładowanym kationem, a elektrony są następnie zdobywane przez atom niemetalu, stając się ujemnie naładowanym anionem. Dwa przeciwnie naładowane jony przyciągają się wzajemnie, a wiązanie jonowe jest elektrostatyczną siłą przyciągania między nimi. Na przykład, sód (Na), metal, traci jeden elektron, stając się kationem Na+, podczas gdy chlor (Cl), niemetal, zyskuje ten elektron, stając się Cl-. Jony te są utrzymywane razem dzięki elektrostatycznemu przyciąganiu i powstaje związek chlorek sodu (NaCl), czyli popularna sól kuchenna.

W wiązaniu kowalencyjnym jedna lub więcej par elektronów walencyjnych jest dzielona przez dwa atomy: powstała w ten sposób elektrycznie obojętna grupa połączonych atomów jest nazywana cząsteczką. Atomy będą dzielić elektrony walencyjne w taki sposób, aby stworzyć konfigurację elektronową gazu szlachetnego (osiem elektronów w najbardziej zewnętrznej powłoce) dla każdego atomu. Atomy, które mają tendencję do łączenia się w taki sposób, że każdy z nich ma osiem elektronów w swojej powłoce walencyjnej, są nazywane zgodnie z regułą oktetu. Jednak niektóre pierwiastki, takie jak wodór i lit potrzebują tylko dwóch elektronów w ich najbardziej zewnętrznej powłoce, aby osiągnąć tę stabilną konfigurację; te atomy są powiedziane, aby przestrzegać reguły duetu, i w ten sposób osiągają konfigurację elektronową gazu szlachetnego helu, który ma dwa elektrony w swojej zewnętrznej powłoce.
Podobnie, teorie z fizyki klasycznej mogą być używane do przewidywania wielu struktur jonowych. W przypadku bardziej skomplikowanych związków, takich jak kompleksy metali, teoria wiązań walencyjnych jest mniej przydatna i zazwyczaj stosuje się alternatywne podejścia, takie jak teoria orbitali molekularnych. Zobacz diagram na orbitalach elektronicznych.
Energia
W kontekście chemii energia jest atrybutem substancji będącym konsekwencją jej struktury atomowej, molekularnej lub agregatowej. Ponieważ przemianie chemicznej towarzyszy zmiana w jednym lub kilku z tych rodzajów struktur, niezmiennie towarzyszy jej wzrost lub spadek energii substancji biorących w niej udział. Część energii jest przekazywana między otoczeniem a reagentami reakcji w postaci ciepła lub światła; dlatego produkty reakcji mogą mieć więcej lub mniej energii niż reagenty.
Reakcja jest egzergoniczna, jeśli stan końcowy jest niższy na skali energetycznej niż stan początkowy; w przypadku reakcji endergonicznych sytuacja jest odwrotna. Reakcja jest egzotermiczna, jeżeli uwalnia ciepło do otoczenia; w przypadku reakcji endotermicznych reakcja pochłania ciepło z otoczenia.
Reakcje chemiczne są niezmiennie niemożliwe, jeżeli reagenty nie pokonają bariery energetycznej zwanej energią aktywacji. Szybkość reakcji chemicznej (w danej temperaturze T) jest związana z energią aktywacji E, przez współczynnik populacji Boltzmanna e – E / k T {{displaystyle e^{-E/kT}}

– czyli prawdopodobieństwo, że cząsteczka będzie miała energię większą lub równą E w danej temperaturze T. Ta wykładnicza zależność szybkości reakcji od temperatury znana jest jako równanie Arrheniusa.Energia aktywacji niezbędna do zajścia reakcji chemicznej może mieć postać ciepła, światła, energii elektrycznej lub siły mechanicznej w postaci ultradźwięków. termodynamice chemicznej bardzo użytecznym sposobem przewidywania wykonalności reakcji i określania stanu równowagi reakcji chemicznej jest powiązana koncepcja energii swobodnej, która obejmuje również rozważania na temat entropii. Reakcja jest wykonalna tylko wtedy, gdy całkowita zmiana w swobodnej energii Gibbsa jest ujemna, Δ G ≤ 0 {Delta G ≤ 0,}

; jeśli jest równa zeru, mówi się, że reakcja chemiczna jest w stanie równowagi.
Istnieją tylko ograniczone możliwe stany energetyczne dla elektronów, atomów i cząsteczek. Są one określone przez zasady mechaniki kwantowej, które wymagają kwantyzacji energii związanego systemu. Atomy/molekuły znajdujące się w wyższym stanie energetycznym nazywane są wzbudzonymi. Cząsteczki/atomy substancji w stanie wzbudzonym są często znacznie bardziej reaktywne; to znaczy, bardziej podatne na reakcje chemiczne.
Faza substancji jest niezmiennie określana przez jej energię i energię otoczenia. Kiedy siły międzycząsteczkowe substancji są takie, że energia otoczenia nie jest wystarczająca do ich pokonania, występuje ona w bardziej uporządkowanej fazie, takiej jak ciecz lub ciało stałe, jak w przypadku wody (H2O); ciecz w temperaturze pokojowej, ponieważ jej cząsteczki są związane wiązaniami wodorowymi. Natomiast siarkowodór (H2S) jest gazem w temperaturze pokojowej i ciśnieniu standardowym, ponieważ jego cząsteczki są związane słabszymi oddziaływaniami dipolowo-dipolowymi.
Przekazywanie energii z jednej substancji chemicznej do drugiej zależy od wielkości kwantów energii emitowanych z jednej substancji. Jednak energia cieplna jest często łatwiej przenoszona z prawie każdej substancji do innej, ponieważ fonony odpowiedzialne za wibracyjne i rotacyjne poziomy energetyczne w substancji mają znacznie mniejszą energię niż fotony przywoływane do elektronicznego transferu energii. Tak więc, ponieważ wibracyjne i rotacyjne poziomy energii są bardziej oddalone od siebie niż elektroniczne poziomy energii, ciepło jest łatwiej przenoszone między substancjami w porównaniu ze światłem lub innymi formami energii elektronicznej. Na przykład, ultrafioletowe promieniowanie elektromagnetyczne nie jest przenoszone z taką skutecznością z jednej substancji do drugiej, jak energia cieplna lub elektryczna.
Istnienie charakterystycznych poziomów energii dla różnych substancji chemicznych jest przydatne do ich identyfikacji poprzez analizę linii widmowych. W spektroskopii chemicznej często stosowane są różne rodzaje widm, np. IR, mikrofalowe, NMR, ESR itp. Spektroskopia jest również wykorzystywana do identyfikacji składu odległych obiektów – takich jak gwiazdy i odległe galaktyki – poprzez analizę ich widm promieniowania.

Termin energia chemiczna jest często używany do wskazania potencjału substancji chemicznej do przejścia przemiany poprzez reakcję chemiczną lub do przekształcenia innych substancji chemicznych.
Reakcja

Gdy substancja chemiczna ulega przemianie w wyniku jej oddziaływania z inną substancją lub z energią, mówi się, że zaszła reakcja chemiczna. Reakcja chemiczna jest więc pojęciem związanym z „reakcją” substancji, gdy wchodzi ona w bliski kontakt z inną, czy to w postaci mieszaniny, czy roztworu; poddanie jej działaniu jakiejś formy energii, lub obu tych czynników. Skutkuje to pewną wymianą energii pomiędzy składnikami reakcji, jak również ze środowiskiem układu, którym mogą być zaprojektowane naczynia – często szklane naczynia laboratoryjne.
Reakcje chemiczne mogą prowadzić do tworzenia lub dysocjacji cząsteczek, to znaczy do rozpadu cząsteczek w celu utworzenia dwóch lub więcej cząsteczek lub do rearanżacji atomów wewnątrz lub w poprzek cząsteczek. Reakcje chemiczne zazwyczaj wiążą się z tworzeniem lub zrywaniem wiązań chemicznych. Utlenianie, redukcja, dysocjacja, neutralizacja kwasowo-zasadowa i rearanżacja molekularna to niektóre z powszechnie stosowanych rodzajów reakcji chemicznych.
Reakcja chemiczna może być symbolicznie przedstawiona za pomocą równania chemicznego. Podczas gdy w niejądrowej reakcji chemicznej liczba i rodzaj atomów po obu stronach równania są równe, w przypadku reakcji jądrowej dotyczy to tylko cząstek jądrowych, takich jak protony i neutrony.
Sekwencja kroków, w których reorganizacja wiązań chemicznych może zachodzić w trakcie reakcji chemicznej, nazywana jest jej mechanizmem. Można sobie wyobrazić, że reakcja chemiczna przebiega w wielu etapach, z których każdy może mieć inną szybkość. Można zatem przewidzieć, że w trakcie reakcji może powstać wiele produktów pośrednich o różnej stabilności. Mechanizmy reakcji są proponowane w celu wyjaśnienia kinetyki i względnego składu produktów reakcji. Wielu chemików fizycznych specjalizuje się w badaniu i proponowaniu mechanizmów różnych reakcji chemicznych. Kilka reguł empirycznych, takich jak reguły Woodwarda-Hoffmanna, często przydaje się podczas proponowania mechanizmu dla reakcji chemicznej.
Zgodnie ze złotą księgą IUPAC reakcja chemiczna to „proces, którego wynikiem jest wzajemna konwersja gatunków chemicznych”. Zgodnie z tym, reakcja chemiczna może być reakcją elementarną lub reakcją stopniową. Dodatkowym zastrzeżeniem jest to, że definicja ta obejmuje przypadki, w których wzajemna konwersja konformerów jest obserwowalna doświadczalnie. Takie wykrywalne reakcje chemiczne zwykle dotyczą zbiorów jednostek molekularnych, jak wskazuje ta definicja, ale często koncepcyjnie wygodnie jest używać tego terminu również do zmian dotyczących pojedynczych jednostek molekularnych (tj. „mikroskopowych zdarzeń chemicznych”).
Jony i sole

Jon to naładowany gatunek, atom lub cząsteczka, który stracił lub zyskał jeden lub więcej elektronów. Gdy atom traci elektron, a zatem ma więcej protonów niż elektronów, atom jest dodatnio naładowanym jonem lub kationem. Kiedy atom zyskuje elektron i w związku z tym ma więcej elektronów niż protonów, jest ujemnie naładowanym jonem lub anionem. Kationy i aniony mogą tworzyć siatkę krystaliczną soli obojętnych, takich jak jony Na+ i Cl- tworzące chlorek sodu, czyli NaCl. Przykładami jonów wieloatomowych, które nie ulegają rozszczepieniu podczas reakcji kwasowo-zasadowych są wodorotlenek (OH-) i fosforan (PO43-).
Plazma składa się z materii gazowej, która została całkowicie zjonizowana, zwykle przez wysoką temperaturę.
Kwaśność i zasadowość

Substancja może być często klasyfikowana jako kwas lub zasada. Istnieje kilka różnych teorii, które wyjaśniają zachowanie kwasów i zasad. Najprostszą jest teoria Arrheniusa, która mówi, że kwas to substancja, która wytwarza jony hydroniowe, gdy jest rozpuszczona w wodzie, a zasada to taka, która wytwarza jony wodorotlenkowe, gdy jest rozpuszczona w wodzie. Zgodnie z teorią kwasowo-zasadową Brønsteda-Lowry’ego, kwasy to substancje, które w reakcji chemicznej przekazują dodatni jon wodorowy innej substancji, a zasada to substancja, która otrzymuje ten jon wodorowy.
Trzecia popularna teoria to teoria kwasowo-zasadowa Lewisa, która opiera się na tworzeniu nowych wiązań chemicznych. Teoria Lewisa wyjaśnia, że kwas to substancja, która jest w stanie przyjąć parę elektronów od innej substancji w procesie tworzenia wiązania, natomiast zasada to substancja, która może dostarczyć parę elektronów do utworzenia nowego wiązania. Zgodnie z tą teorią, kluczowymi elementami podlegającymi wymianie są ładunki. Istnieje kilka innych sposobów, w jaki substancja może być sklasyfikowana jako kwas lub zasada, co jest widoczne w historii tego pojęcia.
Siła kwasu jest powszechnie mierzona za pomocą dwóch metod. Jedną z nich, opartą na definicji kwasowości Arrheniusa, jest pomiar pH, który jest miarą stężenia jonów hydroniowych w roztworze, wyrażoną w ujemnej skali logarytmicznej. Tak więc, roztwory o niskim pH mają wysokie stężenie jonów hydroniowych i można powiedzieć, że są bardziej kwaśne. Inną miarą, opartą na definicji Brønsteda-Lowry’ego, jest stała dysocjacji kwasu (Ka), która mierzy względną zdolność substancji do działania jako kwas zgodnie z definicją kwasu Brønsteda-Lowry’ego. Oznacza to, że substancje o wyższej wartości Ka są bardziej skłonne do oddawania jonów wodorowych w reakcjach chemicznych niż te o niższych wartościach Ka.
Redoks
Reakcje redoks (redukcja-utlenianie) obejmują wszystkie reakcje chemiczne, w których atomy mają zmieniony stan utlenienia poprzez albo zyskanie elektronów (redukcja) albo utratę elektronów (utlenianie). Substancje, które mają zdolność utleniania innych substancji są określane jako utleniacze i znane są jako czynniki utleniające, utleniacze lub utleniacze. Utleniacz usuwa elektrony z innej substancji. Podobnie, substancje, które mają zdolność redukowania innych substancji są nazywane reduktorami i znane są jako reduktory, reduktanty lub reduktory.
Reduktant przenosi elektrony na inną substancję i w ten sposób sam jest utleniany. A ponieważ „oddaje” elektrony, jest również nazywany dawcą elektronów. Utlenianie i redukcja właściwie odnoszą się do zmiany liczby utleniania – rzeczywiste przeniesienie elektronów może nigdy nie nastąpić. Dlatego utlenianie jest lepiej zdefiniowane jako wzrost liczby utleniania, a redukcja jako spadek liczby utleniania.
Równowaga
Chociaż pojęcie równowagi jest szeroko stosowane w różnych naukach, w kontekście chemii pojawia się ono zawsze wtedy, gdy możliwych jest kilka różnych stanów składu chemicznego, jak na przykład w mieszaninie kilku związków chemicznych, które mogą reagować ze sobą, lub gdy substancja może występować w więcej niż jednym rodzaju fazy.
Układ substancji chemicznych w stanie równowagi, mimo że ma niezmienny skład, najczęściej nie jest statyczny; cząsteczki substancji nadal reagują ze sobą, co daje początek równowadze dynamicznej. Tak więc pojęcie to opisuje stan, w którym parametry takie jak skład chemiczny pozostają niezmienione w czasie.
Prawa chemiczne
Reakcje chemiczne rządzą się pewnymi prawami, które stały się fundamentalnymi pojęciami w chemii. Niektóre z nich to:
- Prawo Avogadro
- Prawo Beera-Lamberta
- Prawo Boyle’a (1662 r, odnoszące się do ciśnienia i objętości)
- Prawo Charlesa (1787, odnoszące się do objętości i temperatury)
- Prawo dyfuzji Ficka
- Prawo Gay-Lussaca (1809, odnoszące się do ciśnienia i temperatury)
- Zasada Le Chateliera
- Prawo Henry’ego
- Prawo Hessa
- Prawo zachowania energii prowadzi do ważnych pojęć równowagi, termodynamiki i kinetyki.
- Prawo zachowania masy nadal jest zachowane w układach izolowanych, nawet we współczesnej fizyce. Jednak szczególna względność pokazuje, że z powodu równoważności masa-energia, gdy tylko niematerialna „energia” (ciepło, światło, energia kinetyczna) jest usuwana z nieizolowanego systemu, część masy zostanie utracona wraz z nią. Duże straty energii powodują utratę masy, co jest ważnym tematem w chemii jądrowej.
- Prawo stałego składu, chociaż w wielu układach (zwłaszcza w biomakromolekułach i minerałach) proporcje wymagają dużych liczb i często są przedstawiane jako ułamki.
- Prawo wielokrotnych proporcji
- Prawo Raoulta