Enolizacja lub keto-enol tautomeryzm jest procesem przekształcania ketonu lub aldehydu do odpowiedniego enolu (w warunkach kwaśnych) lub enolanu (w warunkach zasadowych). Proces ten może zachodzić również w estrach. W tym poście skupię się jednak na aldehydach i ketonach, żeby nie przeładować go szczegółami i niuansami.
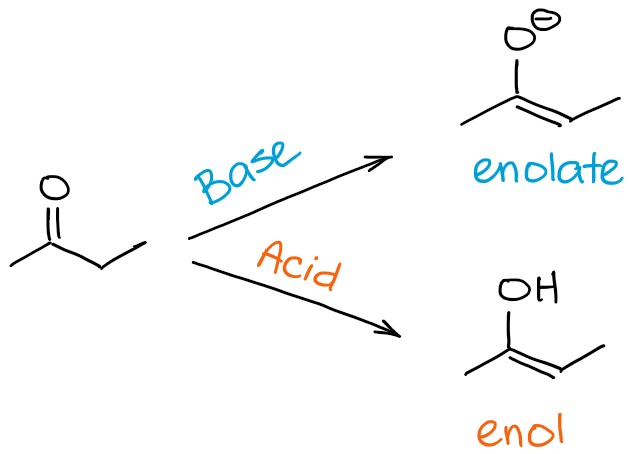
Więc, jaka jest różnica między procesami enolizacji i tautomeryzacji keto-enolowej? Krótka odpowiedź brzmi: tak naprawdę żadna 😊
Gdy odnosimy się do enolizacji, odnosimy się konkretnie do procesu, który przenosi cię z ketonu lub aldehydu do enolu lub enolanu. Kiedy odnosimy się do tautomeryzmu keto-enol, mamy na myśli równowagę w ogóle. Tak więc, mówiąc, że moja cząsteczka ulega tautomeryzacji keto-enolowej, mogę sugerować kierunek procesu, ale na ogół nie wskazuję go per se. Kierunek tautomeryzacji keto-enolowej można jednak często wywnioskować z kontekstu reakcji.
W skrócie, jeśli mówimy, że cząsteczka „A” ulega enolizacji, oznacza to, że „A” staje się enolem lub enolanem. Jeśli mówimy, że cząsteczka „B” ulega tautomeryzacji keto-enolowej, może to oznaczać enolizację, jeśli B jest karbonylem, lub może to oznaczać proces odwrotny, jeśli B jest już enolem lub enolanem.
Enolizacja katalizowana zasadą
Choć enolizacja może zachodzić zarówno w warunkach zasadowych, jak i kwasowych, enolizacja katalizowana zasadą jest częstszym sposobem przeprowadzania tej reakcji. Dlatego uważam, że dobrym pomysłem jest omówienie enolizacji w warunkach zasadowych jako pierwszej.
W warunkach zasadowych, keton lub aldehyd działa jak kwas Brønsteda, oddając proton z węgla α do zasady w roztworze. W wyniku tego procesu powstaje rezonansowo stabilizowany anion enolanowy:

Ponieważ w tej równowadze nasz karbonyl działa jak kwas, musi być wystarczająco kwaśny, aby oddać proton. Alternatywnie, zasada musi być wystarczająco silna, aby napędzać tę równowagę w kierunku produktu.
Jak kwaśne są hydrogeny na węglach α?
Anion enolanowy jest gatunkiem stabilizowanym rezonansowo, więc stopień stabilizacji rezonansowej odgrywa bardzo istotną rolę w kwasowości związków karbonylowych. Wiemy, że im więcej wkładów rezonansowych możemy narysować dla sprzężonej zasady, tym jest ona bardziej stabilna. A im bardziej stabilna baza sprzężona, tym bardziej kwaśny jest kwas wyjściowy. Tak więc, hydrogeny pomiędzy dwoma wiązaniami C=O będą znacznie bardziej kwaśne niż te obok tylko jednego C=O.
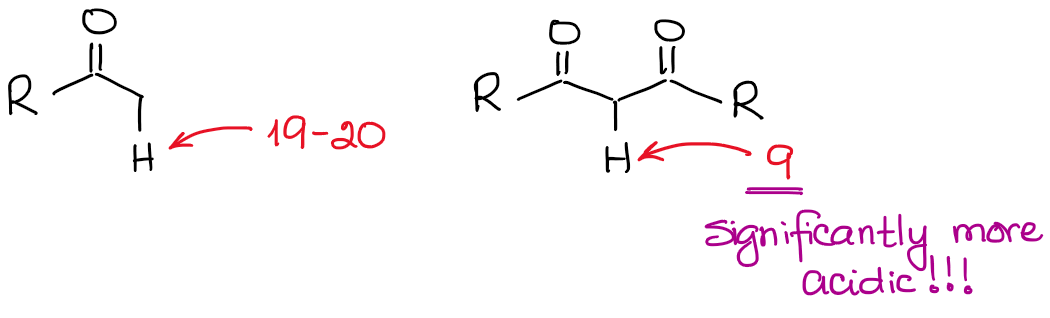
Jeśli porównamy zasady sprzężone w obu przypadkach, zobaczymy, że dikarbonyl ma lepszą stabilizację rezonansową ładunku ujemnego dzięki bardziej rozbudowanemu układowi sprzężonemu.
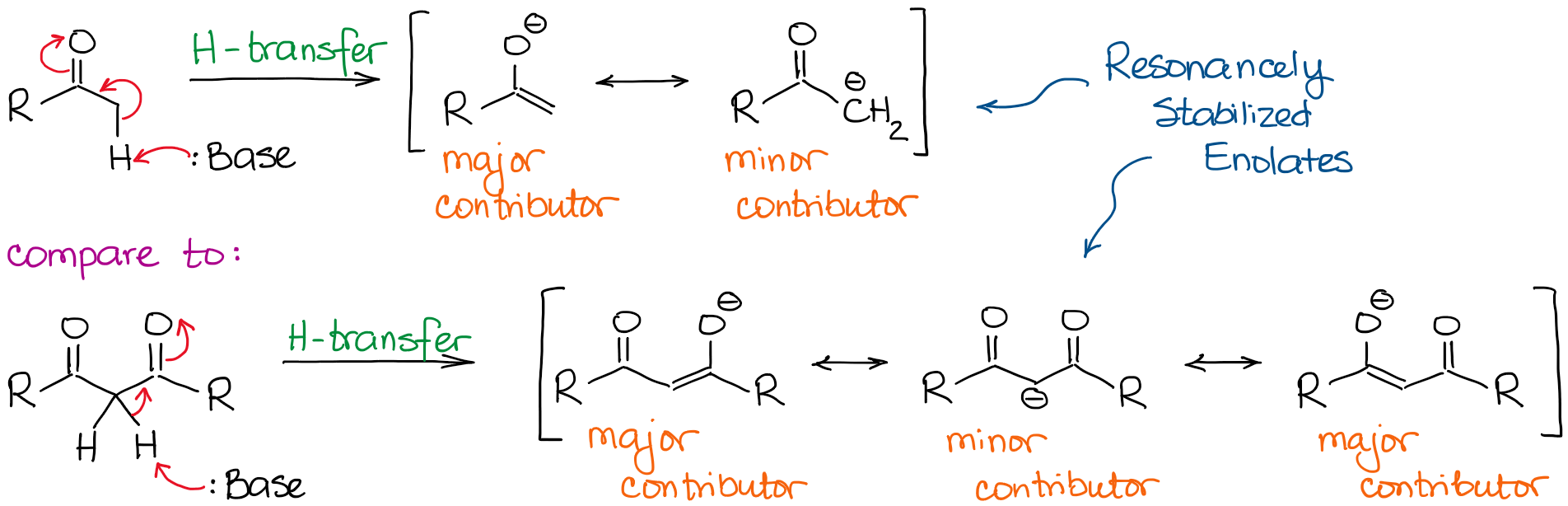
Dodatkowy istotny czynnik rezonansowy w anionie dikarbonylowym czyni cząsteczkę około 10000000000 razy bardziej kwaśną! Tak więc, natura ketonu lub aldehydu jest tutaj dość jasna: im więcej wiązań C=O obok wodoru, tym bardziej kwaśna się staje.
Wpływ zasady na równowagę enolizacyjną
Zasady mają bardzo różne siły. Tak więc, wybór bazy jest ważny, jeśli chcesz doprowadzić równowagę do końca. Przyjrzyjmy się kilku zasadom, które zazwyczaj spotykamy w reakcjach chemii organicznej:
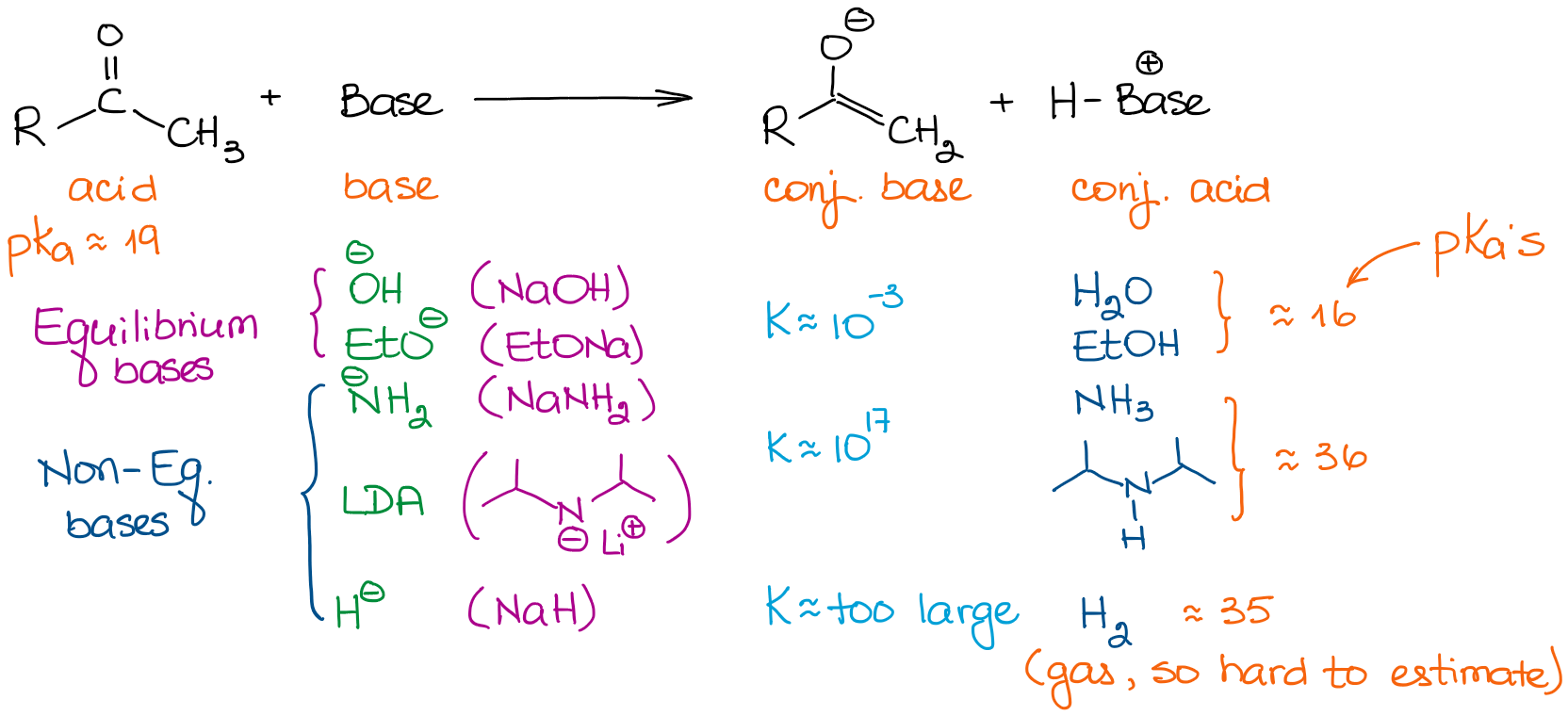
Gdy mamy do czynienia z prostymi aldehydami i ketonami, wszystkie zasady możemy podzielić na dwie kategorie: zasady równowagowe i zasady nierównowagowe. Zasady równowagowe są stosunkowo słabe. Oznacza to, że mogą one tylko w bardzo niewielkim stopniu wpływać na równowagę. W związku z tym rzeczywiste stężenie enolanu w roztworze będzie bardzo małe. Reakcja będzie również przebiegać w stałej równowadze pomiędzy materiałem wyjściowym a enolanem. Zasady te sprzyjają tworzeniu się bardziej stabilnych termodynamicznie enolanów. Enolany te nazywane są enolanami termodynamicznymi.
Nierównowagowe zasady, jednakże, są bardzo silne. Prowadzi to do reakcji przeniesienia protonu (kwasowo-zasadowej) z bardzo dużymi stałymi równowagi. Kiedy mamy stałą równowagową powyżej 103, równowaga jest prawie całkowicie przesunięta w kierunku produktów. Tak więc, enolizacja z zasadą taką jak LDA daje praktycznie 100% enolizację. Tak więc, stężenie początkowego aldehydu lub ketonu jest w zasadzie zerowe.
Karbonyle z jednym wiązaniem C=O vs β-Dikarbonyle
Jak wspomniałem powyżej, β-dikarbonyle są znacznie bardziej kwaśne niż zwykłe aldehydy i ketony. Spójrzmy na stałą równowagi w następujących dwóch przypadkach:
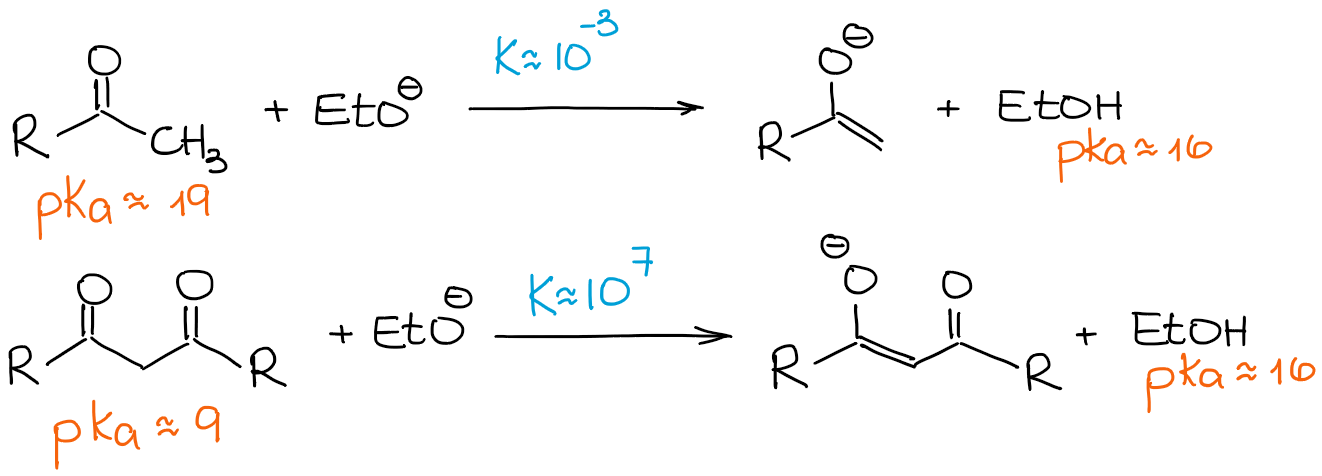
Ponieważ β-dikarbonyl jest o wiele bardziej kwaśny niż zwykły aldehyd czy keton, nawet słaba zasada kieruje równowagę w stronę produktów dających 100% enolizację. Tak więc, będziemy patrzeć na każdą reakcję enolizacji β-dikarbonyli jako na proces 100% enolatu i 0% materiału wyjściowego, niezależnie od zasady.
Dlaczego wybór zasady jest ważny?
Niektóre reakcje mogą być bardzo wrażliwe na to, co znajduje się w roztworze i jakie są stężenia reagentów. Na przykład, aldehydy są elektrofilowe, podczas gdy enolany są nukleofilowe. Tak więc, jeśli używam słabej, nie równowagowej zasady, która pozostawia dużo materiału wyjściowego w roztworze, mogę zacząć obserwować niepożądaną reakcję pomiędzy enolanem a wyjściowym aldehydem. Ogólnie rzecz biorąc, słabe zasady równowagowe są stosowane tylko wtedy, gdy nie spodziewamy się dużej konkurencji pomiędzy możliwymi produktami. Jeśli wiele reakcji jest możliwych i żaden pojedynczy główny produkt nie dominuje w równowadze, zawsze będziemy używać silnych zasad nierównowagowych.
Wielkie vs małe bazy
Rozmiar bazy może być czynnikiem decydującym w procesie enolizacji, gdy konkuruje ze sobą wiele enolizowalnych pozycji w cząsteczce. Przyjrzyjmy się enolizacji 2-metylobutanonu przez dwie silne zasady:
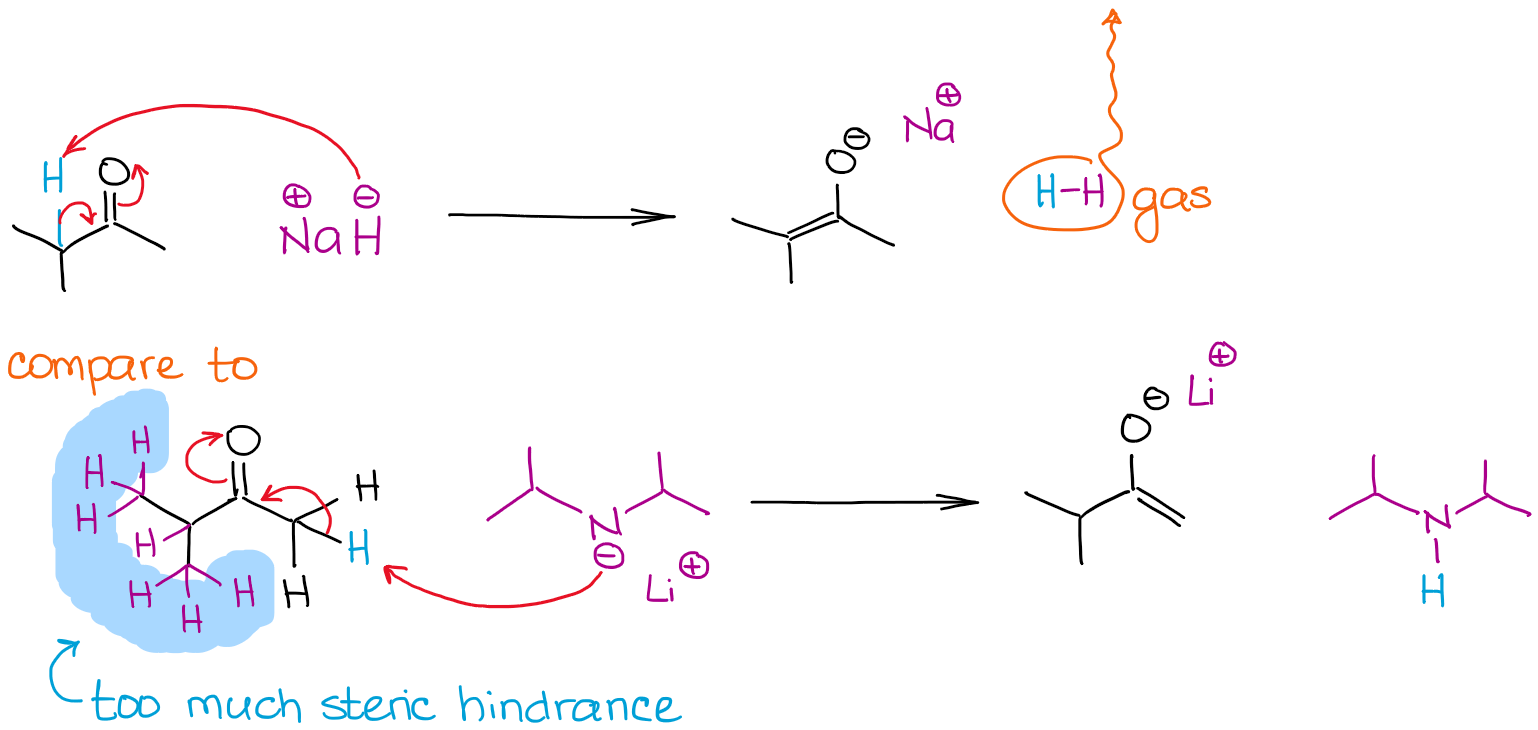
Obydwie reakcje dają 100% enolizację z powodu użycia bardzo silnych zasad nierównowagowych. Jednakże reakcja z wodorkiem sodu (NaH) daje bardziej stabilny termodynamicznie enolan. W przeciwieństwie do LDA, anion wodorkowy jest bardzo mały, więc może łatwo dotrzeć do bardziej sterycznie utrudnionego protonu i dać termodynamicznie stabilny enolan. LDA jest bardzo nieporęczny i dlatego jest bardzo wrażliwy na wszelkie przeszkody steryczne. Oznacza to, że będzie on podążał za mniej sterycznie utrudnionymi i bardziej dostępnymi enolizowalnymi hydrogenami.
Mniej stabilny termodynamicznie enolan, jak w reakcji z LDA, nazywamy enolanem kinetycznym. W tym miejscu istotna staje się również kolejność dodawania reagentów. Aby otrzymać kinetyczny enolan, powinieneś zawsze dodawać karbonyl do zasady, a nie odwrotnie! Niektórzy instruktorzy są w tym względzie wybredni, więc miej to na uwadze.
Enolany termodynamiczne vs kinetyczne
Do tej pory wspomniałem o enolanach termodynamicznych i kinetycznych kilka razy, więc myślę, że dobrym pomysłem będzie omówienie ich nieco bardziej szczegółowo.
Co dokładnie liczy się dla stabilności termodynamicznej enolanu?
Główni uczestnicy rezonansu enolanowego mają ujemny ładunek na atomie tlenu i podwójne wiązanie C=C.
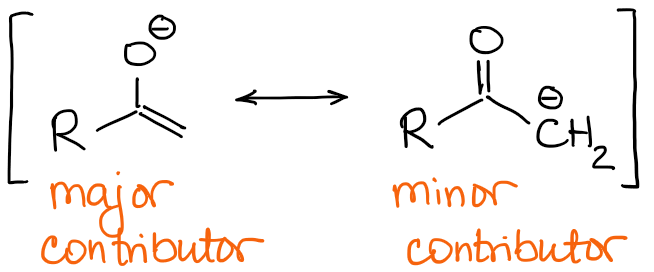
Więc, natura podwójnego wiązania będzie główną różnicą pomiędzy enolanami. Jeśli spojrzymy z powrotem na przykład z 2-metylobutanonem z góry, możemy zobaczyć, że dwa możliwe enolaty mają jakościowo różne wiązania podwójne:

Zawsze zwracaj uwagę na liczbę podstawników na twoim podwójnym wiązaniu. Im więcej podstawników masz na podwójnym wiązaniu, tym bardziej jest ono stabilne. Tak więc, termodynamiczny enolan zawsze będzie miał najbardziej ruchliwe wiązanie podwójne.
Kinetyczny enolan jest tym, który tworzy się szybciej. Pomyśl o reakcji z LDA. LDA jest bardzo silną nie równowagową zasadą. Jak tylko wyrwie proton, nie odda go z powrotem. Jest to również bardzo nieporęczna zasada i nie może złapać wodoru ze środka cząsteczki. Więc pójdzie za tym, co jest bardziej sterycznie dostępne. Tak więc, baza taka jak LDA wyrywa proton szybko, z mniej sterycznie utrudnionego miejsca i nie oddaje go lub pozwala na równowagę dając mniej stabilny enolat.
Dlaczego ważne jest dodanie karbonylu do bazy, aby uzyskać kinetyczny enolan?
Jeśli chcesz uzyskać kinetyczny enolan, twoja baza musi być zawsze w nadmiarze. Enolany są same w sobie zasadowe! Tak więc, jeśli masz karbonyl w nadmiarze, wtedy enolan może szybko ustanowić z nim równowagę.
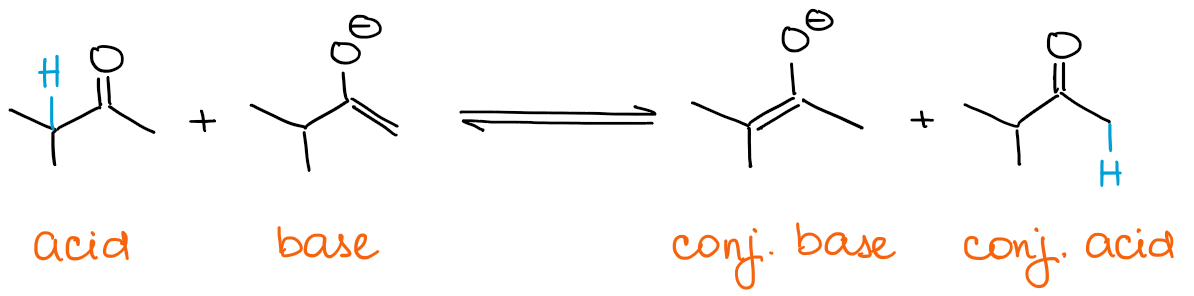
Każda równowaga zawsze będzie faworyzować bardziej stabilne termodynamicznie gatunki. Oznacza to, że zawsze otrzymasz termodynamiczny enolan, jeśli masz nadmiar karbonylu, a nie zasady.
Pamiętaj więc, że:
Słabe i małe silne zasady = termodynamiczny enolan
Bardzo silne zasady = kinetyczny enolan
Użycie tej prostej zasady kciuka pomoże Ci w określeniu, jaki enolan będziesz miał lub musisz wytworzyć w swojej reakcji.
Acid-Catalyzed Enolization
Na samym początku tego wpisu, wspomniałem, że enolizacja jest również możliwa w warunkach kwasowych. Ponieważ aldehydy i ketony nie są szczególnie zasadowe, chcesz użyć bardzo silnego kwasu do katalizowania tego procesu. Zazwyczaj jako katalizatory stosujemy kwasy siarkowy lub tosylowy.
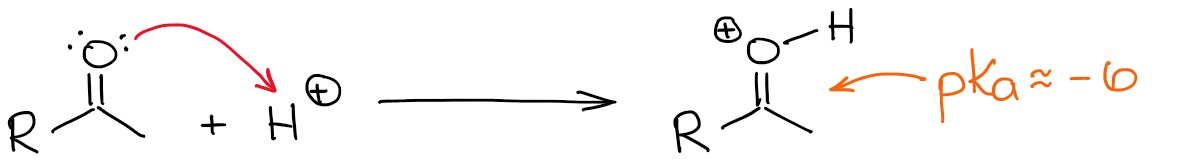
Najbardziej kwaśnym wodorem w protonowanym karbonylu jest oczywiście ten na tlenie. Jednakże, uczynienie wiązania C=O bardziej spolaryzowanym poprzez dodanie do niego protonu, sprawia, że pozycja α jest również bardziej kwaśna. Tak więc teraz jest nieco łatwiej zdeprotonować pozycję α i stworzyć enol.
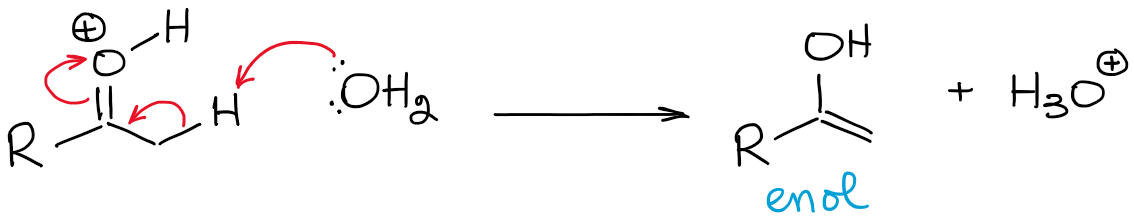
Ta równowaga jest ogromnie niekorzystna i faworyzuje ogólnie karbonyl. Tak więc, nigdy nie będziesz miał wysokiego stężenia enolu w kwaśnych warunkach, chyba że istnieje jakiś rodzaj efektu stabilizacji, czyniąc enol korzystnym (rzadko).
Pomimo, że wszystkie możliwe produkty enolowe mogą być produkowane, ta reakcja zawsze będzie sprzyjać tworzeniu się termodynamicznego enolu.
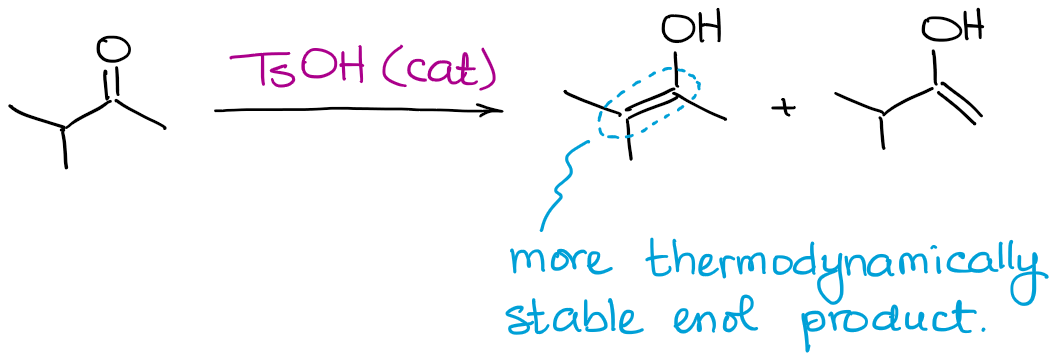
Tak jak w przypadku enolanów, termodynamiczny enol to taki, który ma więcej podstawników na podwójnym wiązaniu.
Jakie czynniki wpływają na enolizację katalizowaną kwasem?
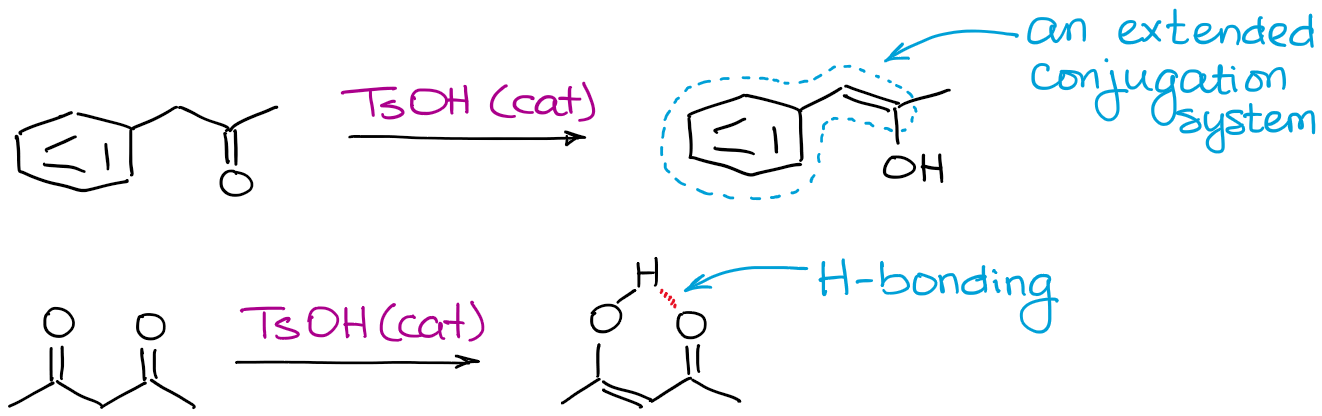
Wszystko, co może uczynić enol bardziej stabilnym, pomoże w osiągnięciu równowagi. Najczęstszymi czynnikami są wiązanie wodorowe i rozszerzona koniugacja.
Po co zawracać sobie głowę enolizacją katalizowaną kwasem, jeśli jest ona katalizowana kwasem?katalizowaną kwasem enolizacją, skoro jest z nią tyle problemów?
Twój związek może być wrażliwy na zasady. Ponadto, może być łatwiej połączyć wiele etapów, gdy zachodzą one w tych samych warunkach. Często łączymy enolizację katalizowaną kwasem z innymi etapami reakcji, które również zachodzą w kwaśnych warunkach.
Musisz jednak pamiętać, że grupy odbierające elektrony w pobliżu karbonylu sprawią, że będzie on jeszcze mniej zasadowy niż już jest. Tak więc, jeśli masz, powiedzmy, halogen w pozycji α, będzie naprawdę trudno wymusić utworzenie enolu.

Zawsze sprawdzaj czy nie ma EWG w pozycji α-zanim założysz tworzenie enolu! Wszelkie EWG, które nie oferują stabilizacji rezonansowej do wiązania podwójnego będzie znacząco niekorzystne dla procesu enolizacji.
Czego się spodziewać na egzaminie?
Profesorzy rzadko zadają pytania ukierunkowane konkretnie na tworzenie enoli lub enolanów bezpośrednio. Pytania enolizacji są zawsze będzie przebrany za coś innego. Pytania enolizacyjne są zazwyczaj sformułowane w następujący sposób:
- Znajdź najbardziej kwaśny wodór w następującej cząsteczce… lub
- Narysuj produkt… (reakcja będzie miała enol lub enolan jako pośrednie)
Oczywiście, mogą zadać bezpośrednie pytanie. Jednak z mojego doświadczenia wynika, że tautomeryzacja keto-enolowa i enolizacje są zazwyczaj podstawowym pojęciem, które napędza pewne pytanie.