Białko miesiąca
listopad 2006
Więcej o PROTEINIE MIESIĄCA |
|
INNE PROTEINY INTEREST |
|
Molekuła miesiąca: Fibryna |
|
ExPASy Protein Spotlight |
Krzepnięcie krwi, lub koagulacja, jest szybką odpowiedzią na uszkodzenie tkanki, gdzieexposure of tissue factor containing cellsto the bloodstream through damage to vessel walls initiates a rapid cascadesystem. Ta kaskada enzymatyczna wykorzystuje serię enzymów do pracy w szybkim tempie, aby wzmocnić małą odpowiedź w dużą w miejscu uszkodzenia (patrz rysunek 1). Po aktywacji, czynnik tkankowy (TF) wiąże się i aktywuje czynnik VII (FVII), inicjując kaskadę. TF/FVII ulega aktywacji poprzez autokleksję do TF/FVIIa, który wraz z kofaktoremFVIIIa przekształca FIX w FIXa; FXa może następnie przekształcić FX w FXa, który wraz z kofaktorem FVa przekształca FII (protrombinę) w FIIa (trombinę); wreszcie FII przekształca fibrynogen w fibrynę, prowadząc do odkładania się fibryny i aktywacji płytek krwi do tworzenia skrzepów. Aktywacja FXIII do FXIIIa może ustabilizować te skrzepy krwi poprzez ich usieciowanie.
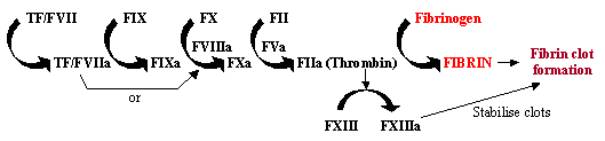
Rysunek 1. Blood Coagulation Cascade
Fibrynogen, Finishing the Coagulation Cascade
Fibrynogen został po raz pierwszy wyizolowany z osocza koni przez Hammarstena w 1876 r., chociaż istnienie nieaktywnego prekursora fibryny zostało zaproponowane już w 1859 r. przez Deni deCommercy’ego. Fibrynogen może przechodzić wyraźną transformację od rozpuszczalnych monomerów (fibrogen) do nierozpuszczalnego polimeru (spolimeryzowana fibryna).
Fibrynogen jest plazmaglikoproteiną syntetyzowaną w wątrobie, która jest niezbędna dla hemostazy (zatrzymanie utraty krwi z uszkodzonych tkanek), gojenia się ran, fibrynolizy, zapalenia, angiogenezy, interakcji komórek i macierzy oraz neoplazji. Procesy te obejmują konwersję fibrynogenu do fibryny, a często także interakcję fibryny (ogenu) z różnymi białkami i komórkami. Ludzie zwykle mają około 2,5 g fibrynogenu na litr krwi, jednak stężenie fibrogenów może wzrosnąć nawet o 200-400% w czasie stresu fizjologicznego (głównie z powodu działania interleukiny-6 pochodzącej z makrofagów).
Fibrynogen jest dużą, złożoną glikoproteiną składającą się z trzech par polipeptydów: dwóch Aa, dwóch Bb i dwóch g. Polipeptydy te są połączone ze sobą 29 wiązaniami disiarczkowymi, z których niektóre przedstawiono na rycinie 2 poniżej. Polipeptydy są zorientowane tak, że wszystkie sześć N-końcowych końców spotyka się, tworząc centralną domenę E. Dwa regiony cewek spiralnych alfa helikali rozciągają się po obu stronach domeny E, każdy składający się z jednego Aa, jednego Bb i jednego gpolipeptydu. Każdy region cewki kończy się w globularnej domenie D, składającej się z C-końcowych końców Bb i g, jak również części Aa. C-końcowy koniec Aa następnie wystaje z każdej domeny D jako długa nić; te wypukłości Aa mogą oddziaływać ze sobą i z domeną E podczas sieciowania skrzepu fibryny. Obie domeny E i D zawierają ważne miejsca wiążące dla konwersji fibrynogenu do fibryny, dla montażu fibryny i sieciowania oraz dla agregacji płytek krwi. Związane jony wapnia są ważne dla utrzymania struktury fibrynogenu.
N-terminalne końce polipeptydów Aa i Bb są rozszczepiane przez trombinę w celu przekształcenia rozpuszczalnego fibrynogenu w fibrynę tworzącą żel. Po odszczepieniu od fibrynogenu, N-końcowe końce znane są jako fibrynopeptyd A (od Aapolipeptydu) i fibrynopeptyd B (od Bbpolipeptydu).
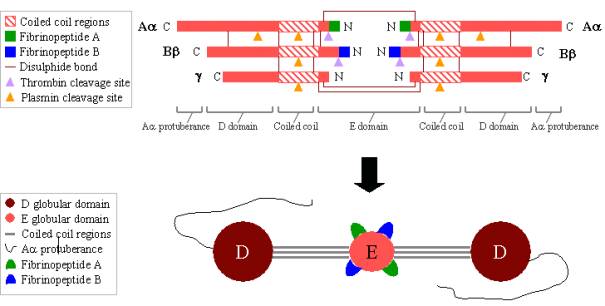
Rysunek 2. Fibrynogen:
TOP – organizacja polipeptydowa fibrynogenu.
BOTTOM – organizacja domenowa fibrynogenu.
Tworzenie skrzepu krwi
Aby utworzyć skrzep krwi, fibrynogen musi być najpierw rozszczepiony przez trombinę w celu usunięcia fibrynopeptydów. Usunięcie fibrynopeptydów A i B z N-końcowych końców Aa i Bb odsłania „gałki” w domenie E, które mogą oddziaływać z „dziurami” zawsze obecnymi w domenach D. Cząsteczki fibryny mogą łączyć się z cząsteczkami fibryny. Cząsteczki fibryny mogą łączyć się ze sobą poprzez interakcję domeny E na jednej cząsteczce fibryny z domenami D na czterech innych cząsteczkach fibryny, polimeryzując w ten sposób w celu utworzenia spłaszczonych oligomerów, które przekształcają się w protofibryle. W miarę jak oligomery fibryny agregują się, te protofibryle nadal wydłużają się, tworząc długie włókna, które mogą owijać się wokół siebie, tworząc wieloniciowe, grube wiązki, i które mogą rozgałęziać się w trójwymiarową sieć splątanych włókien, skrzep fibrynowy. Skrzep fibrynowy jest następnie stabilizowany przez czynnik XIIIa, transglutaminazę, gdzie forma zymogenna czynnika XIII jest przekształcana w aktywny czynnik XIIIa poprzez działanie trombiny (patrz Rycina 1). Czynnik XIII łączy reszty glutaminowe w jednej cząsteczce fibryny z resztami lizyny w innej cząsteczce fibryny, tworząc silne wiązania izopeptydowe. To wiązanie krzyżowe występuje pomiędzy C-końcowymi końcami (wypukłościami Aa) polipeptydów Aa, jak również (wolniej) w innych miejscach, takich jak pomiędzy C-końcowymi końcami łańcuchów g. Te wiązania krzyżowe pomagają wzmocnić fibrynę. Te wiązania krzyżowe pomagają wzmocnić skrzep fibryny, czyniąc go bardziej odpornym na uszkodzenia fizyczne i chemiczne.
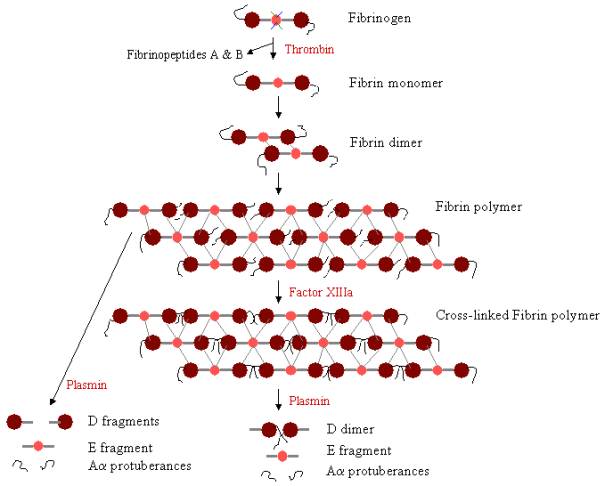
Rysunek 3. Polimeryzacja i liza fibryny: Ścieżka polimeryzacji i rozpadu fibryny. Gałki na domenie E wiążą się z otworami na maksymalnie czterech domenach D (szare linie), tworząc długą, włóknistą sieć. Skrzep jest następnie stabilizowany przez wiązania krzyżowe. Skrzep może być degradowany, dając różne produkty degradacji, jeśli został usieciowany.
.