20 sierpnia 2018
High Flow Nasal Cannula (HFNC) – Part 1: How It Works
 Używanie ogrzewanej i nawilżanej kaniuli nosowej o wysokim przepływie (HFNC) staje się coraz bardziej popularne w leczeniu pacjentów z ostrą niewydolnością oddechową we wszystkich grupach wiekowych. Po raz pierwszy zacząłem jej używać jako kolega z pediatrycznej intensywnej terapii, ale miałem niewielką wiedzę na temat tego, jak to właściwie działa. Po kilku latach stosowania jej z powodzeniem u dzieci, głównie z ciężkim zapaleniem oskrzeli, zauważyłem, że zaczęliśmy ją stosować również na oddziale intensywnej terapii dla dorosłych. Wydaje się, że w ciągu ostatnich kilku lat pojawiło się wiele badań na temat mechanizmów działania leku oraz jego zastosowania w różnych schorzeniach. W tej części podsumujemy jak to działa, a w części 2 omówimy główne wskazania do jej stosowania u dorosłych i dzieci.
Używanie ogrzewanej i nawilżanej kaniuli nosowej o wysokim przepływie (HFNC) staje się coraz bardziej popularne w leczeniu pacjentów z ostrą niewydolnością oddechową we wszystkich grupach wiekowych. Po raz pierwszy zacząłem jej używać jako kolega z pediatrycznej intensywnej terapii, ale miałem niewielką wiedzę na temat tego, jak to właściwie działa. Po kilku latach stosowania jej z powodzeniem u dzieci, głównie z ciężkim zapaleniem oskrzeli, zauważyłem, że zaczęliśmy ją stosować również na oddziale intensywnej terapii dla dorosłych. Wydaje się, że w ciągu ostatnich kilku lat pojawiło się wiele badań na temat mechanizmów działania leku oraz jego zastosowania w różnych schorzeniach. W tej części podsumujemy jak to działa, a w części 2 omówimy główne wskazania do jej stosowania u dorosłych i dzieci.
Ciepła i nawilżana kaniula nosowa o wysokim przepływie lub jak większość nazywa ją Hi Flow Nasal Cannula (HFNC), nie jest tylko standardową kaniulą nosową o bardzo wysokim przepływie. W rzeczywistości pobiera ona gaz i może go podgrzać do temperatury 37 o C przy wilgotności względnej 100% i może dostarczyć 0,21 – 1,00% fi02 przy przepływie do 60 litrów/min. Przepływ i fi02 mogą być niezależnie miareczkowane w oparciu o wymagania pacjenta dotyczące przepływu i fi02.

Istnieją 2 główne firmy, które produkują te urządzenia: Vapotherm, który posiada urządzenie, które może dostarczyć przepływy do 50 litrów/min oraz Fisher Paykall, który oferuje zarówno Optiflow, jak i urządzenia AIRVO 2, które mogą dostarczyć przepływy do 60 litrów/min.
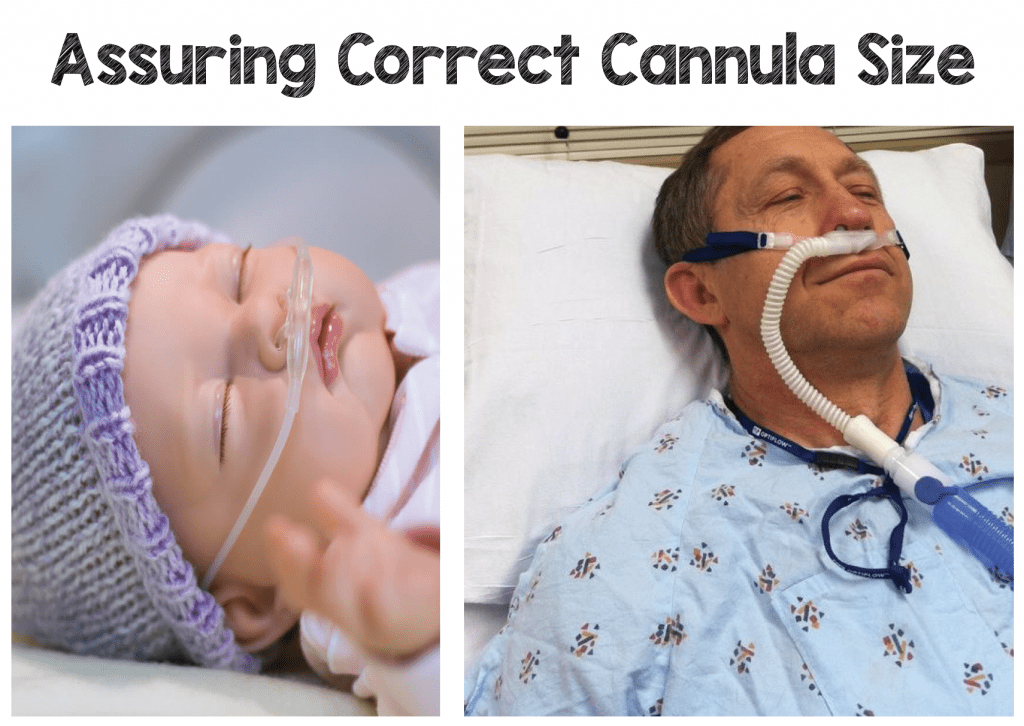
 Każda firma oferuje mniejsze rozmiary kaniul dla wcześniaków, jak również dzieci w różnym wieku do kaniul dla dorosłych. Każda kaniula powinna ściśle przylegać do otworu nosowego pacjenta i zapobiegać porywaniu powietrza wokół kaniuli, co może mieć miejsce w przypadku standardowych kaniul nosowych. Każdy producent posiada również maksymalne natężenie przepływu dla każdego rozmiaru kaniuli odpowiadające rozmiarowi i wiekowi pacjenta.
Każda firma oferuje mniejsze rozmiary kaniul dla wcześniaków, jak również dzieci w różnym wieku do kaniul dla dorosłych. Każda kaniula powinna ściśle przylegać do otworu nosowego pacjenta i zapobiegać porywaniu powietrza wokół kaniuli, co może mieć miejsce w przypadku standardowych kaniul nosowych. Każdy producent posiada również maksymalne natężenie przepływu dla każdego rozmiaru kaniuli odpowiadające rozmiarowi i wiekowi pacjenta.
Jak to działa:
Podgrzany & Nawilżony:
Podgrzany i nawilżony tlen ma wiele korzyści w porównaniu do standardowej terapii tlenowej. Standardowa terapia tlenowa dostarczana przez kaniulę nosową lub inne urządzenie, takie jak respirator, jest zimna (nie ogrzewana) i sucha (nie nawilżana). Może to prowadzić do zapalenia dróg oddechowych, co może zwiększyć opór dróg oddechowych i upośledzić funkcję rzęsek śluzowych, co może prowadzić do zmniejszenia klirensu wydzieliny (1). Ponadto, znaczna ilość kalorii może być również zużyta u osób, aby zarówno ogrzać jak i nawilżyć gaz podczas normalnego oddychania (2).
HFNC może ogrzać (do 37oC) i nawilżyć gaz, co może zmniejszyć stan zapalny dróg oddechowych, utrzymać funkcję rzęsek śluzowych, poprawić klirens śluzu i zmniejszyć wydatek kaloryczny w ostrej niewydolności oddechowej (1-2).
Zapotrzebowanie oddechowe:
Jedną z oczywistych korzyści, ale wartą wspomnienia jest to, że wysoki przepływ może zapewnić bardzo wysoki przepływ gazu. Jest to ważne, ponieważ pacjenci z ostrą niewydolnością oddechową mogą być skrajnie tachypatyczni, a zatem ich szczytowe przepływy wdechowe, które normalnie mogą wynosić 30L/min – 60L/min, mogą osiągać nawet 120 L/min (3). Jeśli więc umieścisz swojego tachypatycznego pacjenta z szybkością PIF 120L/min i objętością minutową >20L/min na masce NRB 15L/min, być może nie pomagasz mu tak bardzo, jak myślisz. Zajmę się tym punktem nieco później w tym przeglądzie, gdy omówimy koncepcję rozcieńczania tlenu.
Funkcjonalna pojemność resztkowa:
Możesz szukać punktu, który mówi, że Hi Flow zapewnia PEEP i nie możesz go znaleźć? Od pewnego czasu toczy się dyskusja na temat tego, ile PEEP może zapewnić urządzenie o wysokim przepływie. Wykazano, że HFNC dostarcza do 1 mm Hg PEEP na każde 10L/min przepływu przy oddychaniu przez zamknięte usta. (4-5)
Nie jestem pewien, czy wierzę, że jest to prawdą w przypadku wszystkich pacjentów, a to dlatego, że istnieje wiele czynników, które mogą wpłynąć na to, ile PEEP może być faktycznie dostarczone pacjentowi. Czynniki takie jak rozmiar pacjenta (otyły, dorosły, dziecko), natężenie przepływu dostarczanego litra (L/Min) i oddychanie z otwartymi ustami versus oddychanie z zamkniętymi ustami (ciśnienie może uciec, gdy usta pacjenta są otwarte) mogą wpływać na ilość dostarczanego PEEP (4)
Dyskusja może trwać, ale wydaje się, że HFNC może zwiększyć funkcjonalną objętość resztkową pacjenta (FRC) lub objętość płuc na końcu wydechu, co zwykle poprawia PEEP. Badanie przeprowadzone przez Riera J. et al wykazało, że stosowanie HFNC zwiększyło końcowo-wydechową impendencję płuc (EELI), co sugeruje, że nastąpiła poprawa FRC (6). Wykorzystali oni Tomografię Impedancji Elektrycznej (EIT), nieinwazyjną metodę obrazowania w czasie rzeczywistym, która zapewnia przekrojowy obraz wentylacji płuc, aby wykazać zwiększoną końcowo-wydechową impendencję płuc (EELI).
Wygląda również na to, że stosowanie HFNC może zmniejszyć obciążenie wstępne poprzez zwiększenie ciśnienia wewnątrz klatki piersiowej, co jest kolejną cechą powszechnie przypisywaną PEEP. Roca i wsp. wykazali w sekwencyjnym badaniu interwałowym u 10 pacjentów (z niewydolnością serca NYHA III, ale nie w ostrym zaostrzeniu CHF), że zastosowanie Hi Flow spowodowało wdechowe zapadnięcie się żyły głównej dolnej (IVC) w stosunku do wartości wyjściowych mierzonych echokardiogramem (7).
Hi flow wydaje się powodować rekrutację pęcherzyków płucnych i zwiększenie FRC, a także wzrost ciśnienia wewnątrz klatki piersiowej, prawdopodobnie w wyniku dodania PEEP, jednak nie jest pewne, czy za te wyniki nie odpowiada inny mechanizm.
Lżejsze:
Pacjenci często wolą stosowanie HFNC niż nieinwazyjnej wentylacji dodatnim ciśnieniem (CPAP lub BPAP), ponieważ ciasno przylegająca maska może być niewygodna dla niektórych pacjentów. Pacjenci mogą nawet woleć ją od standardowej wentylacji ciśnieniowej, ponieważ ogrzane, nawilżone gazy nie wysuszają błony śluzowej, jak w przypadku standardowej tlenoterapii (5). Może to prowadzić do większej zgodności z HFNC i być może poprawy utlenowania i pracy oddechowej pacjenta.
Rozcieńczenie O2:
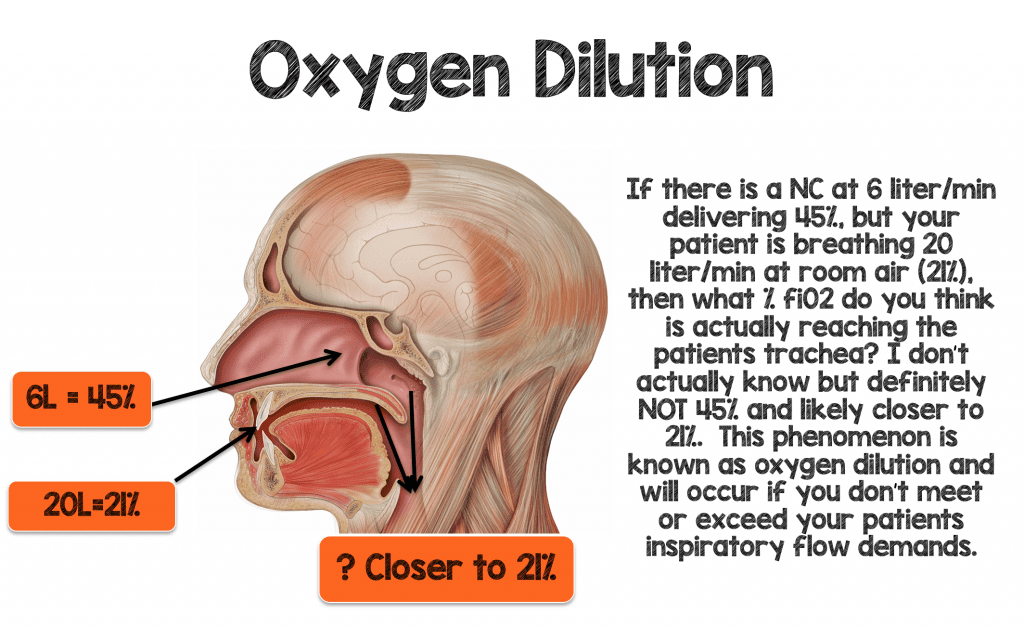
Nauczono mnie na mojej rotacji na OIT jako stażysta, że każdy 1 litr kaniuli nosowej dostarczy ~4% fiO2 powyżej powietrza w pomieszczeniu (21%). Zatem 1 litr/min przez NC powinien dostarczyć ~25% fi02, a 2 litry/min powinny dostarczyć 29% fiO2 (patrz Tabela 1 poniżej). Przez lata wierzyłem, że ta „reguła 1:4” jest prawdziwa, ale zobaczmy, czy ma ona sens w przypadku pacjenta w ostrej niewydolności oddechowej

Obraz 70-kilogramowego mężczyzny oddychającego z prędkością 30-40 uderzeń na minutę z prawidłową objętością oddechową (~500 mL), u którego rozwija się hipoksemia. Wentylacja minutowa tego pacjenta wynosiłaby 15-20 litrów/minutę. Decydujesz się na włączenie 6 litrów/min NC, co teoretycznie powinno zapewnić fiO2 ~ 45% (6L x 4% = 24 + powietrze w pomieszczeniu (21%) = 45%), jeśli „reguła 1:4” jest prawdziwa. Jeśli ten pacjent oddycha 15-20L przez usta i przez otwór nosowy (wokół kaniuli nosowej) przy 21%, to czy wierzysz, że ten pacjent rzeczywiście otrzyma 45% fiO2 dostarczonego do tchawicy?
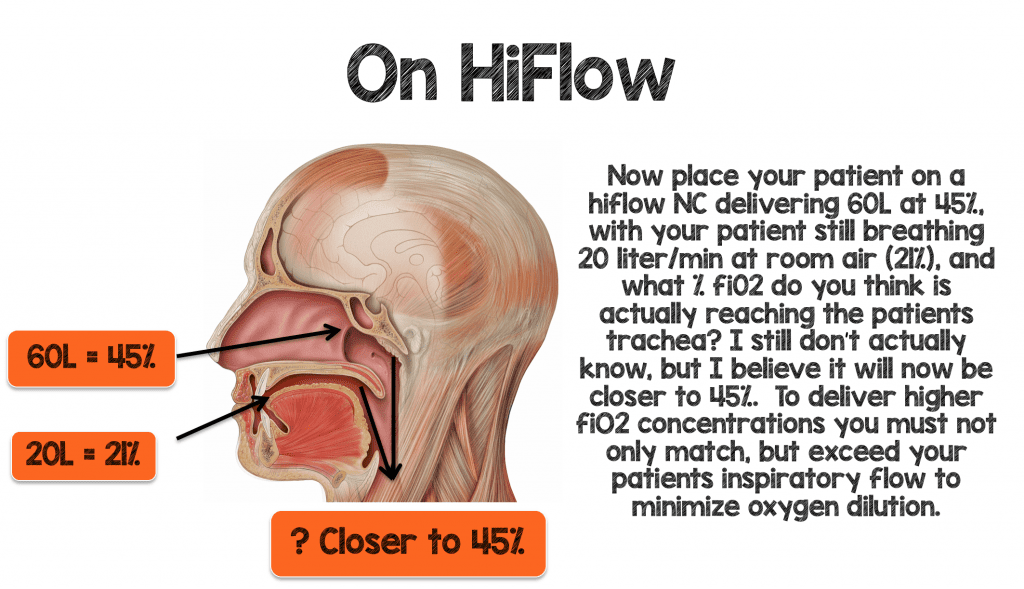
Aby skutecznie dostarczać pacjentowi większe ilości fiO2, musisz nie tylko dopasować się, ale przewyższyć wymagania wentylacji minutowej i wdechowej pacjenta, aby zminimalizować rozcieńczenie tlenu.
Odmywanie przestrzeni martwej:
Zazwyczaj wydychamy jedną trzecią poprzednio wydychanej objętości oddechowej i zamiast oddychać 21% (powietrze w pomieszczeniu) i nieistotną ilością dwutlenku węgla, możemy wydychać więcej jak 15-16% tlenu i 5-6% dwutlenku węgla. Dzieje się tak dlatego, że poprzednio wydychany oddech (ubogi w tlen i z pewną ilością dwutlenku węgla) nie jest w pełni wydychany i pozostaje w górnych drogach oddechowych. Kiedy pacjent bierze następny oddech z gazu atmosferycznego, nie cały ten gaz dostaje się do pęcherzyków płucnych. W rzeczywistości jest to mieszanina nowego gazu atmosferycznego (21% 02, znikoma ilość CO2) i wcześniej wydychanego gazu (<21% tlenu i trochę CO2). U pacjentów z ostrą niewydolnością oddechową, procent gazu, który wydychamy ponownie staje się większy, a w rezultacie możemy wydychać większe ilości dwutlenku węgla, ponieważ czerpiemy nasze oddechy z mieszanego zbiornika z naszych górnych dróg oddechowych. Innym sposobem na powiedzenie tego jest to, że nasza przestrzeń martwa zwiększa się w przypadku ostrej niewydolności oddechowej.
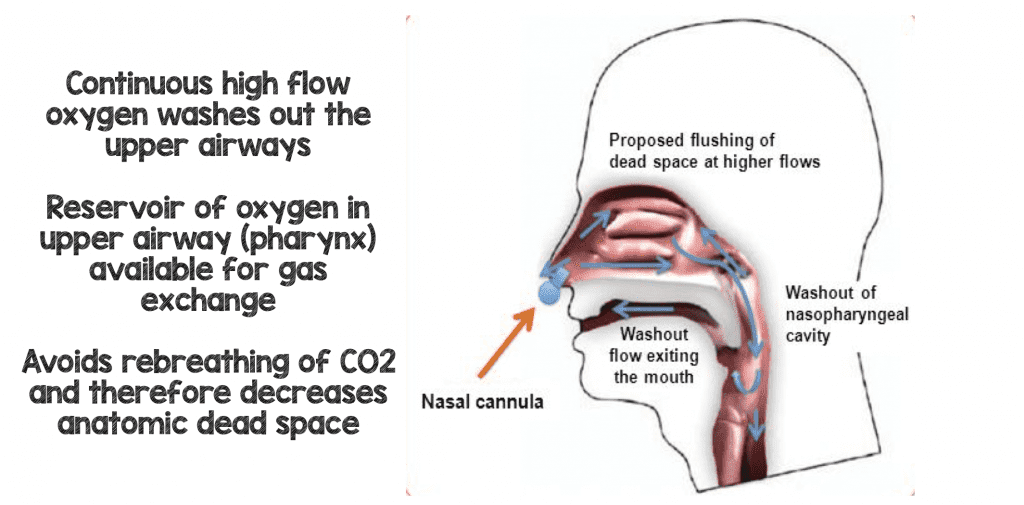
Jedną z głównych korzyści HFNC (niektórzy twierdzą, że jest to właściwie główna korzyść) jest to, że zapewnia ciągły przepływ świeżego gazu przy wysokich prędkościach przepływu, zastępując lub wypłukując gardłową przestrzeń martwą pacjenta (stary gaz o niskiej zawartości tlenu i wysokiej zawartości CO2). Każdy oddech, który pacjent teraz ponownie wydycha, jest wypłukiwany z dwutlenku węgla i zastępowany gazem bogatym w tlen, co poprawia efektywność oddychania (8).

Guest Post Co-Written By

Thomas Lettich, D.O.
Internal Medicine/Pediatrics Resident Physician
Geisinger Medical Center
Danville, Pennsylvania
- Chidekel, A et al. The Effects of Gas Humidification with High-Flow Nasal Cannula on Cultured Human Airway Epithelial Cells. Pulmonary Medicine 2012. PMID: 22988501
- Dysart, K et al. Research in High Flow Therapy: Mechanisms of Action. Respiratory Medicine 2009. PMID: 19467849
- Katz, JA et al. Inspiratory Work with and Without Continuous Positive Airway Pressure in Patients with Acute Respiratory Failure. Anesthesiology 1985. PMID: 3904528
- Parke R et al. Pressures Delivered by Nasal High Flow Oxygen During all Phases of the Respiratory Cycle. Respiratory Care 2013. PMID: 23513246
- Frat JP et al. High-Flow Nasal Oxygen Therapy and Noninvasive Ventilation in the Management of Acute Hypoxemic Respiratory Failure. Annals of Translational Medicine 2017). PMID: 28828372
- Riera J et al. Effect of High-Flow Nasal Cannula and Body Position on End-Expiratory Lung Volume: A Cohort Study Using Electrical Impedance Tomography. Respiratory Medicine 2013. PMID: 23050520
- Roca O et al. Patients with New York Heart Association Class III Heart Failure may Benefit with High Flow Nasal Cannula Supportive Therapy: High Flow Nasal Cannula in Heart Failure. Journal Crit Care 2013. PMID: 23602035
- Möller W et al. Nasal High Flow Clears Anatomical Dead Space in Upper Airway Models. Journal of Applied Physiology 2015). PMID: 25882385
Support the Show by Paying & Claiming 0.5hrs of CME/CEH by Clicking on the Logo Below

Post Peer Reviewed By: Salim R. Rezaie, MD (Twitter: @srrezaie)
- Bio
- Najnowsze posty
Frank Lodeserto MD
Najnowsze posty Frank Lodeserto MD (zobacz wszystkie)
- The RELAx Trial: What is the Optimal PEEP in Patients Without ARDS? – Luty 1, 2021
- COVID-19 Update: The COVID-19 Pfizer Vaccine – Grudzień 15, 2020
- Hemophagocytic Lymphohistiocytosis (HLH): A Zebra Diagnosis We Should All Know – July 30, 2020