N-bromobursztynoimid (NBS) jest czynnikiem bromotwórczym i utleniającym, który jest stosowany jako źródło bromu w reakcjach rodnikowych (na przykład: bromowanie allilowe) i różnych addycjach elektrofilowych. Bromowanie NBS substratów takich jak alkohole i aminy, po którym następuje eliminacja HBr w obecności zasady, prowadzi do produktów utleniania netto, w które nie został wbudowany brom.
Reakcje nazwane
Reakcja Wohla-Zieglera

An efficient and user- friendly procedure has beenendeveloped for the effective and user-Opracowano wydajną i przyjazną dla użytkownika procedurę oksydacyjnej deprotekcji eterów tetrahydropiranylowych (THP) za pomocą N-bromobursztynoimidu (NBS) z zastosowaniem β-cyklodekstryny (β-CD) w wodzie. Szereg eterów tetrahydropiranylowych poddano oksydacyjnej deprotekcji w temperaturze pokojowej z imponującą wydajnością.
M. Narender, M. S. Reddy, K. R. Rao, Synthesis, 2004,1741-1743.

N-alkoksyamidy w dogodny sposób umożliwiają otrzymanie odpowiednich estrów karboksylowych w obecności NBS w toluenie poprzez homosprzęganie oksydacyjne i następujące po nim termiczne odazotowanie. Nawet substraty zawierające nieporęczne lub długołańcuchowe podstawniki dawały produkty z dobrą wydajnością w tym wygodnym i ekonomicznym podejściu do bezpośredniej transformacji ugrupowania alkoksyamidowego w grupę funkcyjną estru karboksylowego.
N. Zhang, R. Yang, D. Zhang-Negrerie, Y. Du, K. Zhao, J. Org. Chem., 2013,78, 8705-8711.

Bezpośrednia transformacja etylenów do pierwszorzędowych amidów aromatycznych za pomocą N-Bromobursztynoimidu i I2-wodnego NH3
S. Shimokawa, Y. Kawagoe, K. Moriyama, H. Togo, Org. Lett, 2016, 18, 784-787.

W wydajnej, wolnej od metali i zasad, chemoselektywnej reakcji kwasów boronowych z rodnikami cyjanamidylowymi/arylocyjanamidylowymi otrzymuje się pierwszorzędowe aminy arylowe, heteroarylowe i alkilowe w temperaturze otoczenia w ciągu 1 h. W reakcji pośredniczą PIFA i NBS.
N. Chatterjee, M. Arfeen, P. V. Bharatam, A. Goswami, J. Org. Chem., 2016,81, 5120-5127.
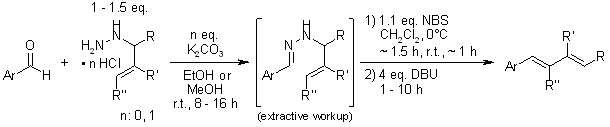
Stereoselektywna synteza dienów z aldehydów i pochodnych N-allilhydrazyny oferuje wysoki poziom (E)-stereoselektywności dla różnych substratów. Dodanie dienofila do mieszaniny reakcyjnej pozwala na przeprowadzenie sekwencji syntezy-cykloaddycji dienów w jednej kolbie.
D. A. Mundal, K. E. Lutz, R. J. Thomson, Org. Lett., 2009,11, 465-468.

Wydajną, jednopotową transformację związków β-hydroksykarbonylowych do α-bromowanych związków 1,3-dikarbonylowych uzyskano za pomocą MoO2Cl2 w obecności N-bromobursztynoimidu. Wszystkie reakcje prowadzono w łagodnych warunkach z dobrymi wydajnościami. W pozycjach benzylowych i allilowych nie zachodzi bromowanie.
K. Jeyakumar, D. K. Chand, Synthesis, 2009, 306-310.

K. Jeyakumar, D. K. Chand, Synthesis, 2009, 306-310.

Selektywne oksyhalogenowanie alkinów uzyskano w wodzie w bardzo łagodnych warunkach w obecności niedrogich odczynników halogenujących, takich jak N-bromobursztynoimid i N-chlorobursztynoimid, oraz FI-750-M jako amfifila. Nie wykryto halogenowania przy pierścieniach aromatycznych. Medium reakcyjne i katalizator mogą być poddane recyklingowi.
L. Finck, J. Brals, B. Pavuluri, F. Gallou, S. Handa, J. Org. Chem., 2018, 83, 7366-7372.

Katalizowana tlenkiem trifenylofosfiny redukcyjna halogenizacja α,β-nienasyconego ketonu z trichlorosilanem jako odczynnikiem redukującym i N-halosuccinimidem jako elektrofilowym źródłem halogenu umożliwia selektywną syntezę niesymetrycznych α-haloketonów.
Z. Lao, H. Zhang, P. H. Toy, Org. Lett., 2019, 21, 8149-8152.

Niezawodne, proste operacyjnie, katalityczne reakcje α-selektywnego hydroaluminowania przebiegają w obecności wodorku diizobutyloglinu i (Ni(dppp)Cl2), i w przeciwieństwie do niekatalizowanych transformacji generują niewiele lub nie generują produktów ubocznych w postaci alkiloglinu. Otrzymane halogenki α-winylowe i boroniany mogą być syntezowane poprzez bezpośrednie traktowanie odpowiednimi elektrofilami.
F. Gao, A. H. Hoveyda, J. Am. Chem. Soc., 2010, 132, 10961-10963.

Uwięzienie diazonu w sposób międzycząsteczkowy przez dwa niezależne jony w tandemie w centrum karbenu powoduje zainstalowanie elektrofilu i nukleofila na tym samym węglu. Ta wolna od metali koncepcja umożliwia regioselektywną syntezę różnych halogenków winylu, sulfonów winylowych i pochodnych alkinowych.
D. P. Ojha, K. R. Prabhu, Org. Lett., 2015,17, 18-21.

Nienasycone związki, takie jak alkeny, alkeny, alleny i metylenocyklopropany (MCPs) mogą być dibromowane w ciągu kilku minut przez NBS i bromek litu w THF w temperaturze pokojowej w dobrych do doskonałych wydajnościach w łagodnych warunkach.
L.-X. Shao, M. Shi, Synlett, 2006, 1269-1271.

L.-X. Shao, M. Shi, Synlett, 2006, 1269-1271.

L.-X. Shao, M. Shi, Synlett, 2006, 1269-1271.

Użycie N-bromobursztynoimidu umożliwia bezmetalową, jednopotencjałową strategię syntezy ważnych farmaceutycznie α-aminoketonów z łatwo dostępnych benzylowych alkoholi drugorzędowych i amin. Reakcja przebiega w trzech kolejnych etapach obejmujących utlenianie alkoholi, α-bromowanie ketonów i nukleofilową substytucję α-bromo ketonów w celu otrzymania α-amino ketonów.
S. Guha, V. Rajeshkumar, S. S. Kotha, G. Sekar, Org. Lett., 2015,17, 406-409.

Połączenie N-bromoimidu i DBU umożliwia reakcje aminowania allilowego alkenów, w których można bezpośrednio instalować zarówno wewnętrzne, jak i zewnętrzne nukleofile azotowe. Podwójna aktywacja NBS lub NBP przez DBU prowadzi do uzyskania większej ilości elektrofilowego bromu i większej ilości nukleofilowych atomów azotu jednocześnie. Protokół ten zapewnia komplementarny dostęp do aminowania allilowego w łagodnych warunkach.
Y. Wei, F. Liang, X. Zhang, Org. Lett., 2013,15, 5186-5189.

Zgłoszono wygodną i wydajną metodę aminobromowania alkilidenecyklopropanów. Przykładem tego jest stereoselektywne otrzymywanie N–p-toluenosulfonamidów przy użyciu p-toluenosulfonamidu i N-bromobursztynoimidu (NBS) jako źródeł azotu i bromu, odpowiednio.
X. Huang, W.-J. Fu, Synthesis, 2006, 1016-1017.

W protokole ciągłego przepływu bromowania związków benzylowych przy użyciu jedynie niewielkiego nadmiaru N-bromobursztynoimidu, reakcje rodnikowe aktywowano za pomocą łatwo dostępnej w gospodarstwie domowym kompaktowej lampy fluorescencyjnej (CFL), stosując prostą konstrukcję reaktora przepływowego opartego na przezroczystych rurkach z fluorowanego polimeru etylenu. Wszystkie reakcje przeprowadzono z użyciem acetonitrylu jako rozpuszczalnika, unikając w ten sposób niebezpiecznych rozpuszczalników chlorowanych, takich jak CCl4.
D. Cantillo, O. de Frutos, J. A. Rincon, C. Mateos, C. O. Kappe, J. Org. Chem., 2014,79, 223-229.

Zasada Lewisa Trip-SMe (Trip = triptycenyl) katalizuje elektrofilowe halogenowanie nieaktywowanych związków aromatycznych przy użyciu N-halosuccinimidów (NXS) w temperaturze otoczenia w obecności AgSBF6 jako źródła anionu niekoordynacyjnego. Układ π funkcji triptycenylowej odgrywa kluczową rolę w zwiększaniu elektrofilowości.
Y. Nishii, M. Ikeda, Y. Hayashi, S. Kawauchi, M. Miura, J. Am. Chem. Soc., 2020, 142, 1621-1629.

Uzyskano wysoce regioselektywne bromowanie aktywowanych związków aromatycznych przy użyciu bromku N-bromobursztynianu w bromku tetrabutyloamoniowym. Predominant-para-selektywne monobromowanie aktywowanych aromatów, przyspieszenie tempa dla mniej reaktywnych substratów na dodanie kwaśnego montmorylonitu K-10 gliny, z lub bez pomocy mikrofalowej, są godne uwagi cechy tego protokołu.
N. C. Ganguly, P. De. S. Dutta, Synthesis, 2005, 1103-1108.

Użycie heksafluoroizopropanolu jako rozpuszczalnika umożliwia łagodne i regioselektywne halogenowanie szerokiego zakresu arenów i heterocykli za pomocą N-halosuccinimidów z dobrą wydajnością. Ponadto, wszechstronność metody została zademonstrowana poprzez rozwój jednopotowych sekwencyjnych reakcji dihalogenowania i halogenowania-Suzuki cross-coupling.
R.-J. Tang, T. Milcent, B. Crousse, J. Org. Chem., 2018, 83, 930-938.

Wysoko para-selektywna halogenacja arenów posiadających elektronodonujące grupy koordynacyjne w obecności soli dimidazolowej rprowadza p-haloareny w dobrych wydajnościach. Zaproponowano prawdopodobny mechanizm reakcji katalitycznej.
J. Chen, X. Xiong, Z. Chen, J. Huang, Synlett, 2015, 26, 2831-2834.

Wysoko dezaktywowane związki aromatyczne zostały gładko zmonobromowane poprzez traktowanie N-bromobursztynoimidem (NBS) w stężonym kwasie siarkowym. Łagodne warunki reakcji i prosta obróbka zapewniają praktyczną i komercyjnie opłacalną drogę do syntezy bromozwiązków dezaktywowanych związków aromatycznych z dobrą wydajnością.
K. Rajesh, M. Somasundaram, R. Saiganesh, K. K. Balasubramanian, J. Org. Chem., 2007,72, 5867-5869.

N-Halosuccinimidy są wydajnie aktywowane w kwasie trifluorometanosulfonowym i BF3-H2O, co pozwala na halogenowanie dezaktywowanych aromatów. BF3-H2O jest bardziej ekonomiczny, łatwy do przygotowania, nieutleniający i oferuje wystarczająco wysoką kwasowość.
G. K. S. Prakash, T. Mathew, D. Hoole, P. M. Esteves, Q. Wang, G. Rasul, G. A. Olah, J. Am. Chem. Soc., 2004,126, 15770-15776.

Kwasy boronowe arylowe i heteroarylowe reagują z N-jodobursztynoimidem i N-bromobursztynoimidem dając odpowiednie jodo- i bromoareny w wydajnościach dobrych do doskonałych. Reakcja jest zazwyczaj wysoce regioselektywna i daje tylko ipso-podstawiony produkt.
C. Thiebes, G. K. Surya Prakash, N. A. Petasis, G. A. Olah, Synlett, 1998, 141-142.

Wysokowydajna, ogólna i praktyczna reakcja orto bromowania i jodowania różnych klas związków aromatycznych zachodzi przy użyciu Rh(III)-katalizowanej metodologii aktywacji wiązania C-H.
N. Schröder, J. Wencel-Delord, F. Glorius, J. Am. Chem. Soc., 2012, 134, 8298-8301.

Używając cyjanu jako grupy kierującej, katalizowana palladem reakcja orto-halogenowania (I, Br, Cl) dała dobre do doskonałych wydajności. Metoda ta jest kompatybilna z arylonitrylami z grupami oddającymi lub odbierającymi elektrony. Prezentowana metoda została z powodzeniem zastosowana do syntezy prekursorów paucifloralu F i izopaucifloralu F.
B. Du, X. Jiang, P. Sun, J. Org. Chem., 2013,78, 2786-2791.

Wydajny protokół wysoce stereoselektywnej, jednopotencjalnej syntezy (E)-β-arylowych jodków winylowych i (E)-β-arylowych bromków winylowych ze styrenów oparty jest na katalizowanym rutenem sprzęganiu sililowym, po którym następuje reakcja N-halosuccinimide-mediated halodesilylation.
P. Pawluć, G. Hreczycho, J. Szudkowska, M. Kubicki, B. Marciniec, Org. Lett., 2009,11, 3390-3393.

Używając trietyloaminy jako katalizatora w reakcjach Hunsdieckera z N-halosuccinimidami jako źródłem Br+ lub I+, kwasy cynamonowy i propiolowy są przekształcane w odpowiednie α-halostyreny i 1-halo-1-alkeny z dobrą izolowaną wydajnością w ciągu 1-5 min.
J. Prakash, S. Roy, J. Org. Chem., 2002, 67, 7861-7864.

J. Prakash, S. Roy, J. Org. Chem., 2002, 67, 7861-7864.

(E)-β-bromki arylwinylowe były łatwo otrzymywane w krótkim czasie reakcji (1-2 min) poprzez mikrofalowe napromieniowanie odpowiednich kwasów3-arylopropenowych w obecności N-bromobursztynoimidu i akatalitycznej ilości octanu litu.
C. Kuang, Q. Yang, H. Senboku, M. Tokuda, Synthesis, 2005,1319-1325.

Wydajna synteza α-jodo/bromo-α,β-nienasyconych aldehydów/ketonów bezpośrednio z alkoholi propargilowych jest katalizowana kolaboracyjnie przez Ph3PAuNTf2 i MoO2(acac)2, a Ph3PO jako dodatek pomaga tłumić niepożądane tworzenie się enonu/enalu. Godnymi uwagi cechami tej metody są niskie obciążenia katalizatora, łagodne warunki reakcji i przeważnie dobra diastereoselektywność.
L. Ye, L. Zhang, Org. Lett., 2009,11, 3646-3649.

Regio- i stereoselektywne jodowanie, wraz z kilkoma przykładami bromowania, łatwo dostępnych akryloamidów przebiega w łagodnych warunkach poprzez Rh(III)-katalizowany mechanizm C-H-aktywacji/halogenowania. Reakcja ta stanowi rzadki przykład bezpośredniego chlorowcowania pochodnych ubogiego w elektrony kwasu akrylowego w celu otrzymania różnorodnie podstawionych pochodnych kwasu Z-halakrylowego.
N. Kuhl, N. Schröder, F. Glorius, Org. Lett., 2013,15, 3860-3863.

W promowanej przez NBS kaskadowej reakcji addycji alliloksylu – rearanżacji Klaisena – dehydrobrominacji, ponad 20 podstawionych alkilosulfonamidów zostało poddanych reakcji z alkoholami allilowymi w celu wygenerowania (2Z)-2,4-dienamidów z dobrą wydajnością. Obliczenia teoretyczne sugerują, że etapem ograniczającym szybkość reakcji jest rearanżacja sigmatropowa.
R. Ding, Y. Li, C. Tao, B. Cheng, H. Zhai, Org. Lett., 2015,17, 3994-3997.

Szybka i wygodna jednoetapowa procedura pozwala na konwersję α,β-nienasyconych związków karbonylowych do odpowiadających im bromoenonów w temperaturze pokojowej w bardzo łagodnych warunkach z wysoką wydajnością przy użyciu NBS-Et3N – 3 HBr w obecności węglanu potasu w dichlorometanie.
D. Jyothi, S. HariPrasad, Synlett, 2009, 2309-2311.

Łagodną, jednogarnkową cyjanoimidację aldehydów przy użyciu cyjanamidu jako źródła azotu i NBS jako utleniacza uzyskano z wysoką wydajnością bez dodatku katalizatora. Następnie podstawione produkty N-cyjanobenzimidanowe mogą być również poddane reakcji cyklizacji w celu otrzymania pochodnych 1,2,4-triazolu z wysokimi wydajnościami.
P. Yin, W.-B. Ma, Y. Chen, W.-C. Huang, Y. Deng, L. He, Org. Lett., 2009,11, 5482-5485.

Sm(OTf)3 jest efektywnym katalizatorem dla wszechstronnego i wydajnego, promowanego halogenem wysoce regio- i stereoselektywnego alkilowania Friedela-Craftsa (F-C) bogatych elektronowo arenów z alkenami i α,β-nienasyconymi związkami karbonylowymi w obecności NBS lub I2 jako źródeł halogenu.
S. Haira, B. Maji, S. Bar, Org. Lett., 2007,9, 2783-2786.

Nowa katalizowana srebrem wysoce regio- i stereoselektywna reakcja dyfunkcjonalizacji prostych terminalnych alkinów daje w dobrych wydajnościach pochodne octanowe (Z)-β-haloenolu. Otrzymane produkty są uniwersalnymi intermediatami w syntezie organicznej.
Z. Chen, J. Li, H. Jiang, S. Zhu, Y. Li, C. Qi, Org. Lett., 2010,12, 3262-3265.

Nowa procedura aminobromowania olefin daje wikłające pochodne bromoaminowe z wysoką wydajnością przy użyciu katalizatorów Cu, Mn, lub V z toluenosulfonamidem jako źródłem azotu i N-bromobursztynoimidem(NBS) jako źródłem bromu. Doskonałe regio- i stereoselektywność jest pokazany dla różnych substratów olefinowych, jak również metali przejściowychcatalysts.
V. V. Thakur, S. K. Talluri, A. Sudalai, Org. Lett., 2003,5, 861-864.

Przy użyciu niedrogiego FeCl2 jako katalizatora, amidów/sulfonamidów i NBS jako źródeł azotu i bromu, odpowiednio, w łagodnych warunkach, opracowano wygodny i wydajny sposób katalizowanego żelazem aminobromowania alkenów.
Z. Wang, Y. Zhang, H. Fu, Y. Jiang, Y. Zhao, Synlett, 2008, 2667-2668.

W wydajnym, bezkatalizatorowym i bezmetalowym bromoamidowaniu nieaktywowanych olefin, 4-(trifluorometylo)benzenosulfonamid i N-bromobursztynoimid zostały użyte odpowiednio jako źródła azotu i halogenu. Metodologia ta ma zastosowanie zarówno do cyklicznych, jak i alifatycznych olefin.
W. Z. Yu, F. Chen, Y. A. Cheng, Y.-Y. Yeung, J. Org. Chem., 2015,80, 2815-2821.

W obecności N-bromobursztynoimidu jako inicjatora rodnikowego pod wpływem promieniowania mikrofalowego zachodziła wydajna bezkatalizatorowa reakcja rodnikowego sprzęgania krzyżowego pomiędzy aldehydami aromatycznymi a sulfoksyminami, w wyniku której otrzymywano odpowiednie acylowane sulfoksyminy z dobrą wydajnością.
K. K. Rajbongshi, S. Ambala, T. Govender, H. G. Kruger, P. I. Arvidsson, T. Naicker, Synthesis, 2020, 52, 1279-1286.

Nowoczesna elektrofilowa reakcja one-pot olefiny, cyjanimidu, aminy i N-bromobursztynoimidu umożliwia syntezę szeregu pochodnych guanidyny z bardzo dobrymi wydajnościami – w tym prekursora rTRTVI.
L. Zhou, J. Chen, J. Zhou, Y.-Y. Yeung, Org. Lett., 2011,13, 5804-5807.

Stereoselektywne arylowanie i winylowanie alkenów bez użycia katalizatorów metali przejściowych zachodzi poprzez interesującą, promowaną przez NBS rearanżację semipinakolową w łagodnych warunkach i następującą po niej niezwykłą fragmentację Grob z udziałem NaOH.
D.-Y. Yuan, Y.-Q. Tu, C.-A. Fan, J. Org. Chem., 2008,73, 7797-7799.

Nowa kationowa synteza typu one-pot inicjowana Br z wykorzystaniem olefiny, nitrylu, aminy i N-bromobursztynoimidu daje imidazoliny z dobrą wydajnością. Substraty olefinowe i nitryle mogą być elastycznie zmieniane w celu uzyskania szeregu pochodnych imidazoliny.
L. Zhou, J. Zhou, C. K. Tan, J. Chen, Y.-Y. Yeung, Org. Lett., 2011,13, 2448-2451.

Mediowana przez N-bromobursztynian bezpośrednia synteza 2,5-diaryloxazoli wychodzących z N-H ketoazirydyn przebiega poprzez tworzenie in situ N-bromoketoazirydyn, a następnie generowanie ylidów azometinowych.
H. S. Samimi, F. Dadvar, Synthesis, 2015, 47, 1899-1904.

3-Oksazolino-4-karboksylany jako łatwo dostępne syntetyczne intermediaty mogą być utleniane do otrzymania oksazolo-4-karboksylanów. Ponadto, derywatyzacja 3-oksazolino-4-karboksylanów odczynnikami Grignarda umożliwia łatwe otrzymanie pochodnych 4-keto-oksazolu.
K. Murai, Y. Takahara, T. Matsushita, H. Komatsu, H. Fujioka, Org. Lett., 2010,12, 3456-3459.

2-Amino-4-alkilo- i 2-amino-4-arylotiazolo-5-karboksylany oraz ich analogi selenazolowe zsyntetyzowano poprzez α-halogenowanie β-ketoestrów za pomocą N-bromobursztynoimidu, a następnie cyklizację odpowiednio tiomocznikiem lub selenomocznikiem w obecności β-cyklodekstryny w wodzie w temp. 50°C.
M. Narender, M. S. Reddy, V. P. Kumar, B. Srinivas, R. Sridhar, Y. V. D. Nageswar, K. R. Rao, Synthesis, 2007, 3469-3472.
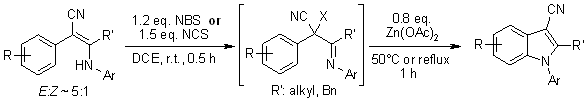
Różne 2-arylo-3-aryloamino-2-alkenonitryle dają N-aryloindolo-3-karbonitryle w sposób jednopotencjalny poprzez NBS- lub NCS-mediowaną halogenację, po której następuje Zn(OAc)2-katalizowana wewnątrzcząsteczkowa cyklizacja. W procesie tym powstają intermediaty w postaci jonów arylonitreniowych, które ulegają elektrofilowemu podstawieniu aromatycznemu dając cyklizowane N-aryloindole.
Q. Yan, J. Luo, D. Zhang-Negrerie, H. Li, X. Qi, K. Zhao, J. Org. Chem., 2011,76, 8690-8697.

Tert-butylosulfotlenki mogą być stosowane jako źródła sulfinylowe w wewnątrzcząsteczkowym sulfinylowaniu sulfonamidów, po którym następuje all-heteroatomowy proces równoważny procesowi Wittiga, w celu otrzymania arylisotiazoli z wysoką wydajnością.
F. Xu, Y. Chen, E. Fan, Z. Sun, Org. Lett., 2016, 18, 2777-2779.

Bezkatalizacyjna halogenowa cyklizacja N-arylowych diazoamidów z N-halosuccinimidami (NXS) dostarcza 3-halooxindole z dobrą wydajnością poprzez mechanizm bezkarbenu w łagodnych i bezkatalizatorowych warunkach. Proponuje się, że transformacja ta przebiega poprzez tworzenie jonów diazoniowych, a następnie wewnątrzcząsteczkową alkilację Friedela-Craftsa.
C. Ma, D. Xing, W. Hu, Org. Lett., 2016, 18, 3134-3137.

Opisano nową metodologię syntezy różnie podstawionych 2-oksazolin i jednej dihydrooksazyny z wykorzystaniem aldehydów, aminoalkoholi i N-bromobursztynoimidu jako utleniacza. Ta jednogarnkowa synteza charakteryzuje się łagodnymi warunkami reakcji, szerokim zakresem, wysoką wydajnością i prostotą przygotowania.
K. Schwekendiek, F. Glorius, Synthesis, 2006, 2996-3002.

Katalizowana złotem cyklizacja intermediatów β-amino-ynonu i proces halodeuracji umożliwia szybką i wydajną jednoetapową syntezę halopirydonów.
K. H. Nguyen, S. Tomasi, M. Le Roch, L. Toupet, J. Renault, P. Uriac, N. Gouault, J. Org. Chem., 2013,78, 7809-7815.

Wszechstronna i wysoce wydajna katalizowana przez Zn(OTf)2 reakcja one-pot alkenów, NBS, nitryli i TMSN3 daje różne 1,5-dysubstytuowane tetrazole zawierające dodatkową funkcjonalność α-bromo podstawnika N1-alkilowego.
S. Hajra, D. Sinha, M. Bhowmick, J. Org. Chem., 2007,72, 1852-1855.

Opisano syntezę one-pot arylowych sulfonów z alkoholi pierwszorzędowych. Alkohole traktowano N-bromobursztynoimidem i trifenylofosfiną, a następnie dodawano arenosulfinian sodu z katalityczną ilością jodku tetrabutyloamoniowego w celu otrzymania arylosulfonów z dobrą lub wysoką wydajnością.
T. Murakami, K. Furusawa, Synthesis,2002, 479-482.

Sulfotlenki posiadające grupę tert-butylową mogą być aktywowane przy użyciu N-bromobursztynoimidu (NBS) w warunkach kwaśnych. Późniejsze traktowanie różnymi nukleofilami azotowymi, węglowymi lub tlenowymi prowadzi do otrzymania szerokiej gamy amidów kwasu sulfinowego, nowych sulfotlenków i estrów kwasu sulfinowego.
J. Wei, Z. Sun, Org. Lett., 2015,17, 5396-5399.

Cyjanek pośredniczy w generacji in situ nukleofilowego jonu sulfinianowego z sulfonów winylowych. Następujące po tym S-alkilowanie in situ prowadzi do otrzymania sulfonów z dużą wydajnością. W obecności N-bromobursztynoimidu, pierwszo- i drugorzędowe aminy ulegały tworzeniu sulfonamidów.
T. Roy, J.-W. Lee, Synlett, 2020, 31, 455-458.

Thiosulfoniany syntetyzowane metodą katalizowanej miedzią dimeryzacji tlenowej służą jako substraty do prostych i wysokowydajnych strategii produkcji różnorodnych sulfonów i sulfonamidów. Tiosulfiniany są stabilną, nietoksyczną alternatywą dla soli metalosulfinianowych otrzymywanych z toksycznego SO2.
P. K. Shyam, H.-Y. Jang, J. Org. Chem., 2017, 82, 1761-1767.

Syntezę N-cyjanosulfilimin można łatwo uzyskać poprzez reakcję odpowiednich siarczków z aminą cyjanogenową w obecności zasady i NBS lub I2 jako czynników halogenujących. W wyniku utleniania, a następnie deksyanacji otrzymuje się użyteczne syntetycznie sulfoksyminy.
O. García Mancheño, O. Bistri, C. Bolm, Org. Lett., 2007,9, 3809-3811.

W kaskadowej transformacji ketonów w α-imidoketony w jednym garnku, N-bromobursztynoimid (NBS) dostarcza zarówno elektrofilowego bromu jak i nukleofilowego źródła azotu, a diazabicyklochodek-7-en (DBU) funkcjonuje jako baza i nukleofilowy promotor aktywacji NBS. Przypuszcza się, że kluczowym etapem procesu jest α-bromowanie.
Y. Wei, S. Lin, F. Liang, Org. Lett., 2012,14, 4202-4205.