US Pharm. 2013;38(2):HS2-HS8.
ABSTRAKT: Ostra zdekompensowana niewydolność serca (ADHF), zaostrzenie przewlekłej niewydolności serca, płuc i/lub nerek, jest przyczyną większości z 39 miliardów dolarów wydawanych na leczenie przewlekłej niewydolności serca. Farmakoterapia ADHF nie uległa ostatnio zmianie, ale badania wykazały, że większość terapii jest skuteczna, choć nieekonomiczna. Oparta na dowodach naukowych farmakoterapia w warunkach szpitalnych opiera się na zrozumieniu hemodynamicznych podgrup Forrestera i ich patofizjologii. Sukces kliniczny zależy nie tylko od właściwego leczenia szpitalnego, ale także od wykorzystania zespołu wypisowego.Farmaceuci mogą wypełnić lukę między wizytami w szpitalu a opieką ambulatoryjną, zalecając i zapewniając ciągłość opieki.
W 2010 roku koszty leczenia niewydolności serca (HF) w Stanach Zjednoczonych oszacowano na 39,2 miliarda dolarów.1,2Prawie 1 milion pacjentów jest co roku hospitalizowanych z powodu zaostrzeń, a HF jest obecnie najczęstszą przyczyną hospitalizacji osób dorosłych powyżej 65. roku życia.2 Ostra zdekompensowana niewydolność serca (ADHF) może być wynikiem źle kontrolowanej, przewlekłej HF i/lub dysfunkcji serca, płuc lub nerek. Koszty opieki stacjonarnej nad tymi pacjentami są bardzo wysokie i stanowią około 60% całkowitych wydatków na HF.3
Oprócz skutków finansowych HF, u pacjentów z ostrymi zaostrzeniami dochodzi do poważnego pogorszenia długości i jakości życia. Przyjęcie do szpitala wiąże się ze zwiększonym ryzykiem śmiertelności u pacjentów z HF; śmiertelność występuje u 15,5% pacjentów, a jedna trzecia pacjentów nigdy nie zostaje wypisana ze szpitala.2 ADHF jest wyniszczającą chorobą obciążającą nie tylko pacjentów, ale również system opieki zdrowotnej.
Farmakoterapia ADHF jest polem bitwy dla szpitali poszukujących możliwości kontroli kosztów w erze obniżonych płatności i zwiększonych wydatków. W październiku 2012 roku Centers for Medicare and Medicaid (CMS) zaczęło obcinać refundację szpitalom z wysokim odsetkiem przyjęć pacjentów w trzech kosztownych stanach chorobowych: zawał serca (MI), zapalenie płuc i HF. Jeśli pacjenci z tymi schorzeniami zostaną przyjęci do szpitala w ciągu 30 dni, CMS będzie obniżać całkowity zwrot kosztów o 1% rocznie, aż do maksymalnej redukcji o 3% w 2014 r.4 Wkrótce straty finansowe zmotywują prawie 2000 szpitali, które poniosą najwyższe kary, do wprowadzenia nowych zasad i dalszej opieki nad pacjentami wypisanymi z rozpoznaniem HF.
Na szczęście analiza przeprowadzona przez CMS w 2011 r. wykazała, że wskaźnik przyjęć do szpitala z HF zmniejszył się w ciągu 10 lat.1 W 2008 roku było o 229 000 mniej przyjęć niż przewidywano, biorąc pod uwagę trendy obserwowane w ciągu ostatnich kilku dekad.1,5Badacze przypisali ten spadek „zmniejszeniu częstości występowania choroby wieńcowej, lepszej kontroli ciśnienia tętniczego, częstszemu stosowaniu terapii opartych na dowodach naukowych i prawdopodobnie zmianom progów przyjęć”. Wskaźnik jednorocznej śmiertelności z wszystkich przyczyn pozostał jednak wysoki i wynosił około 30% wśród pacjentów hospitalizowanych z powodu NS.1,5Czarnoskórzy mężczyźni i niektóre regiony kraju radziły sobie gorzej pod względem wskaźników hospitalizacji; badacze wysunęli hipotezę, że różnice w dostępności lub jakości opieki mogą przyczyniać się do tych dysproporcji.1Najlepsze wyniki (zmniejszenie kosztów i wskaźnika ponownych przyjęć) obserwuje się w przypadku wielodyscyplinarnego podejścia obejmującego lekarzy, farmaceutów, pielęgniarki, dietetyków i fizykoterapeutów.6 Ten artykuł jest krótkim przeglądem farmakoterapii ADHF z dodatkowym spojrzeniem na względy farmakoekonomiczne i kontrowersje związane z wypisem.
Patofizjologia
ADHF jest definiowana jako nagłe pogorszenie objawów HF i jest zwykle spowodowana kardiogennym obrzękiem płuc z szybką akumulacją płynów w płucach, chociaż może wystąpić bez obrzęku płuc.7 Nadciśnienie tętnicze, niedokrwienie i/lub dysfunkcja układu komorowego powodują zmniejszenie rzutu serca, co prowadzi do aktywacji szlaku neurohormonalnego. Układ współczulny zwiększa stężenie noradrenaliny w celu poprawy perfuzji obwodowej poprzez skurcz naczyń oraz aktywuje układ renina-angiotensyna-aldosteron w celu zwiększenia perfuzji nerek poprzez zatrzymanie wody.8 Ostry wzrost ciśnienia napełniania lewej komory powoduje przeciek białkowo-przepływowy do pęcherzyków płucnych i śródmiąższu, ale nie dochodzi do naruszenia integralności błony płucnej. Mechanizmy kompensacyjne zwiększają częstość akcji serca i systemowy opór naczyniowy w celu poprawy rzutu serca, co prowadzi do błędnego koła.7,8
Wspólne przyczyny ADHF obejmują dysfunkcję lewej komory lub jej rozkurcz z lub bez choroby wieńcowej (CAD) lub zaburzeń zastawkowych. Chociaż u większości pacjentów hospitalizowanych z ADHF dochodzi do zaostrzenia istniejącej wcześniej HF, u 20% pacjentów nie rozpoznano wcześniej HF.9
ADHF może również wystąpić u pacjentów bez wcześniejszej choroby serca, w tym w takich stanach, jak ciężkie nadciśnienie tętnicze, przeciążenie płynami, ciężka choroba nerek lub zwężenie tętnicy nerkowej. Czynniki sprzyjające wystąpieniu ADHF wiążą się ze zmianą przepływu krwi przez serce; ADHF może być wywołana przez kryzys nadciśnieniowy, zawał serca lub niedokrwienie, niedrożność przedsionków, ostrą niedomykalność mitralną, przeciążenie płynami lub nieprzestrzeganie zaleceń lekarskich dotyczących HF. Niektóre leki, takie jakbeta-blokery, niedihydropirydynowe blokery kanału wapniowego i niesteroidowe leki przeciwzapalne (NLPZ), mogą również nasilaćADHF.7,10

Klasyfikacja
ADHF można podzielić na stadia hemodynamiczne w zależności od wskaźnika sercowego i ciśnienia zaklinowania w kapilarach płucnych. Stopnie te są sklasyfikowane jako podzbiory hemodynamiczne Forrestera (TABELA 1).11Wskaźnik sercowy (CI) określa stopień perfuzji; pacjenci są określani jako „ciepli” lub „zimni” w zależności od obecności hipoperfuzji. CI równy <2,2 L/min/m2 gwarantuje klasyfikację jako „zimny”, wskazując na hipoperfuzję. Oznaki i objawy charakterystyczne dla hipoperfuzji obejmują zmęczenie, hipotensję, koolejne kończyny, zmniejszenie czynności nerek i zmieniony stan psychiczny.Ciśnienie zaklinowania włośniczek płucnych (PCWP) wskazuje stan płynów; pacjentów klasyfikuje się jako „suchych” lub „mokrych” w zależności od obecności obrzęku, który definiuje się jako PCWP >18 mmHg. Objawy przeciążenia objętościowego obejmują kaszel, duszność, napadowy nocny bezdech, podwyższone ciśnienie w żyle szyjnej, obrzęki obwodowe, wodobrzusze, powiększenie wątroby i powiększenie śledziony.
Najczęstszą postacią, stanowiącą dwie trzecie przyjęć do szpitala z ADHF, jest podzbiór II (ciepły i wilgotny).8 W porównaniu z podzbiorem I (ciepły i suchy), podzbiór IV (zimny i wilgotny) zwiększa częstość zgonów dwuipółkrotnie.12Zgodnie z wynikami badania Acute Decompensated Heart Failure NationalRegistry (ADHERE) trzy kluczowe parametry laboratoryjne wskazują na zwiększone ryzyko zgonu wśród pacjentów hospitalizowanych: stężenie azotu mocznikowego we krwi ≥43 g/dl, skurczowe ciśnienie tętnicze <115 mmHg i/lub stężenie kreatyniny w surowicy >2,75 mg/dl.13
Farmakoterapia
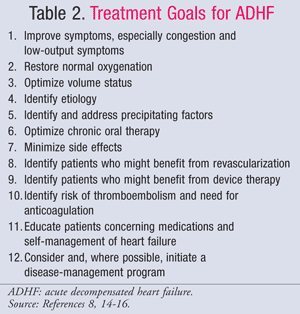
Postępowanie farmakologiczne w ADHF jest uzależnione od stanu hemodynamicznego pacjenta, który ocenia się na podstawie wartości CI i PCWP (TABELA 1).11 Cele i leki stosowane w leczeniu ADHF przedstawiono w TABELACH 2 i 3.8,14-16Chociaż standardy leczenia nie zmieniły się znacząco w ciągu ostatnich kilku lat, to nowe spojrzenie na farmakoekonomiczne skutki HF pokazało, że nie wszystkie metody leczenia są jednakowe. Farmakoterapię należy dobierać w zależności od rozpoznanego podzbioru, lecząc albo przeciążenie płynami, albo hipoperfuzję. Pacjenci z podzbioru IV są klasyfikowani jako osoby z przeciążeniem płynami i zaburzeniami perfuzji, a zatem wymagają leczenia obu objawów.
Zbiór II lub IV-Wet: Dożylne (IV) diuretyki pętlowe są podstawą leczenia ADHF u pacjentów z przeciążeniem płynami (PCWP >18 mmHg), pomimo sprzecznych danych dotyczących korzyści w zakresie śmiertelności i zachorowalności. Metaanaliza 14 małych badań wykazała zmniejszenie śmiertelności i liczby hospitalizacji u pacjentów leczonych diuretykami17; jednak ostatnia analiza danych obserwacyjnych z badania ADHERE wykazała, że hospitalizowani pacjenci leczeni diuretykami dożylnymi mieli dłuższy całkowity czas pobytu i dłuższy czas pobytu na oddziale intensywnej terapii18. Niezależnie od tego, aktualizacja wytycznych American College of Cardiology/American HeartAssociation (ACC/AHA) z 2009 r. dotycząca leczenia HF zaleca wczesne podawanie dożylnych leków moczopędnych.14 Preferowane są bolusowe dawki diuretyków pętlowych. Najczęściej stosuje się furosemid, jednak bumetanid i torsemid są równie skuteczne. Jeżeli chorzy nie reagują na maksymalną zalecaną dawkę bolusa leku pętlodiuretycznego, można rozpocząć ciągły wlew furosemidu w dawce 5 mg/h i w razie potrzeby zwiększyć ją do 20 mg/h.14
Nie ustalono jeszcze wyższości podawania furosemidu we wlewie ciągłym; badanie Diuretic Optimization StrategiesEvaluation (DOSE), w którym uczestniczyło 308 hospitalizowanych pacjentów przydzielonych do podawania furosemidu w bolusie lub dożylnie, nie wykazało istotnej różnicy między punktami końcowymi dotyczącymi bezpieczeństwa i skuteczności, ale w mniejszych badaniach wykazano niewielki wzrost ilości wydalanego moczu przy podawaniu furosemidu we wlewie ciągłym.19 Nieopanowane skutki szybkiej diurezy, takie jak zaburzenia równowagi elektrolitowej i dysfunkcja nerek, mogą prowadzić do przedłużenia hospitalizacji po ustąpieniu objawów ADHF, dlatego należy często monitorować stężenie elektrolitów i kreatyniny w surowicy.
Inną strategią zwiększenia diurezy jest dodanie drugiego leku moczopędnego o innym mechanizmie działania, takiego jak metolazon lub spironolakton. Metolazon, diuretyk tiazydopodobny, jest najczęściej stosowany do ostrej kontroli objętości; jednak w terapii przewlekłej HF preferuje się spironolakton i innych antagonistów aldosteronu.20-22
W przypadku pacjentów z utrzymującym się nadciśnieniem i/lub utrzymującymi się objawami mimo agresywnej diurezy można dodać lek rozszerzający naczynia w celu zmniejszenia przekrwienia płuc. Nitroprusydek sodu, nesirytus i nitrogliceryna dożylnie to leki rozszerzające naczynia żylne, które szybko łagodzą objawy zatorowe poprzez zmniejszenie PCWP. Jeśli u pacjenta występuje niski rzut serca i wysoki systemowy opór naczyniowy, zaleca się stosowanie leków rozszerzających naczynia żylne lub inotropów, chociaż preferowaną terapią są leki rozszerzające naczynia. Ze względu na ryzyko toksycznego działania cyjanku podczas długotrwałego wlewu dużych dawek nitroprusydku, preferowanymi lekami rozszerzającymi naczynia są nesirytus i nitrogliceryna. W badaniu Vasodilation in theManagement of Acute Congestive Heart Failure (VMAC) nesiritid, mimo skłonności tego leku do wywoływania hipotensji, spowodował większą poprawę ogólnego stanu klinicznego niż nitrogliceryna13. Z tego względu nesirityd jest preferowanym lekiem u pacjentów z przeciążeniem płynami i niskim rzutem serca.
Przydatność nesiritydu była kwestionowana ze względu na jego wysoki koszt nabycia.23 Brakuje danych dotyczących wyników klinicznych, ale jeden z modeli farmakoekonomicznych wskazuje, że wysoki początkowy koszt nesiritydu jest równoważony przez niższy wskaźnik ponownych przyjęć do szpitala w ciągu 21 dni w porównaniu z pacjentami, którzy otrzymywali dobutaminę.24 Podobnie, retrospektywna analiza danych ADHERE wykazała, że pacjenci leczeni nitrogliceryną lub nesiritidem byli wypisywani ze szpitala wcześniej niż pacjenci leczeni dobutaminą lub milrinonem, a także charakteryzowali się mniejszym ryzykiem śmiertelności.13 Ponieważ więcej pacjentów w stanie krytycznym było leczonych w ramachotropów, trudno jest przypisać zwiększoną śmiertelność do leku.
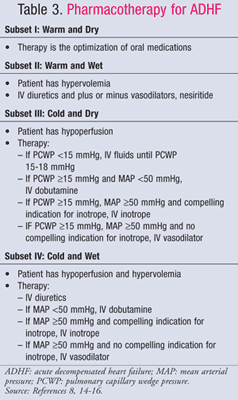
Zestaw III lub IV-zimny: Dobutamina i silrinon są inotropami z wyboru w celu zwiększenia perfuzji i zachowania perfuzji narządów końcowych u pacjentów ze zmniejszonym rzutem serca.Istotne wskazania do podania inotropów obejmują skurczowe ciśnienie tętnicze<90 mmHg, objawowe niedociśnienie pomimo odpowiedniego ciśnienia napełniania (PCWP 15-18 mmHg), pogarszającą się funkcję nerek lub nieodpowiednią odpowiedź na leki rozszerzające naczynia krwionośne. Ostrożny dobór chorych jest konieczny, ponieważ dane wskazują, że gorsze wyniki leczenia uzyskuje się, gdy inotropy podaje się chorym z zachowanym rzutem serca. W badaniu OPTIME-CHF wykazano nieistotny wzrost śmiertelności i częstości występowania arytmii, gdy wlewy milrinonu podawano chorym jako część standardowej opieki.25 Milrinon należy wybierać do leczenia chorych otrzymujących jednocześnie beta-blokery, ponieważ wpływa on na rzut serca i systemowy opór naczyniowy poprzez hamowanie fosfodiesterazy, podczas gdy dobutamina jest agonistą abeta1. Dobutamina jest jednak najlepszym wyborem dla pacjentów z nadciśnieniem tętniczym, ponieważ milrinon może powodować znaczne spadki ciśnienia tętniczego.15
Planowanie wypisu
Ostatnim etapem leczenia ADHF jest planowanie wypisu i dalsza obserwacja. Zarówno wytyczne ACC/AHA, jak i wytyczne Amerykańskiego Towarzystwa Niewydolności Serca (HFSA) podkreślają znaczenie właściwego planowania wypisu.14,15 Główne elementy opieki nad chorym przy wypisie ze szpitala, opartej na dowodach naukowych, obejmują leczenie czynników zaostrzających, takich jak odstawienie niedihydropirydynowych blokerów kanału wapniowego lub NLPZ, osiągnięcie optymalnego stanu objętościowego, optymalizację leczenia farmakologicznego i przejście na doustną terapię ambulatoryjną (TABELA 4).15 Wytyczne ACC/AHA zalecają przekazanie pacjentom i/lub ich opiekunom przy wypisie ze szpitala pisemnych instrukcji lub materiałów edukacyjnych dotyczących: poziomu aktywności, diety, leków przy wypisie, wizyty kontrolnej, monitorowania masy ciała i postępowania w przypadku pogorszenia objawów.14Wytyczne wskazują również na korzyści płynące z rozpoczęcia obniżającej śmiertelność terapii doustnej HF podczas przyjęcia do szpitala, takiej jak inhibitory konwertazy angiotensyny (ACE) i beta-adrenolityki.Badania wykazały, że opieka oparta na wytycznych zmniejsza śmiertelność,26 ale nie wykazano zmniejszenia liczby ponownych przyjęć pacjentów z HF.27,28

Discharge support, czyli szpitalne zarządzanie przypadkami, jest obecnie wykorzystywane do planowania wypisu. Wsparcie przy wypisie jest wielodyscyplinarnym, zespołowym podejściem do opieki, które obejmuje pomoc w przyjmowaniu leków, edukację pacjenta, planowanie dalszych działań i koordynację informacji. W metaanalizie 18 randomizowanych, kontrolowanych badań (RCT), w których analizowano planowanie wypisu z oddziału z uwzględnieniem wsparcia po wypisie z oddziału z udziałem 3 304 pacjentów, stwierdzono istotną redukcję liczby ponownych przyjęć z wszystkich przyczyn (ryzyko względne 0,75, 95% CI 0,68-0,88).29 Trudno jest określić zewnętrzną wiarygodność metaanalizy, ale może ona oferować pewne opłacalne strategie. Jedna z nich pochodzi z badania RCT obejmującego 223 pacjentów z HF, w którym porównano tradycyjne wsparcie przy wypisie z oddziału z materiałami edukacyjnymi z 1-godzinną indywidualną sesją szkoleniową z udziałem pielęgniarki-edukatorki przed wypisem.30 W grupie z interwencją pielęgniarską ryzyko ponownej hospitalizacji lub zgonu 180 dni po wypisie było mniejsze, a oszczędności w przeliczeniu na jednego pacjenta oszacowano na 2 823 USD. Z kolei w dużych badaniach obserwacyjnych nie stwierdzono związku między otrzymywaniem przez pacjentów materiałów edukacyjnych a zmniejszeniem wskaźnika readmisji.26,31 Aktualne wytyczne ACC/AHA nie określają jednoznacznie sposobu wypisywania pacjentów z ADHF innego niż przekazanie materiałów edukacyjnych.14 Zalecenia zawarte w wytycznych mogą nie zapewniać procedur wypisowych, które pomogłyby szpitalom spełnić oczekiwania CMS.
Podczas gdy materiały edukacyjne przy wypisie nie wykazały korzyści w zakresie śmiertelności, każdy dodatkowy doustny środek stosowany w leczeniu ADHF, taki jak beta-bloker lub antagonista aldosteronu, może zmniejszyć liczbę hospitalizacji i/lub śmiertelność o 25% do 35%. Wytyczne ACC/AHA sugerują, że wielu pacjentów z HF jest wypisywanych do domu przed osiągnięciem optymalnego stanu objętościowego lub bez zastosowania terapii ratujących życie, co utrwala zjawisko szybkiej readmisji takich pacjentów.14 Farmaceuta szpitalny powinien być rzecznikiem pacjentów w zespole wspierającym przy wypisie, pomagając w uzgadnianiu leków, odstawianiu leków przeciwwskazanych i zalecając farmakoterapię HF opartą na dowodach. Leki powinny być włączane tak szybko, jak to możliwe, najlepiej w warunkach szpitalnych; włączenie tych leków może nasilić objawy HF poprzedzające ADHF, co dodatkowo podkreśla znaczenie wczesnej obserwacji tej populacji pacjentów.
Wnioski
ADHF jest obciążeniem dla pacjentów, świadczeniodawców i płatników. Farmakoterapia ADHF nie zmieniła się w ostatnim czasie, ale wykorzystanie zespołów wspierających wypisy ze szpitala i szybka obserwacja po wypisie stwarzają możliwości interwencji farmaceuty, zarówno w szpitalu, jak i poza nim. Farmaceuci środowiskowi mogą odegrać dużą rolę w zapewnieniu ciągłości opieki, pomagając w przejściu pacjentów ze szpitala do opieki podstawowej. Farmaceuci są w stanie zaoferować właściwe zalecenia oparte na wytycznych, pomóc w uzgadnianiu leków i zapewnić edukację przy wypisie. W związku z ostatnimi zmianami w systemie refundacji CMS, farmaceuci muszą odgrywać większą rolę w leczeniu tej przewlekłej choroby.
1. Winslow R, Wang SS. Niewydolność serca powoduje, że mniej osób trafia do szpitala. Wall Street Journal. October 19, 2011. http://online.wsj.com/article/SB10001424052970203658804576639360226103584.html. Dostęp 1 września 2012 r.
2. Lloyd-Jones D, Adams RJ, Brown TM, et al. Heart diseaseand stroke statistics-2010 update. A report from the American HeartAssociation. Circulation. 2010;121:e46-e215.
3. Michota FA Jr, Amin A. Bridging the gap between evidence and practice in acute decompensated heart failure management. J Hosp Med. 2008;3(suppl):S7-S15.
4. Rau J. Medicare ukarać 2,217 szpitali za nadmiar readmisji. Kaiser Health News.August 13, 2012.www.kaiserhealthnews.org/Stories/2012/August/13/medicare-hospitals-readmissions-penalties.aspx.Accessed September 1, 2012.
5. Chen J, Normand ST, Wang Y, Krumholz HM. National andregional trends in heart failure hospitalization and mortality rates forMedicare beneficiaries, 1998-2008. JAMA. 2011;306:1669-1678.
6. Amin A. Kto zajmuje się ostrą zdekompensowaną niewydolnością serca? The need for a multidisciplinary approach. J Hosp Med. 2008;6(suppl):S1-S6.
7. Pinto DS, Lewis S. Patofizjologia ostrej zdekompensowanej niewydolności serca. In: Basow DS, ed. UpToDate. Waltham, MA: UpToDate; 2012.
8. Crouch MA, Didomenico RJ, Rodgers JE. Applyingconsensus guidelines in the management of acute decompensated heartfailure. ACPE Program #204-000-06-407-H01. Bethesda, MD: ASHP Advantage;2007.
9. Joseph SM, Cedars AM, Ewald GA, et al. Acute decompensated heart failure: contemporary medical management. Tex Heart Inst J. 2009;36:510-520.
10. Pinto DS, Lewis S. Ocena ostrej zdekompensowanej niewydolności serca. In: Basow DS, ed. UpToDate. Waltham, MA: UpToDate; 2012.
11. Forrester JS, Diamond G, Chatterjee K, et al. Medicaltherapy of acute myocardial infarction by application of hemodynamicsubsets. N Engl J Med. 1976;295:1356-1362.
12. Nohria A, Mielniczuk LM, Stevenson LW. Evaluation and monitoring of patients with acute heart failure syndromes. Am J Cardiol. 2005;96:32G-40G.
13. Abraham WT, Adams KF, Fonarow GC, et al. In-hospitalmortality in patients with acute decompensated heart failure requiringintravenous vasoactive medications: an analysis from the AcuteDecompensated Heart Failure National Registry (ADHERE). J Am Coll Cardiol. 2005;46:57-64.
14. Hunt SA, Abraham WT, Chin MH, et al. 2009 focusedupdate incorporated into the ACC/AHA 2005 guidelines for the diagnosisand management of heart failure in adults: a report of the AmericanCollege of Cardiology Foundation/American Heart Association Task Forceon Practice Guidelines. Circulation. 2009;119;e391-e479.
15. Heart Failure Society of America. Evaluation andmanagement of patients with acute decompensated heart failure: HFSA 2010comprehensive heart failure practice guideline. J Card Fail. 2010;16:e134-e156.
16. Colucci W. Leczenie ostrej zdekompensowanej niewydolności serca: Komponenty terapii. In: Basow DS, ed. UpToDate. Waltham, MA: UpToDate; 2012.
17. Faris R, Flather MD, Purcell H, et al. Diuretics for heart failure. Cochrane Database Syst Rev. 2012;(1):CD003838.
18. Gheorghiade M, Filippatos G. Reassessing treatment of acute heart failure syndromes: the ADHERE registry. Eur Heart J. 2005;7:813-819.
19. Felker GM, Lee KL, Bull DA, et al. Diuretic strategies in patients with acute decompensated heart failure. N Engl J Med. 2011;364:797-805.
20. Effectiveness of spironolactone added to anangiotensin-converting enzyme inhibitor and a loop diuretic for severechronic congestive heart failure (the Randomized Aldactone EvaluationStudy). Am J Cardiol. 1996;78:902-907.
21. Pitt B, Remme W, Zannad F, et al. Eplerenone, aselective aldosterone blocker, in patients with left ventriculardysfunction after myocardial infarction. N Engl J Med. 2003;348:1309-1321.
22. Zannad F, McMurray JJ, Krum H, et al; EMPHASIS-HFStudy Group. Eplerenone in patients with systolic heart failure and mildsymptoms. N Engl J Med. 2011;364:11-21.
23. Gerhard T, Zineh I, Winterstein AG, Hartzema AG.Pharmacoeconomic modeling of nesiritide versus dobutamine fordecompensated heart failure. Pharmacotherapy. 2006;26:34-43.
24. Lissovoy G, Stier DM, Ciesla G, et al. Economicimplications of nesiritide versus dobutamine in the treatment ofpatients with acutely decompensated congestive heart failure. Am J Cardiol. 2003;92:631-633.
25. Cuffe MS, Califf RM, Adams KF Jr, et al. Short-termintravenous milrinone for acute exacerbation of heart failure: arandomized controlled trial. JAMA. 2002;287:1541-1547.
26. Kfoury AG, French TK, Horne BD, et al. Incrementalsurvival benefit with adherence to standardized heart failure coremeasures: a performance evaluation study of 2958 patients. J Card Fail. 2008;14:95-102.
27. Patterson ME, Hernandez AF, Hammill BG, et al. Processof care performance measures and long-term outcomes in patientshospitalized with heart failure. Med Care. 2010;48:210.
28. Fonarow GC, Abraham WT, Albert NM, et al. Associationbetween performance measures and clinical outcomes for patientshospitalized with heart failure. JAMA. 2007;297:61-70.
29. Phillips CO, Wright SM, Kern DE, et al. Comprehensivedischarge planning with postdischarge support for older patients withcongestive heart failure: a meta-analysis. JAMA. 2004;291:1358-1367.
30. Koelling TM, Johnson ML, Cody RJ, Aaronson KD.Discharge education improves clinical outcomes in patients with chronic heart failure. Circulation. 2005;111:179-185.
31. Jha AK, Orav EJ, Epstein AM. Public reporting of discharge planning and rates of readmissions. N Engl J Med. 2009;361:2637-2645.