Ruchliwość jest zdolnością organizmu do samodzielnego poruszania się za pomocą śmigłowych flagelli unikalnych dla bakterii lub specjalnych włókien, które wytwarzają ślizgową formę ruchliwości. Bakterie ruchliwe poruszają się za pomocą flagelli, nitkowatych przydatków lokomotorycznych wysuwających się z błony plazmatycznej i ściany komórkowej, albo pojedynczej flagelli, albo wielu flagelli. Ruchliwość od dawna uznawana jest za ważne narzędzie taksonomiczne i cechę biologiczną mikroorganizmów. Obecność flagelli występuje przede wszystkim u pałeczek, ale jest też kilka flagellowanych kokcytów, dlatego też ruchliwość jest bardzo ważnym sposobem identyfikacji w rodzinie Enterobacteriaceae. Od pierwszych dni w dziedzinie mikrobiologii, zdolność bakterii do poruszania się była używana jako środek do różnicowania i klasyfikacji organizmów.
Cel
- Określenie ruchliwości bakterii.
- Różnicowanie pomiędzy bakteriami ruchliwymi i nieruchliwymi.
Zasada
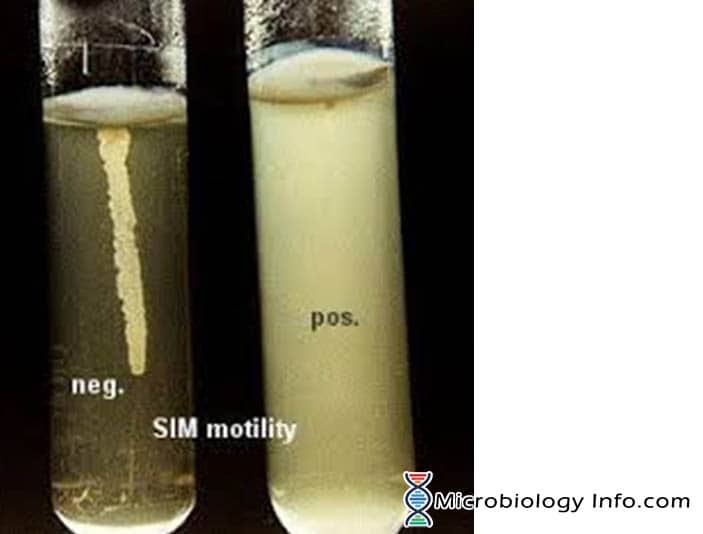
Ruchliwość bakterii jest najczęściej wykazywana w półstałym podłożu agarowym. W półstałych pożywkach agarowych, bakterie ruchliwe „roją się” i dają rozproszony wzrost, który jest łatwo rozpoznawalny gołym okiem. Pożywka używana głównie do tego celu to pożywka SIM (Sulphide Indole Motility medium), która jest kombinacją pożywki różnicującej, która testuje trzy różne parametry, redukcję siarki, produkcję indolu i ruchliwość. Podłoże to ma bardzo miękką konsystencję, która pozwala bakteriom ruchliwym łatwo migrować przez nie powodując zmętnienie. Inokulum jest wkłuwane w środek półstałego podłoża agarowego. Ruchliwość bakterii jest widoczna poprzez rozproszoną strefę wzrostu rozciągającą się od linii inokulacji. Niektóre organizmy rosną na całej powierzchni pożywki, podczas gdy inne wykazują małe obszary lub guzki, które rosną od linii inokulacji. Bakterie niemotylne będą rosły tylko w miękkiej probówce agarowej i tylko w obszarze, w którym zostały zaszczepione.
Podłoże:
Podłoże SIM
Przeferment trzustkowy kazeiny 20.0g, Przefermentowana tkanka zwierzęca 6.1g, Agar 3.5g, Fe(NH4)2(SO4)2-6H2O 0.2g, Na2S2O3-5H2O 0.2g, pH 7.3 ± 0.2 w 25°C
Metoda
- Dotknij prostą igłą do kolonii młodej (18- do 24-godzinnej) kultury rosnącej na podłożu agarowym.
- Wbij raz na głębokość tylko 1/3 do ½ cala w środku probówki. Upewnij się, że igła znajduje się w tej samej linii, w której została wyjęta z pożywki.
- Inkubuj w temperaturze 35°-37°C i badaj codziennie przez okres do 7 dni.
- Obserwuj rozproszoną strefę wzrostu rozciągającą się od linii inokulacji.
Spodziewane wyniki
- Pozytywne: Rozproszone, zamglone wzrosty, które rozprzestrzeniają się w pożywce, czyniąc ją lekko nieprzezroczystą.
- Negatywny: Wzrost, który jest ograniczony do linii papilarnej, z ostro zdefiniowanymi brzegami i pozostawiający otaczającą pożywkę wyraźnie przezroczystą.
Zastosowanie
- Jest stosowany do różnicowania mikroorganizmów na podstawie ruchliwości w warunkach laboratoryjnych.Wykonywany jest w celu przypisania klasyfikacji taksonomicznej do organizmów.
- Testy ruchliwości są ważne w charakterystyce patogenów.
- Testy są często stosowane w protokołach identyfikacyjnych w rodzinie Enterobacteriaceae
- Test ruchliwości jest również stosowany do różnicowania gatunkowego bakterii Gram-dodatnich, Enterokoków. Enterococcus faecium i E. faecalis nie są ruchliwe, podczas gdy E. gallinarum i E. casseliflavus/E. flavescens są ruchliwe.
Ograniczenia
- Niektóre organizmy nie wykazują wystarczającego wzrostu na tym podłożu, aby dokonać dokładnego oznaczenia i wymagane są dodatkowe badania kontrolne.
- Zaleca się wykonanie badań biochemicznych, immunologicznych, molekularnych lub spektrometrii masowej na koloniach z czystej kultury w celu pełnej identyfikacji.
- Reakcje fałszywie ujemne mogą wystąpić, jeśli flagi bakteryjne zostaną uszkodzone w wyniku ogrzewania, wstrząsania lub innego urazu. Taki szok środowiskowy spowoduje, że organizm przestanie być ruchliwy.
- Organizmy, które są słabo ruchliwe mogą powodować reakcje fałszywie ujemne.
- Podczas inokulacji pożywek półstałych ważne jest, aby igła inokulacyjna była wyciągana dokładnie wzdłuż tej samej linii, która została użyta do inokulacji pożywki. Ruch wachlarzowy może spowodować wzrost wzdłuż linii ukłucia, co może skutkować interpretacją fałszywie dodatnią.
- Tille, P. M., & Forbes, B. A. (2014). Mikrobiologia diagnostyczna Bailey & Scott’s diagnostic microbiology (Thirteenth edition.). St. Louis, Missouri: Elsevier.
- Cappuccino J.G. i Sherman N. 2008. Microbiology: A Laboratory Manual, 8th ed. Pearson Benjamin Cummings, San Francisco, CA, USA.
- vlab.amrita.edu/?sub=3&brch=73&sim=697&cnt=1
- www.asmscience.org/content/education/protocol/protocol.3658
- https://catalog.hardydiagnostics.com/cp_prod/Content/hugo/MotilityTestMedia.htm