Exzitotoxizitätstheorie^
Glutamat übt seine Wirkung durch Bindung an spezifische Rezeptoren auf Nervenzellen aus. Es gibt verschiedene Typen von Glutamatrezeptoren. Hier werden wir uns mit zwei Arten von Glutamatrezeptoren beschäftigen, die als NMDA-Rezeptor und Nicht-NMDA-Rezeptor bezeichnet werden. Diese Rezeptoren enthalten alle Glutamat-Bindungsstellen. Sobald Glutamat an den Rezeptor bindet, „erregt“ Glutamat die Zellen, indem es positive Ionen in die Zelle einströmen lässt und so die elektrische Ladung der Zelle erhöht. Die erhöhte Ladung löst Veränderungen im Neuron aus, die letztlich zur Freisetzung vieler Neurotransmitter am Ende der Zelle führen.
Wissenschaftler haben entdeckt, dass NMDA-Rezeptoren in Zellen von Menschen mit HD durch Glutamat überaktiviert sind. Die Forscher glauben, dass diese Überaktivierung auf die Beeinträchtigungen des Energiestoffwechsels zurückzuführen ist, die durch das veränderte Huntingtin-Gen von Menschen mit HD verursacht werden. (Mehr zum Energiestoffwechsel finden Sie hier.) Der Defekt im Energiestoffwechsel führt zu einer verminderten Energiemenge in der Zelle, was wiederum zu Veränderungen im NMDA-Rezeptor führt.
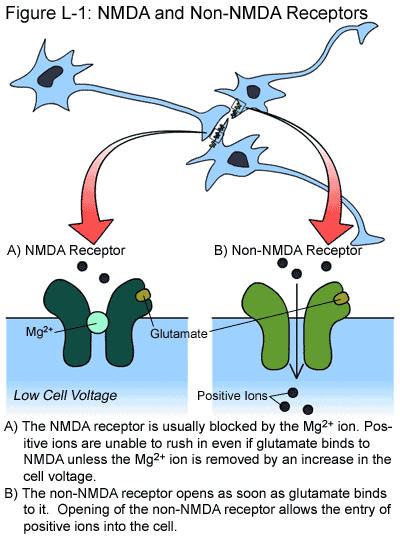
Der NMDA-Rezeptor auf Nervenzellen ist einzigartig, da er verschiedene Eigenschaften besitzt, die bei anderen Rezeptortypen nicht vorkommen. Erstens haben die NMDA-Rezeptoren die besondere Fähigkeit, große Mengen an Kalzium-Ionen (Ca2+) einzulassen, ein wichtiger Vermittler der toxischen Wirkungen von Glutamat bei HD-Patienten. Nicht-NMDA-Rezeptoren erlauben den Eintritt von Ca2+ nicht. Wir werden später in diesem Abschnitt mehr über die zerstörerischen Wirkungen von Ca2+ sprechen. Eine zweite wichtige Eigenschaft des NMDA-Rezeptors ist, dass seine Öffnung durch ein einzelnes Magnesiumion (Mg2+) blockiert wird. Ein Mg2+-Ion wird nur dann entfernt, wenn die elektrische Ladung innerhalb der Zelle auf einen bestimmten Wert ansteigt. Während sich Nicht-NMDA-Rezeptoren jederzeit öffnen, wenn Glutamat an sie bindet, benötigt der NMDA-Rezeptor sowohl die Bindung von Glutamat als auch einen Anstieg der Zellladung, bevor er sich öffnet.
Normalerweise bindet Glutamat, wenn es von „Botenstoff-abgebenden“ Nervenzellen freigesetzt wird, an die NMDA- und Nicht-NMDA-Rezeptoren der empfangenden Nervenzelle. Da die Nicht-NMDA-Rezeptoren nicht blockiert sind, öffnet allein die Bindung von Glutamat diese Rezeptoren und lässt positiv geladene Ionen in die Zelle einströmen. In den Zellen vorhandene Ionenpumpen entfernen einen Teil der positiven Ionen und verhindern so, dass die Ladung innerhalb der Zelle zu schnell ansteigt. Diese Ionenpumpen arbeiten nur dann, wenn genügend Energie in der Zelle vorhanden ist. Aufgrund der Aktivitäten dieser Ionenpumpen müssen viele Glutamatmoleküle an die Nicht-NMDA-Rezeptoren binden, bevor die Ladung der Zelle auf den Wert ansteigt, der es erlaubt, das Mg2+-Ion des NMDA-Rezeptors zu entfernen. Sobald das Mg2+-Ion entfernt ist, lässt der NMDA-Rezeptor Ca2+-Ionen einströmen.

In HD-Nervenzellen hingegen reduziert die geringere verfügbare Energiemenge die Fähigkeit der Ionenpumpen, einen schnellen Anstieg der Zellspannung zu verhindern. Infolgedessen werden weniger Glutamatmoleküle, die an die Nicht-NMDA-Rezeptoren binden, benötigt, um die Zellladung auf den Wert zu erhöhen, der zur Entfernung von Mg2+ benötigt wird. Die vorzeitige Entsperrung des NMDA-Rezeptors bewirkt einen Anstieg des Eintritts von Ca2+-Ionen in die Zelle. Wenn Ca2+ in die Zelle strömt, aktiviert es verschiedene Moleküle, die in der Lage sind, essentielle Proteine und Zellmembranen abzubauen, die Anzahl der freien Radikale in der Zelle zu erhöhen und einen weiteren Anstieg der Ca2+-Menge in der Zelle zu verursachen. Aus der Kombination dieser Effekte, die aus dem erhöhten Ca2+-Eintrag resultieren, resultiert schließlich der Zelltod.
Zusammenfassend verursacht das veränderte Huntingtin-Protein eine Abnahme der Energieversorgung der Nervenzelle. Dieser Energiemangel führt zu einer Erhöhung der Empfindlichkeit der NMDA-Rezeptoren gegenüber Glutamatmolekülen. Da die NMDA-Rezeptoren überaktiviert werden, können mehr Ca2+-Ionen in die Zelle eindringen. Der Eintritt von Ca2+ führt zur Aktivierung verschiedener Moleküle, die in der Lage sind, den Zelltod zu verursachen.
Anti-Glutamat-Therapien umfassen Medikamente und Nahrungsergänzungsmittel, die in der Lage sind, diese verschiedenen Wirkungen von Glutamat in Zellen zu reduzieren. Diese Substanzen blockieren entweder Glutamatrezeptoren oder reduzieren die Menge an Glutamat, die von anderen Zellen freigesetzt wird. Diese Verbindungen können auch die Menge an Glutamat reduzieren, die in der Verbindung zwischen Glutamat freisetzenden Nervenzellen und Glutamat-aufnehmenden Nervenzellen vorhanden ist.
Für weitere Lektüre^
- Kandel, Eric. Essentials of Neuroscience and Behavior. McGraw-Hill Professional Publishing, 1996.
Dieses einführende neurowissenschaftliche Lehrbuch enthält detaillierte Informationen über die Wechselwirkungen zwischen Neurowissenschaft und Verhalten. Die meisten der in diesem Abschnitt vorgestellten Informationen über Glutamat und seine Rezeptoren finden sich in Kandels Buch.