Basizität von heterocyclischen Aminen
Wenn ein Stickstoffatom direkt in einen aromatischen Ring eingebaut ist, hängt seine Basizität vom Bindungskontext ab. In einem Pyridinring zum Beispiel besetzt das einsame Stickstoffpaar ein sp2-Hybridorbital und ist nicht Teil des aromatischen Sextetts – es ist im Wesentlichen ein Iminstickstoff. Sein Elektronenpaar steht für die Bildung einer Bindung zu einem Proton zur Verfügung, und somit ist das Pyridin-Stickstoffatom etwas basisch.

In einem Pyrrolring hingegen ist das Stickstoff-Einzelpaar Teil des aromatischen Sextetts. Das bedeutet, dass diese Elektronen dort, wo sie sind (im aromatischen System), sehr stabil sind und viel weniger für die Bindung an ein Proton zur Verfügung stehen (und wenn sie doch ein Proton aufnehmen, wird das aromatische System zerstört). Aus diesen Gründen sind Pyrrol-Stickstoffatome nicht stark basisch.

Die Beispiele Anilin, Pyridin und Pyrrol sind gute Modelle für die Vorhersage der Reaktivität von Stickstoffatomen in komplexeren Ringsystemen (von denen es in der Natur eine große Vielfalt gibt). Die Tryptophan-Seitenkette zum Beispiel enthält einen nicht-basischen „pyrrolartigen“ Stickstoff, während Adenin (eine DNA/RNA-Base) alle drei Typen enthält.


Die einsamen Paarelektronen am Stickstoff eines Nitrils befinden sich in einem sp-Hybrid-Orbital. Der 50%ige s-Charakter eines sp-Hybridorbitals bedeutet, dass die Elektronen nahe am Kern liegen und daher nicht signifikant basisch sind.
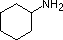
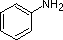
Ein Überblick über grundlegende Säure-Base-Konzepte sollte für die folgende Diskussion hilfreich sein. Wie Ammoniak sind die meisten Amine Brønsted- und Lewis-Basen, aber ihre Basenstärke kann durch Substituenten enorm verändert werden. Es ist üblich, Basen quantitativ zu vergleichen, indem man die pKa’s ihrer konjugierten Säuren anstelle ihrer pKb’s verwendet. Da pKa + pKb = 14 ist, ist die Base umso stärker, je höher der pKa ist, im Gegensatz zu der üblichen umgekehrten Beziehung von pKa mit der Säure. Die meisten einfachen Alkylamine haben pKa-Werte im Bereich von 9,5 bis 11,0, und ihre wässrigen Lösungen sind basisch (haben einen pH-Wert von 11 bis 12, je nach Konzentration). Die ersten vier Verbindungen in der folgenden Tabelle, einschließlich Ammoniak, fallen in diese Kategorie.
Die letzten fünf Verbindungen (farbige Zellen) sind deutlich schwächere Basen, was auf drei Faktoren zurückzuführen ist. Der erste davon ist die Hybridisierung des Stickstoffs. In Pyridin ist der Stickstoff sp2-hybridisiert, und in Nitrilen (letzter Eintrag) ist ein sp-Hybridstickstoff Teil der Dreifachbindung. In jeder dieser Verbindungen (rot schraffiert) ist das nicht bindende Elektronenpaar am Stickstoffatom lokalisiert, aber mit zunehmendem s-Charakter rückt es näher an den Stickstoffkern heran, was seine Neigung zur Bindung an ein Proton verringert.
|
Verbindung |
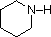 |
 |
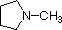 |
NH3 |  |
 |
 |
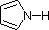 |
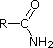 |
CH3C≡N |
|---|---|---|---|---|---|---|---|---|---|---|
| pKa | 11.0 | 10.7 | 10.7 | 9.3 | 5.2 | 4.6 | 1.0 | 0.0 | -1.0 | -10. |
Basizität üblicher Amine (pKa der konjugierten Ammonium-Ionen)
Schließlich spiegelt die sehr niedrige Basizität von Pyrrol (blau schattiert) die außergewöhnliche Delokalisierung des Stickstoff-Elektronenpaares wider, die mit seinem Einbau in einen aromatischen Ring verbunden ist. Indol (pKa = -2) und Imidazol (pKa = 7,0), siehe oben, haben ebenfalls ähnliche heterocyclische aromatische Ringe. Imidazol ist mehr als eine Million Mal basischer als Pyrrol, da der sp2-Stickstoff, der Teil einer Doppelbindung ist, strukturell dem Pyridin ähnelt und eine vergleichbare Basizität aufweist.
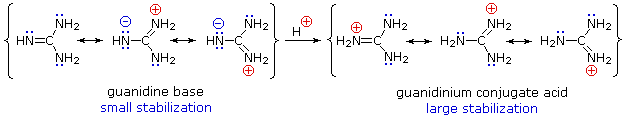
Obwohl die Resonanzdelokalisation im Allgemeinen die Basizität von Aminen reduziert, findet sich ein dramatisches Beispiel für den umgekehrten Effekt in der Verbindung Guanidin (pKa = 13,6). Hier ist, wie unten gezeigt, die Resonanzstabilisierung der Base aufgrund von Ladungstrennung gering, während die konjugierte Säure durch Ladungsdelokalisierung stark stabilisiert wird. Folglich sind wässrige Lösungen von Guanidin fast so basisch wie Lösungen von Natriumhydroxid.