US Pharm. 2013;38(2):HS2-HS8.
ABSTRACT: Die akute dekompensierte Herzinsuffizienz (ADHF), eine Exazerbation der chronischen Herz-, Lungen- und/oder Nierenfunktionsstörung, ist für den Großteil der 39 Milliarden US-Dollar verantwortlich, die für chronische Herzinsuffizienz ausgegeben werden. Die Pharmakotherapie des ADHF hat sich in letzter Zeit nicht geändert, aber Studien haben gezeigt, dass die meisten Therapien wirksam, wenn auch nicht wirtschaftlich, sind. Die evidenzbasierte, stationäre Pharmakotherapie wird durch das Verständnis der Forrester-Hämodynamik-Subsets und deren Pathophysiologie geleitet. Der klinische Erfolg hängt nicht nur von der richtigen stationären Behandlung ab, sondern auch von der Nutzung eines Entlassungsteams.
Apotheker können die Lücke zwischen Krankenhausaufenthalt und ambulanter Versorgung überbrücken, indem sie Empfehlungen aussprechen und für Kontinuität in der Versorgung sorgen.
Im Jahr 2010 wurden die Kosten für die Behandlung von Herzinsuffizienz (HF) in den Vereinigten Staaten auf 39,2 Milliarden US-Dollar geschätzt.1,2Fast 1 Million Patienten werden jedes Jahr wegen Exazerbationen ins Krankenhaus eingeliefert, und HF ist derzeit der häufigste Grund für Krankenhauseinweisungen bei Erwachsenen über 65 Jahren.2 Akute dekompensierte Herzinsuffizienz (ADHF) kann aus schlecht kontrollierter, chronischer HF und/oder kardialer, pulmonaler oder renaler Dysfunktion resultieren. Die stationären Kosten für die Versorgung dieser Patienten sind extrem hoch und machen etwa 60 % der gesamten HF-Ausgaben aus.3
Zusätzlich zu den finanziellen Auswirkungen der HF sind die Lebenserwartung und die Lebensqualität bei Patienten mit akuten Exazerbationen stark beeinträchtigt. Die Krankenhauseinweisung ist mit einem erhöhten Sterberisiko bei HF-Patienten verbunden; die Sterblichkeit tritt bei 15,5 % der Patienten auf, und ein Drittel der Patienten wird nie aus dem Krankenhaus entlassen.2 ADHF ist eine lähmende Krankheit, die nicht nur die Patienten, sondern auch das Gesundheitssystem belastet.
Die Pharmakotherapie von ADHF ist ein Schlachtfeld für Krankenhäuser, die versuchen, die Kosten in einer Ära von reduzierten Zahlungen und erhöhten Ausgaben zu kontrollieren. Im Oktober 2012 begannen die Centers for Medicare and Medicaid (CMS) damit, die Erstattungen für Krankenhäuser mit hohen Raten von Patienteneinweisungen in drei kostenintensiven Krankheitszuständen zu kürzen: Myokardinfarkt (MI), Lungenentzündung und HF. Wenn Patienten mit diesen Erkrankungen innerhalb von 30 Tagen wiedereingewiesen werden, wird das CMS die Gesamtvergütung jährlich um 1 % kürzen, bis zu einer maximalen Kürzung von 3 % im Jahr 2014.4 Schon bald wird der finanzielle Verlust die fast 2.000 Krankenhäuser, die die höchsten Strafen erleiden, dazu motivieren, neue Richtlinien und eine Nachsorge für Patienten einzuführen, die mit einer HF-Diagnose entlassen werden.
Erfreulicherweise hat eine Analyse des CMS aus dem Jahr 2011 gezeigt, dass die Rate der HF-Aufnahmen über einen Zeitraum von 10 Jahren tatsächlich gesunken ist.1 Im Jahr 2008 gab es 229.000 weniger Einweisungen als angesichts der beobachteten Trends der letzten Jahrzehnte erwartet.1,5Die Forscher führten diesen Rückgang auf „die Verringerung der Inzidenz der koronaren Herzkrankheit, die verbesserte Kontrolle des Blutdrucks, den verstärkten Einsatz evidenzbasierter Therapien und möglicherweise auf Änderungen der Einweisungsschwellen zurück.“ Die 1-Jahres-Gesamtmortalitätsrate blieb jedoch mit ca. 30 % für Patienten, die aufgrund von HF ins Krankenhaus eingeliefert wurden, hoch.1,5Schwarze Männer und bestimmte Regionen des Landes schnitten bei den Hospitalisierungsraten schlechter ab; die Forscher stellten die Hypothese auf, dass Unterschiede in der Zugänglichkeit oder Qualität der Versorgung zu dieser Ungleichheit beitragen könnten.1Die besten Ergebnisse (reduzierte Kosten und Wiedereinweisungsraten) werden bei einem multidisziplinären Ansatz gesehen, der Ärzte, Apotheker, Krankenschwestern, Ernährungsberater und Physiotherapeuten umfasst.6 Dieser Artikel ist ein kurzer Überblick über die Pharmakotherapie des ADHF mit einem zusätzlichen Blick auf pharmakoökonomische Überlegungen und Entlassungskontroversen.
Pathophysiologie
ADHF ist definiert als eine plötzliche Verschlechterung der HF-Symptome und wird in der Regel durch ein kardiogenes Lungenödem mit schneller Flüssigkeitsansammlung in der Lunge verursacht, kann aber auch ohne Lungenödem auftreten.7 Bluthochdruck, Ischämie und/oder Ventrikulardysfunktion verursachen eine Abnahme des Herzzeitvolumens, was zu einer Aktivierung des neurohormonellen Weges führt. Der Sympathikus erhöht Noradrenalin, um die periphere Perfusion durch Vasokonstriktion zu verbessern, und aktiviert das Renin-Angiotensin-Aldosteron-System, um die renale Perfusion durch Wasserretention zu erhöhen.8 Ein akuter Anstieg des linksventrikulären Füllungsdrucks führt zu einer Leckage von Protein-Po-Flüssigkeit in die Lungenalveolen und das Interstitium, aber es kommt zu keiner Beeinträchtigung der pulmonalen Membranintegrität. Kompensatorische Mechanismen erhöhen die Herzfrequenz und den systemischen Gefäßwiderstand in dem Versuch, die Herzleistung zu verbessern, und es entsteht ein Teufelskreis.7,8
Zu den häufigen Ursachen von ADHF gehört eine linksventrikuläre oder diastolische Dysfunktion mit oder ohne koronare Herzkrankheit (KHK) oder Herzklappenanomalien. Obwohl die meisten Patienten, die mit ADHF ins Krankenhaus eingeliefert werden, eine Verschlimmerung der vorbestehenden HF haben, haben bis zu 20 % der Patienten keine vorherige Diagnose von HF.9
ADHF kann auch bei Patienten ohne vorbestehende Herzerkrankung auftreten, einschließlich Bedingungen wie schwerer Bluthochdruck, Flüssigkeitsüberlastung, schwere Nierenerkrankung oder Nierenarterienstenose. ADHF kann durch eine hypertensive Krise, einen Herzinfarkt oder eine Ischämie, eine Vorhofobstruktion, eine akute Mitralinsuffizienz, eine Flüssigkeitsüberlastung oder die Nichtanwendung von HF-Medikamenten ausgelöst werden. Bestimmte Medikamente, wie Betablocker, Nicht-Dihydropyridin-Kalziumkanalblocker und nichtsteroidale Antirheumatika (NSAIDs), können ebenfalls eineADHF auslösen.7,10

Klassifikation
ADHF kann in hämodynamische Stadien eingeteilt werden, die vom kardialen Index und dem pulmonalen kapillaren Wedge-Druck abhängen. Die Stadien werden als hämodynamische Untergruppen nach Forrester klassifiziert (TABELLE 1).11Der kardiale Index (CI) gibt den Grad der Perfusion an; je nach Vorhandensein der Hypoperfusion werden die Patienten als „warm“ oder „kalt“ charakterisiert. Ein CI von <2,2 L/min/m2 gewährleistet eine Klassifizierung von „kalt“, was auf eine Hypoperfusion hinweist. Zu den Anzeichen und Symptomen, die mit einer Hypoperfusion einhergehen, gehören Müdigkeit, Hypotonie, kalte Extremitäten, verminderte Nierenfunktion und veränderter mentaler Status.Der pulmonale kapillare Druck (PCWP) zeigt den Flüssigkeitsstatus an; Patienten werden entweder als „trocken“ oder „feucht“ klassifiziert, abhängig vom Vorhandensein eines Ödems, das als PCWP >18 mmHg definiert ist. Zu den Anzeichen und Symptomen einer Volumenüberlastung gehören Husten, Dyspnoe, paroxysmale nächtliche Dyspnoe, erhöhter Jugularvenendruck, periphere Ödeme, Aszites, Hepatomegalie und Splenomegalie.
Die häufigste Form, die zwei Drittel der ADHF-Aufnahmen ausmacht, ist Subset II (warm und feucht).8 Im Vergleich zu Subset I (warm und trocken) erhöht Subset IV (kalt und feucht) die Sterberate um das Zweieinhalbfache.12Drei wichtige Laborparameter weisen laut der ADHERE-Studie (Acute Decompensated Heart Failure NationalRegistry) auf ein erhöhtes Sterberisiko hin: ein Blutharnstoff-Stickstoff von ≥43 g/dL, ein systolischer Blutdruck <115 mmHg und/oder ein Serumkreatinin >2,75 mg/dL.13
Pharmakotherapie
Die pharmakologische Behandlung von ADHF richtet sich nach dem hämodynamischen Status des Patienten, der anhand von CI- und PCWP-Werten bewertet wird (TABELLE 1).11 Die Ziele und Medikamente für die Behandlung von ADHF sind in den TABELLEN 2 und 3 zusammengefasst.8,14-16Während sich der Behandlungsstandard in den letzten Jahren nicht wesentlich verändert hat, hat ein neuer Fokus auf die pharmakoökonomischen Auswirkungen von HF gezeigt, dass nicht alle Behandlungen gleich sind. Die Pharmakotherapie sollte auf der Grundlage der diagnostizierten Untergruppe ausgewählt werden, wobei entweder Flüssigkeitsüberlastung oder Hypoperfusion behandelt wird. Patienten im Subset IV haben sowohl eine Flüssigkeitsüberlastung als auch eine Perfusionsstörung und benötigen daher eine Therapie für beide Symptome.
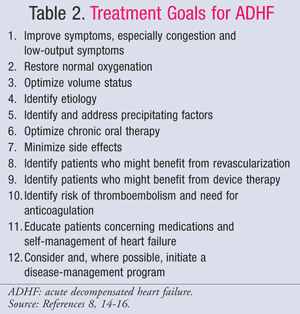
Subset II oder IV-Wet: Intravenöse (IV) Schleifendiuretika sind die Hauptstütze der ADHF-Behandlung für Patienten mit Flüssigkeitsüberladung (PCWP >18 mmHg), trotz widersprüchlicher Daten bezüglich des Nutzens für Mortalität und Morbidität. Eine Meta-Analyse von 14 kleinen Studien zeigte eine verringerte Sterblichkeit und Hospitalisierung bei mit Diuretika behandelten Patienten17; eine aktuelle Analyse von Beobachtungsdaten aus der ADHERE-Studie zeigte jedoch, dass mit IV-Diuretika behandelte hospitalisierte Patienten eine längere Gesamtverweildauer und eine längere Verweildauer auf der Intensivstation hatten.18 Unabhängig davon wird in den 2009 aktualisierten Leitlinien des American College of Cardiology/American HeartAssociation (ACC/AHA) zur Behandlung von HF die frühzeitige Verabreichung von IV-Diuretika empfohlen.14 Bolusdosen von Schleifendiuretika werden bevorzugt. Furosemid wird am häufigsten verwendet; Bumetanid und Torsemid sind jedoch ebenso wirksam. Wenn Patienten auf die maximal empfohlene Bolusdosis eines Schleifendiuretikums unzureichend ansprechen, kann die kontinuierliche Infusion von Furosemid mit 5 mg/h begonnen und bei Bedarf auf 20 mg/h titriert werden.14
Die Überlegenheit der Verabreichung von Furosemid als Dauerinfusion ist noch nicht erwiesen; die Diuretic Optimization StrategiesEvaluation (DOSE)-Studie, die 308 Krankenhauspatienten untersuchte, die randomisiert entweder Bolus- oder intravenöses Furosemid erhielten, zeigte keinen signifikanten Unterschied zwischen Sicherheits- und Wirksamkeitsendpunkten, aber kleinere Studien wiesen auf einen geringen Anstieg der Harnausscheidung bei kontinuierlicher Infusion hin.19 Die unkontrollierten Auswirkungen einer schnellen Diurese, wie z. B. Elektrolyt-Ungleichgewichte und Nierenfunktionsstörungen, können zu einem längeren Krankenhausaufenthalt über das Abklingen der ADHF-Symptome hinaus führen, so dass die Elektrolyte und das Serumkreatinin häufig überwacht werden sollten.
Eine weitere Strategie zur Erhöhung der Diurese ist die Zugabe eines zweiten Diuretikums mit einem anderen Wirkmechanismus wie Metolazon oder Spironolacton. Metolazon, ein Thiazid-ähnliches Diuretikum, wird am häufigsten zur akuten Volumenkontrolle eingesetzt; in der chronischen HF-Therapie werden jedoch Spironolacton und andere Saldosteron-Antagonisten bevorzugt.20-22
Bei Patienten mit anhaltendem Bluthochdruck und/oder persistierenden Symptomen trotz aggressiver Diurese kann ein Vasodilatator hinzugefügt werden, um die pulmonale Stauung zu reduzieren. Natriumnitroprussid, Nesiritid und intravenöses Nitroglyzerin sind venöse Vasodilatatoren, die Stauungssymptome durch Senkung des PCWP schnell lindern. Wenn ein Patient ein niedriges Herzzeitvolumen und einen hohen systemischen Gefäßwiderstand aufweist, werden venöse Vasodilatatoren oder Inotropika empfohlen, obwohl Vasodilatatoren die bevorzugte Therapie sind. Aufgrund des Risikos einer Zyanidtoxizität bei längerer, hochdosierter Infusion von Nitroprussid sind die bevorzugten Vasodilatatoren Nesiritid und Nitroglycerin. Von beiden führte Nesiritid in der VMAC-Studie (Vasodilation in the Management of Acute Congestive Heart Failure) zu einer größeren Verbesserung des globalen klinischen Status als Nitroglycerin, obwohl das Medikament zu Hypotonie neigt.13 Daher ist Nesiritid der bevorzugte Wirkstoff bei Patienten mit Flüssigkeitsüberladung und niedrigem Herzzeitvolumen.
Der Nutzen von Nesiritid wurde wegen seiner hohen Anschaffungskosten in Frage gestellt.23Klinische Ergebnisdaten fehlen, aber ein pharmakoökonomisches Modell zeigt, dass die hohen anfänglichen Kosten von Nesiritid durch die niedrigere Rate an Krankenhauswiederaufnahmen innerhalb von 21 Tagen im Vergleich zu Patienten, die Dobutamin erhielten, ausgeglichen werden.24 In ähnlicher Weise zeigte eine retrospektive Analyse der ADHERE-Daten, dass Patienten, die mit Nitroglycerin oder Nesiritid behandelt wurden, früher aus dem Krankenhaus entlassen wurden als Patienten, die mit Dobutamin oder Milrinon behandelt wurden, und auch ein geringeres Mortalitätsrisiko hatten.13 Da mehr kritisch kranke Patienten mit Dotropen behandelt wurden, ist es schwierig, die Inzidenz der erhöhten Sterblichkeit dem Medikament zuzuschreiben.
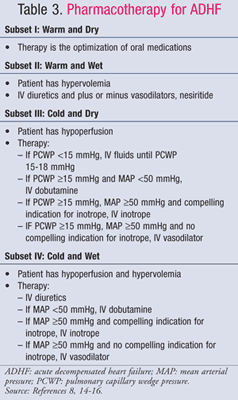
Subset III oder IV-Cold: Dobutamin und Milrinon sind die Inotropika der Wahl, um die Perfusion zu erhöhen und die Perfusion der Endorgane bei Patienten mit vermindertem Herzzeitvolumen zu erhalten.Zwingende Indikationen für Inotropika sind systolischer Blutdruck<90 mmHg, symptomatische Hypotonie trotz adäquater Füllungsdrücke (PCWP 15-18 mmHg), Verschlechterung der Nierenfunktion oder unzureichendes Ansprechen auf IV-Vasodilatatoren. Eine sorgfältige Auswahl der Patienten ist notwendig, da Daten darauf hindeuten, dass schlechte Ergebnisse auftreten, wenn Inotropika an Patienten mit erhaltenem Herzzeitvolumen verabreicht werden. Die OPTIME-CHF-Studie zeigte einen nicht signifikanten Anstieg der Mortalität und der Arrhythmien, wenn Milrinon-Infusionen den Patienten als Teil der Standardbehandlung verabreicht wurden.25 Milrinon sollte zur Behandlung von Patienten gewählt werden, die gleichzeitig Betablocker erhalten, da es über Phosphodiesterase-Hemmung eine Wirkung auf das Herzzeitvolumen und die systemische Gefäßresistenz ausübt, während Dobutamin ein abeta1-Agonist ist. Dobutamin ist jedoch die beste Wahl für hypotensive Patienten, da Milrinon einen signifikanten Blutdruckabfall verursachen kann.15
Entlassungsplanung
Der letzte Schritt in der Behandlung von ADHF ist die Entlassungsplanung und Nachsorge. Sowohl die ACC/AHA- als auch die Heart Failure Society of America (HFSA)-Leitlinien betonen die Bedeutung einer korrekten Entlassungsplanung.14,15 Zu den Grundpfeilern einer evidenzbasierten Entlassungsbehandlung gehören die Behandlung von exazerbierenden Faktoren, wie z. B. das Absetzen von Kalziumkanalblockern oder NSAIDs, das Erreichen eines optimalen Volumenzustands, die Optimierung der pharmakologischen Therapie und die Umstellung auf eine ambulante orale Therapie (TABELLE 4).15 Die ACC/AHA-Leitlinien empfehlen, Patienten und/oder Betreuern bei der Entlassung schriftliche Anweisungen oder Aufklärungsmaterial zu folgenden Themen zu geben: Aktivitätsniveau, Ernährung, Entlassungsmedikation, Nachsorgetermin, Gewichtskontrolle und was zu tun ist, wenn sich die Symptome verschlechtern.14Die Leitlinien weisen auch auf den Nutzen der Einleitung einer sterblichkeitssenkenden oralen Therapie für HF während der Krankenhausaufnahme hin, wie z. B. Angiotensin-Converting-Enzyme (ACE)-Hemmer und Beta-Blocker.26 Studien zeigen, dass eine leitlinienbasierte Versorgung die Sterblichkeit senkt, aber keine Verringerung der Wiederaufnahmeraten für Patienten mit HF zeigt.27,28

Entlassungsunterstützung, oder krankenhausbasiertes Fallmanagement, wird jetzt für die Entlassungsplanung eingesetzt. Entlassungsunterstützung ist ein multidisziplinärer, teambasierter Betreuungsansatz, der sich mit Medikationsunterstützung, Patientenaufklärung, Nachsorgeplanung und Informationskoordination beschäftigt. Eine Meta-Analyse von 18 randomisierten, kontrollierten Studien (RCT), die die Entlassungsplanung mit Post-Discharge-Support unter Einbeziehung von 3.304 Patienten analysierten, ergab eine signifikante Reduktion aller Wiederaufnahmen (relatives Risiko 0,75, 95% CI 0,68-0,88).29Die externe Validität der Meta-Analyse ist schwer zu bestimmen, könnte aber einige kosteneffektive Strategien anbieten. Eine Strategie stammt aus einerRCT mit 223 HF-Patienten, die die traditionelle Entlassungsunterstützung mit Aufklärungsmaterial mit einer einstündigen Einzelschulung durch eine Krankenschwester vor der Entlassung verglich.30 Die Krankenschwester-Interventionsgruppe hatte 180 Tage nach der Entlassung ein geringeres Risiko für eine erneute Krankenhauseinweisung oder den Tod und sparte schätzungsweise 2.823 $ pro Patient. Umgekehrt haben groß angelegte Beobachtungsstudien keinen Zusammenhang zwischen Patienten, die Aufklärungsmaterial erhalten haben, und einer geringeren Wiederaufnahmerate gefunden.26,31 Die aktuellen ACC/AHA-Richtlinien geben nicht explizit an, wie Patienten nach ADHF entlassen werden sollen, außer durch die Bereitstellung von Aufklärungsmaterial.14 Die Leitlinienempfehlungen geben möglicherweise keine Entlassungsprozeduren vor, die den Krankenhäusern helfen, die Erwartungen der CMS zu erfüllen.
Während Aufklärungsmaterialien bei der Entlassung keinen Nutzen für die Mortalität zeigten, kann jeder zusätzliche orale Wirkstoff, der zur Behandlung von ADHF eingesetzt wird, wie z. B. ein Betablocker oder Aldosteronantagonist, die Zahl der Krankenhausaufenthalte und/oder die Mortalität um 25 bis 35 % senken. Die ACC/AHA-Leitlinien weisen darauf hin, dass viele HF-Patienten entlassen werden, bevor ein optimaler Volumenzustand erreicht ist, oder nach Hause geschickt werden, ohne dass sie lebensrettende Therapien erhalten haben, was die schnelle Wiederaufnahme solcher Patienten begünstigt.14 Ein Krankenhausapotheker sollte im Entlassungsunterstützungsteam ein Fürsprecher für die Patienten sein, indem er bei der Medikamentenabstimmung hilft, kontraindizierte Medikamente absetzt und eine evidenzbasierte HF-Pharmakotherapie empfiehlt. Medikamente sollten so schnell wie möglich eingeleitet werden, idealerweise im Krankenhaus; die Einleitung dieser Medikamente kann HF-Symptome, die ADHF auslösen, verschlimmern, was die Bedeutung einer rechtzeitigen Nachsorge für diese Patientenpopulation weiter unterstreicht.
Fazit
ADHF ist eine Belastung für Patienten, Leistungserbringer im Gesundheitswesen und Kostenträger. Die Pharmakotherapie für ADHF hat sich in letzter Zeit nicht geändert, aber der Einsatz von Entlassungsunterstützungsteams und die schnelle Nachsorge nach der Entlassung bieten Möglichkeiten für die Intervention des Apothekers, sowohl innerhalb als auch außerhalb des Krankenhauses. Gemeindeapotheker können eine große Rolle in der Kontinuität der Versorgung spielen, indem sie Patienten beim Übergang vom Krankenhaus zur Primärversorgung unterstützen. Apotheker sind in der Lage, korrekte leitlinienbasierte Empfehlungen zu geben, beim Medikamentenabgleich zu helfen und bei der Entlassung Aufklärung zu leisten. Mit den jüngsten Änderungen in der CMS-Vergütung müssen Apotheker eine größere Rolle bei der Behandlung dieser chronischen Erkrankung übernehmen.
1. Winslow R, Wang SS. Heart failure puts fewer in the hospital. Wall Street Journal. October 19, 2011. http://online.wsj.com/article/SB10001424052970203658804576639360226103584.html. Accessed September 1, 2012.
2. Lloyd-Jones D, Adams RJ, Brown TM, et al. Heart diseaseand stroke statistics-2010 update. A report from the American HeartAssociation. Circulation. 2010;121:e46-e215.
3. Michota FA Jr, Amin A. Bridging the gap between evidence and practice in acute decompensated heart failure management. J Hosp Med. 2008;3(suppl):S7-S15.
4. Rau J. Medicare to penalize 2,217 hospitals for excess readmissions. Kaiser Health News.August 13, 2012.www.kaiserhealthnews.org/Stories/2012/August/13/medicare-hospitals-readmissions-penalties.aspx.Accessed September 1, 2012.
5. Chen J, Normand ST, Wang Y, Krumholz HM. National and regional trends in heart failure hospitalization and mortality rates forMedicare beneficiaries, 1998-2008. JAMA. 2011;306:1669-1678.
6. Amin A. Who is managing acute decompensated heart failure? The need for a multidisciplinary approach. J Hosp Med. 2008;6(suppl):S1-S6.
7. Pinto DS, Lewis S. Pathophysiology of acute decompensated heart failure. In: Basow DS, ed. UpToDate. Waltham, MA: UpToDate; 2012.
8. Crouch MA, Didomenico RJ, Rodgers JE. Applyingconsensus guidelines in the management of acute decompensated heartfailure. ACPE Program #204-000-06-407-H01. Bethesda, MD: ASHP Advantage;2007.
9. Joseph SM, Cedars AM, Ewald GA, et al. Acute decompensated heart failure: contemporary medical management. Tex Heart Inst J. 2009;36:510-520.
10. Pinto DS, Lewis S. Evaluation of acute decompensated heart failure. In: Basow DS, ed. UpToDate. Waltham, MA: UpToDate; 2012.
11. Forrester JS, Diamond G, Chatterjee K, et al. Medicaltherapy of acute myocardial infarction by application of hemodynamicsubsets. N Engl J Med. 1976;295:1356-1362.
12. Nohria A, Mielniczuk LM, Stevenson LW. Bewertung und Überwachung von Patienten mit akuten Herzinsuffizienzsyndromen. Am J Cardiol. 2005;96:32G-40G.
13. Abraham WT, Adams KF, Fonarow GC, et al. In-hospitalmortality in patients with acute decompensated heart failure requiringintravenous vasoactive medications: an analysis from the AcuteDecompensated Heart Failure National Registry (ADHERE). J Am Coll Cardiol. 2005;46:57-64.
14. Hunt SA, Abraham WT, Chin MH, et al. 2009 focusedupdate incorporated into the ACC/AHA 2005 guidelines for the diagnosisand management of heart failure in adults: a report of the AmericanCollege of Cardiology Foundation/American Heart Association Task Forceon Practice Guidelines. Circulation. 2009;119;e391-e479.
15. Heart Failure Society of America. Evaluation andmanagement of patients with acute decompensated heart failure: HFSA 2010comprehensive heart failure practice guideline. J Card Fail. 2010;16:e134-e156.
16. Colucci W. Behandlung der akuten dekompensierten Herzinsuffizienz: Komponenten der Therapie. In: Basow DS, ed. UpToDate. Waltham, MA: UpToDate; 2012.
17. Faris R, Flather MD, Purcell H, et al. Diuretics for heart failure. Cochrane Database Syst Rev. 2012;(1):CD003838.
18. Gheorghiade M, Filippatos G. Reassessing treatment of acute heart failure syndromes: the ADHERE registry. Eur Heart J. 2005;7:813-819.
19. Felker GM, Lee KL, Bull DA, et al. Diuretische Strategien bei Patienten mit akuter dekompensierter Herzinsuffizienz. N Engl J Med. 2011;364:797-805.
20. Effectiveness of spironolactone added to anangiotensin-converting enzyme inhibitor and a loop diuretic for severechronic congestive heart failure (the Randomized Aldactone EvaluationStudy ). Am J Cardiol. 1996;78:902-907.
21. Pitt B, Remme W, Zannad F, et al. Eplerenone, aselective aldosterone blocker, in patients with left ventriculardysfunction after myocardial infarction. N Engl J Med. 2003;348:1309-1321.
22. Zannad F, McMurray JJ, Krum H, et al; EMPHASIS-HFStudy Group. Eplerenon bei Patienten mit systolischer Herzinsuffizienz und Mildsymptomen. N Engl J Med. 2011;364:11-21.
23. Gerhard T, Zineh I, Winterstein AG, Hartzema AG.Pharmacoeconomic modeling of nesiritide versus dobutamine fordecompensated heart failure. Pharmakotherapie. 2006;26:34-43.
24. Lissovoy G, Stier DM, Ciesla G, et al. Economicimplications of nesiritide versus dobutamine in the treatment ofpatients with acutely decompensated congestive heart failure. Am J Cardiol. 2003;92:631-633.
25. Cuffe MS, Califf RM, Adams KF Jr, et al. Short-terminal intravenous milrinone for acute exacerbation of heart failure: arandomized controlled trial. JAMA. 2002;287:1541-1547.
26. Kfoury AG, French TK, Horne BD, et al. Incrementalsurvival benefit with adherence to standardized heart failure coremeasures: a performance evaluation study of 2958 patients. J Card Fail. 2008;14:95-102.
27. Patterson ME, Hernandez AF, Hammill BG, et al. Processof care performance measures and long-term outcomes in patientshospitalized with heart failure. Med Care. 2010;48:210.
28. Fonarow GC, Abraham WT, Albert NM, et al. Associationbetween performance measures and clinical outcomes for patientshospitalized with heart failure. JAMA. 2007;297:61-70.
29. Phillips CO, Wright SM, Kern DE, et al. Comprehensivedischarge planning with postdischarge support for older patients withcongestive heart failure: a meta-analysis. JAMA. 2004;291:1358-1367.
30. Koelling TM, Johnson ML, Cody RJ, Aaronson KD.Discharge education improves clinical outcomes in patients with chronicheart failure. Circulation. 2005;111:179-185.
31. Jha AK, Orav EJ, Epstein AM. Öffentliche Berichterstattung über Entlassungsplanung und Raten von Wiedereinweisungen. N Engl J Med. 2009;361:2637-2645.