Karthish Manthiram träumt von einer elektrifizierten Zukunft. Der MIT-Chemieingenieur gehört zu einer wachsenden Gruppe von Forschern, die Möglichkeiten erkunden, wie die mit erneuerbaren Energien betriebene Elektrochemie fossile Brennstoffe als Grundlage der chemischen Industrie ersetzen könnte.
„Die allgemeine Vision ist es, über eine Zukunft nachzudenken, in der die chemische Produktion nur mit Kohlendioxid, Wasser und Stickstoff beginnt“, sagt Manthiram. Wenn wir mit diesen drei Rohstoffen beginnen und über erneuerbaren Strom verfügen, können wir uns vorstellen, Kohlendioxid als Quelle für Kohlenstoffatome, Wasser für Sauerstoff und Wasserstoff und Distickstoff als Quelle für Stickstoff zu verwenden und damit zu beginnen, relativ komplexe organische Moleküle zusammenzufügen“, sagt er.
In dieser zukünftigen Welt, von der wir träumen, könnten wir Ammoniak nur aus Luft, Wasser und erneuerbarem Strom herstellen
Hoch auf der Liste der Moleküle, die Elektrochemie-Forscher auf diese Weise herstellen wollen, steht Ammoniak. Als Hauptbestandteil von Kunstdünger werden jährlich etwa 175 Millionen Tonnen Ammoniak produziert. Aber die riesigen Mengen, in denen es hergestellt wird, und die energieintensive Art der Produktion bedeuten, dass Ammoniakanlagen etwa 2 % der globalen Energieproduktion verbrauchen und einen ähnlichen Anteil an den globalen Kohlendioxidemissionen produzieren.
Mit der schnell wachsenden Verfügbarkeit von erneuerbarem Strom sehen die Forscher einen alternativen Weg zu Ammoniak. ‚In dieser zukünftigen Welt, von der wir träumen, könnten wir Ammoniak nur aus Luft, Wasser und erneuerbarem Strom herstellen‘, sagt Manthiram.
In einem jungen Forschungsfeld, in dem frühe Behauptungen über die elektrochemische Ammoniakproduktion einer Überprüfung oft nicht standgehalten haben, könnte die Handvoll solider Ergebnisse über die Lithium-vermittelte Ammoniakproduktion die solide Grundlage bilden, auf der eine saubere Ammoniakzukunft aufgebaut werden kann.
Kopfzerbrechen
Die große Herausforderung bei der Ammoniaksynthese, egal ob elektrochemisch oder nicht, ist die Anforderung, den Stickstoff aus der Luft zu nehmen und ihn in zwei Teile zu spalten. Die Dreifachbindung, die die beiden Stickstoffatome zusammenhält, ist eine der stärksten bekannten Bindungen.
Seit einem Jahrhundert überwinden Ammoniakanlagen die Reaktionsscheu des Distickstoffs in einem zweistufigen Prozess. Im ersten Schritt, der Dampf-Methan-Reformierung, werden Wasser und Methan über einem Katalysator erhitzt, der den Austausch von Atompartnern fördert, wodurch ein Strom aus Kohlendioxid und Wasserstoff entsteht. Der Wasserstoff wird dann mit Stickstoff über einem Eisenkatalysator im Haber-Bosch-Verfahren umgesetzt, benannt nach den deutschen Chemikern Fritz Haber, der die Reaktion erfand, und Carl Bosch, der sie für die Industrie verfeinerte.
Ein großer Teil der Ungleichheit beim Zugang zu Nahrungsmitteln in der Welt ist darauf zurückzuführen, dass die Ammoniakproduktion zentralisiert ist
Was Haber entdeckte, war ein Weg, das Problem zu umgehen, bei den hohen Temperaturen, die zur Spaltung von Distickstoff benötigt werden, das Gleichgewicht für die Ammoniakbildung weit links liegt, sagt Ib Chorkendorff, Katalyseforscher an der Technischen Universität Dänemark und Direktor des Villum Center for the science of sustainable fuels and chemicals. Die große Erfindung von Haber war die Erkenntnis, dass man kein Ammoniak erhält, wenn man es nicht unter Druck setzt“, sagt Chorkendorff. Wenn man aus vier Molen Gas zwei macht, hilft der Druck sehr. Haber-Bosch-Anlagen laufen heute typischerweise bei Drücken von über 200 Atmosphären.
Das stöchiometrische Kohlendioxid, das bei der Reaktion entsteht, sowie die Kohlendioxidemissionen, die bei der Erzeugung der erforderlichen hohen Temperaturen und Drücke entstehen, sind ein zwingender Grund, nach einem alternativen Ansatz zu suchen. Aber selbst wenn Kohlendioxid kein Infrarot einfangendes Gas wäre, das zur globalen Erwärmung führt, hätten wir immer noch ein Problem mit dem Prozess“, sagt Manthiram. Die wirklich hohen Temperaturen und Drücke bedeuten, dass es einfach nicht möglich ist, diese Reaktion dezentral durchzuführen.‘
Die Kosten für den Bau von Hochdruckreaktoren kippen das wirtschaftliche Gleichgewicht stark in Richtung des Baus von sehr großen, zentralisierten Ammoniakanlagen. ‚Ein großer Teil der Ungleichheit beim Zugang zu Nahrungsmitteln in der Welt ist auf die Tatsache zurückzuführen, dass die Ammoniakproduktion zentralisiert ist‘, sagt Manthiram. In Afrika südlich der Sahara ist die Verteilungsinfrastruktur so schlecht, dass der Dünger am Ende das Zwei- bis Dreifache des internationalen Durchschnittspreises kostet. Das schränkt seinen Einsatz ein, was zu geringen Ernteerträgen, Hunger, geringerer Produktivität der Arbeitskräfte und niedrigeren Einkommen führt, was wiederum die Möglichkeit einschränkt, sich den Dünger zu leisten. Dies ist ein enormes Problem, das es zu lösen gilt.‘
Ammoniak aus Luft, Wasser und erneuerbarem Strom, bei Umgebungstemperaturen und -druck, könnte überall dort hergestellt werden, wo es benötigt wird.
Die Anziehungskraft der erneuerbaren Energien spüren
Forscher versuchen seit Jahrzehnten, grünere Alternativen zur Haber-Bosch-Reaktion zu finden. Der Unterschied dieses Mal ist der sich schnell verändernde Energiemarkt, sagt Doug MacFarlane, ein Chemiker an der Monash University, der das Australian Research Council Centre of Excellence for Electromaterials Science leitet. In den letzten 10 Jahren sind immer mehr und immer preiswertere erneuerbare Energien verfügbar geworden“, sagt MacFarlane. Seit 2010 sind die Preise für Solarenergie um 80 % und für Windenergie um 50 % gefallen, und es besteht die Aussicht auf weitere Preissenkungen.

Quelle: Mit freundlicher Genehmigung des Science and Technology Facilities Council
Siemens Energy Green Ammonia Demonstrator in Großbritannien testet Wasserspaltung und Haber-Bosch-Chemie
MacFarlanes Labor konzentrierte sich – wie viele elektrochemische Syntheselabore – zunächst auf die mit erneuerbaren Energien betriebene Wasserspaltungschemie, um einen Strom sauberen Wasserstoffs zu erzeugen, der als Ausgangsstoff oder Brennstoff verwendet werden kann. Die zweite Welle der Forschung konzentrierte sich auf die Reduzierung von Kohlendioxid, um Kohlenstoffemissionen in nützliche Produkte umzuwandeln, sagt er. Vor etwa sechs Jahren begannen wir zu erkennen, dass unsere Forschung eine dritte Perspektive hat, nämlich die Stickstoffreduzierung“, sagt MacFarlane. Es sind die gleichen Ideen, die gleiche Laborausrüstung, aber ein anderes Substrat und Zielprodukt. Statt Wasserstoff würde die Zelle einen Strom von Ammoniak erzeugen.
Die Ammoniakproduktion könnte weit über die Verwendung als Dünger hinausgehen. Sinkende Strompreise, angetrieben durch erneuerbare Energien, haben bereits zu einem Umdenken bei der traditionellen Dampfreformierung geführt (siehe Kasten Elektrische Reformierung unten). Länder wie Australien, die über Solar- und Windressourcen verfügen, die weit über den eigenen Bedarf hinausgehen, haben ein Auge auf elektrochemisch synthetisiertes Ammoniak geworfen – nicht nur für eine sauberere Düngemittelproduktion, sondern auch als grünen Treibstoff, der den Export erneuerbarer Energien ermöglichen könnte.
Im Mai 2020 veröffentlichten MacFarlane und seine Kollegen eine Roadmap, die den möglichen Weg zu einer grünen Ammoniakwirtschaft aufzeigt. Das Konzept der ersten Generation, das die konventionelle Ammoniakproduktion mit der Kohlenstoffabscheidung kombiniert, wird bereits von einem Ansatz der zweiten Generation abgelöst, bei dem der Wasserstoff für Haber-Bosch aus der mit erneuerbaren Energien betriebenen elektrochemischen Wasserspaltung und nicht aus der methanbetriebenen Dampfreformierung stammt.
Nach jahrzehntelanger Forschung ist die elektrochemische Wasserspaltung so weit fortgeschritten, dass Wasserspalter im industriellen Maßstab verfügbar sind, etwa von ITM-Power in Großbritannien und Siemens in Deutschland. Siemens hat das Konzept der Kombination von Wasserspaltung und Haber-Bosch bereits im Siemens Green Ammonia Demonstrator in Oxfordshire getestet. In der Pilbara-Region in Westaustralien – die eine der höchsten jährlichen Sonneneinstrahlungen der Welt aufweist – bereitet sich Yara Fertilisers ebenfalls auf die Umstellung vor. Diese Anlage produziert derzeit 5 % des weltweiten Ammoniaks.
Das Haupthindernis für eine breite Akzeptanz der Ammoniakproduktion der zweiten Generation sind nicht mehr die Kosten für erneuerbaren Strom, sagt MacFarlane. Das Hindernis sind die Kapitalkosten für die Elektrolysezellen“, sagt er. Die leistungsfähigsten Elektroden für die Wasserspaltung verwenden Edelmetalle.
Elektrische Reformierung
Der erste Schritt in der konventionellen Ammoniaksynthese ist die Erzeugung des Wasserstoffs, der mit Distickstoff zu Ammoniak kombiniert wird. Heute wird dieser Wasserstoff aus Methan über die Dampfreformierung gewonnen, angetrieben durch eine Reihe von Gasbrennern, die die katalysatorbeschichteten Rohre umgeben, in denen die Reaktion stattfindet.
Die Menge des Katalysators kann um eine Größenordnung reduziert werden
Die Dampfreformierung ist so endotherm, dass sie einen signifikanten Temperaturgradienten innerhalb des Rohrs erzeugt, der zur Ablagerung von Kohlenstoff auf der Katalysatoroberfläche und zur Verstopfung oder sogar zum Bruch des Rohrs führen kann.
Im Jahr 2019 zeigte Chorkendorff, dass die Reaktion durch ohmsches Heizen viel effektiver angetrieben werden kann. Lässt man einen elektrischen Strom durch das stählerne Dampfreformerrohr fließen, entsteht aufgrund des elektrischen Widerstands in situ Wärme. Wir erhalten einen sehr engen Kontakt zwischen der Heizquelle und dem Katalysator, wodurch alle Probleme des Wärmetransports beseitigt werden und wir überhaupt keinen Temperaturgradienten haben“, sagt Chorkendorff.
Abgesehen von der Vermeidung von Kohlenstoffablagerungen bietet die ohmsche Heizung viele Vorteile, fügt Chorkendorff hinzu. Das Anfahren einer Dampfreformierungsanlage dauert normalerweise etwa eine Woche, das ohmsch beheizte System dagegen etwa zwei Minuten. Die Menge des Katalysators kann um eine Größenordnung reduziert werden, die Größe der Anlage um zwei Größenordnungen“, sagt er. Früher machten die Stromkosten die ohmsche Heizung unerschwinglich – aber mit erneuerbaren Energien ist das nicht mehr der Fall, sagt Chorkendorff. Das Unternehmen, mit dem Chorkendorff die Forschung durchführte, arbeitet bereits an einer Pilotanlage und hat Pläne für die ohmsche Heizung, die weit über die Dampfreformierung hinausgehen, sagt er.
Kosten senken
Ein langfristiges Ziel von Chorkendorffs Labor war es, kostengünstigere Alternativen zu Platin- und Iridiumelektroden zu finden. Im Jahr 2005 zeigte das Team, dass Molybdänsulfid ein starker Elektrokatalysator für die Wasserstoff-Evolutionsreaktion ist. Es stellte sich heraus, dass der katalytisch aktive Teil von MoS2 entlang der Kanten des Katalysators liegt und nicht auf der flachen Oberfläche, was eine Menge Forschung zur Entwicklung von nanostrukturierten oder geschichteten MoS2-Materialien auslöste, die den Anteil der Kanten maximieren.
Wir wissen, dass ein OER-Katalysator ein Oxid sein muss und dass er bei extremen pH-Werten stabil sein muss
‚Wir haben uns viel mit der Wasserstoffentwicklung beschäftigt, aber wir betrachten das als gelöst – es gibt einige sehr gute Katalysatoren‘, sagt Chorkendorff. Das eigentliche Problem ist der Energieverlust durch die Sauerstoffentwicklung“, argumentiert er. Wasserspaltende Zellen produzieren Wasserstoff an der Kathode und Sauerstoff an der Anode (siehe Kasten Inzwischen, an der Anode unten). Ein geringer Wirkungsgrad auf der Seite der Sauerstoffentwicklungsreaktion (OER) des Wassersplitters macht den gesamten Prozess energie- und kostenintensiver im Betrieb. Heute laufen sie mit einem Wirkungsgrad von maximal 70 %, aber normalerweise nicht so hoch.‘
Trotz jahrelanger Arbeit lässt der Durchbruch des OER-Katalysators noch auf sich warten. ‚Es spricht nichts dagegen, dass wir ein Material finden, aber wir wissen, dass es eng wird – wir wissen, dass es ein Oxid sein muss und dass es entweder in einer starken Säure oder einer starken Lauge stabil sein muss‘, sagt Chorkendorff. Elektrolyseure werden bei dem einen oder anderen Extrem der pH-Skala betrieben, um die Effizienz zu maximieren, aber die aktivsten OER-Katalysatoren sind unter diesen Bedingungen nicht stabil genug für einen langfristigen praktischen Einsatz.
Ein Konzept, das von Daniel Nocera, damals am Massachusetts Institute of Technology in den USA, vorgestellt wurde, sind selbstheilende OER-Katalysatoren, die sich in-situ bilden und sich kontinuierlich aus Metallionen im Elektrolyten regenerieren. Noceras Elektrokatalysatoren funktionierten unter neutralen Bedingungen. Im Jahr 2019 demonstrierten MacFarlane und seine Kollegen einen selbstheilenden, in-situ generierten Mischmetalloxid-OER-Katalysator für stark saure Bedingungen.
An der Anode
Bei den meisten elektrochemischen Prozessen – der Herstellung von Wasserstoff oder Ammoniak oder der Reduktion von Kohlendioxid – richten sich alle Augen auf die Kathode. Die begleitende Reaktion an der Anode ist ein oxidativer Prozess, bei dem typischerweise Sauerstoff entsteht, ein harmloses Nebenprodukt des Hauptereignisses.
„Viele Menschen betrachten den Sauerstoff nur als Abfallprodukt“, sagt Chorkendorff. Aber es gibt potenziell wertvolle Anwendungen für das Gas. Ein Strom aus reinem Sauerstoff ist der Schlüssel zum Konzept der Oxyfuel-Kraftwerke, die das Problem der Kohlenstoffabscheidung umgehen, indem sie den Brennstoff in Sauerstoff statt in Luft verbrennen. Wenn man Biomasse in einem Kraftwerk mit diesem Sauerstoff verbrennt, erhält man einen viel höheren Anteil an Kohlendioxid“, sagt Chorkendorff.
Manthiram sieht auch einen Wert in der Anodenreaktion. ‚Wir haben an Methoden gearbeitet, mit denen man diesen Sauerstoff für chemische Synthesen nutzen kann, anstatt zu versuchen, zwei Sauerstoffatome zu kombinieren, um Dioxygen zu machen, was kinetisch schwierig zu machen ist.‘ Aus früheren Arbeiten wusste das Team, dass Manganoxid ein Katalysator ist, der Wasser oxidiert und dabei eine Mangan-Oxo-Spezies erzeugt. Was wäre, wenn wir das mit Hilfe eines Olefins abfangen könnten, um ein Epoxid herzustellen? fragt Manthiram. Es war eine reine Spekulation, aber irgendwie hat es funktioniert. Das Team hat gezeigt, dass es nicht nur Epoxide herstellen kann, sondern auch Sauerstoff in eine Kohlenstoff-Kohlenstoff-Bindung einfügen kann, um Lactone herzustellen. Das könnte den Wasserelektrolyseur ökonomisch sinnvoller machen“, sagt Manthiram. Es gibt keine Möglichkeit, den gesamten Wasserstoff der Welt auf diese Weise herzustellen – wir haben einen viel zu großen Bedarf an Wasserstoff – aber wir könnten etwas Wasserstoff herstellen, der wirklich billig ist, während wir gleichzeitig Lactone erzeugen, die in großen Mengen zu biologisch abbaubaren Kunststoffen verarbeitet werden, oder in großen Mengen Epoxide zur Herstellung von Ethylenglykol.
Unzuverlässige Quellen
Da die Wasserspaltung noch immer nicht perfektioniert ist und weiterhin auf die Haber-Bosch-Reaktion angewiesen ist, besteht die Hoffnung, dass die grüne Ammoniakproduktion der zweiten Generation ein Sprungbrett in Richtung des ultimativen Ziels ist, Ammoniak direkt mit elektrochemischen Mitteln zu produzieren. Anstatt Diwasserstoffgas zu erzeugen, könnten Wasserstoff- und Stickstoffatome in situ an der Kathode kombiniert werden, um Ammoniak herzustellen.
Die größte Herausforderung besteht darin, Wege zu finden, die Ammoniakproduktion gegenüber der Diwasserstoffbildung zu bevorzugen, erklärt Manthiram. Das Elektronenreservoir an der Kathode könnte mit zwei Protonen in der Lösung reagieren, um Wasserstoff zu bilden; oder stattdessen mit Stickstoff reagieren, um die Dreifachbindung zu brechen und ebenfalls sechs Protonen zu rekrutieren, um zwei Ammoniakmoleküle zu bilden“, sagt Manthiram.
In den letzten fünf Jahren erschienen eine Reihe von Veröffentlichungen, die zu zeigen schienen, dass Katalysatoren in der Lage sind, etwas Ammoniak in dem überwiegend aus Wasserstoff bestehenden Gasstrom an der Kathode zu erzeugen. In der Zwischenzeit testete MacFarlanes Labor die Idee, dass eine gute Möglichkeit, die Wasserstoffproduktion zu unterdrücken, darin bestünde, eine Hauptquelle für Protonen zu eliminieren – den Elektrolyten. Indem sie zu einem aprotischen ionischen Flüssigelektrolyten wechselten und dann nur die kontrollierte Menge an Wasser, Säure oder Base hinzufügten, zeigte das Team, dass sie die Ammoniakproduktion begünstigen konnten.
Praktisch jeder Katalysator wird dazu neigen, mehr Wasserstoff als Ammoniak zu erzeugen
‚Die aprotische Arbeit ist ziemlich agnostisch, was den Katalysator angeht, also war unser Ansatz immer, sie auf den besten Katalysator anzuwenden, den wir finden konnten‘, sagt MacFarlane. Wann immer eine Arbeit über einen neuen Katalysator veröffentlicht wurde, versuchten wir schnell, die Arbeit in der Literatur zu wiederholen und sie dann in unserer aprotischen Arbeit anzuwenden. In einigen frustrierenden Fällen haben wir es nach Gesprächen mit den beteiligten Autoren nie geschafft, einen Katalysator aus der Literatur dazu zu bringen, gut zu funktionieren. Am Ende wurden wir zu Experten darin, was nicht funktioniert.‘
Obwohl die Umwandlung von Stickstoff in Ammoniak sehr schwierig ist, ist es nur allzu leicht, Spuren von Ammoniak aus anderen Stickstoffquellen herzustellen. Die lange Liste möglicher Quellen von zufälligem Stickstoff umfasst die Elektrode oder Spuren von NO oder NO2 in der Stickstoffgasversorgung. Wenn man diese Quellen ausschließt oder berücksichtigt, ist die Menge an Stickstoff, die von den meisten Katalysatorsystemen in Ammoniak umgewandelt wird, so gering, dass sie nicht von praktischem Interesse ist, sagt MacFarlane.
‚war ein großer Befürworter davon, herauszufinden, woher das Ammoniak tatsächlich kommt und ob der Katalysator wirklich die Arbeit macht‘, sagt Lauren Greenlee von der University of Arkansas in den USA, die als eine der ersten an der elektrokatalytischen Ammoniakproduktion gearbeitet hat und eine der ersten war, die darauf hinwies, dass zufälliges Ammoniak ein großes Problem darstellt. Die direkte Umwandlung von Distickstoff in zwei Ammoniakmoleküle auf der Oberfläche des Katalysators ist ein sehr schwieriges Problem, und ich weiß nicht, ob wir der Lösung so nahe sind.‘
Vorerst hat sich Greenlee von den Experimenten zur Ammoniakproduktion zurückgezogen, um mehr Grundlagenforschung zu diesem Problem zu betreiben. ‚Wir haben uns für die Chemie der Elektrolyte interessiert und arbeiten daran, die Chemie der Katalysatoroberfläche zu verstehen und wie sie sich mit diesen Elektrolyten verändert‘, sagt Greenlee. Ich verspreche nicht, dass wir Ammoniak herstellen können, aber hoffentlich werden wir viel über den Katalysator lernen und einen Beitrag zu diesem Gebiet leisten.‘
Blick auf Lithium
Neben Greenlee und MacFarlane hat auch Chorkendorff die strengen Kontrollexperimente durchgeführt, einschließlich der Verwendung von radioaktiv markiertem Distickstoff, die notwendig sind, um zu zeigen, dass das produzierte Ammoniak tatsächlich von Distickstoff stammt und nicht von einer alternativen Stickstoffquelle. Wir haben eine Methode veröffentlicht, weil ich es satt habe, mir all die Papiere anzusehen, in denen behauptet wird, dass sie Ammoniak produzieren, weil sie gar keines produzieren“, sagt Chorkendorff. Ich kenne nur ein System, das mit Sicherheit Ammoniak herstellt, und das ist die Lithium-vermittelte Route.‘
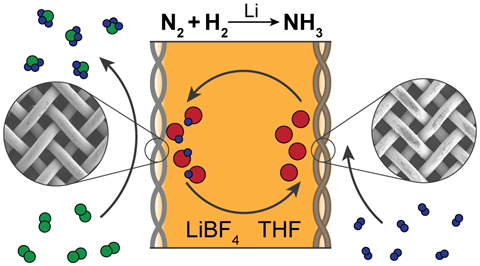
Quelle: © Nikifar Lazouski et al/Springer Nature Limited 2020
Lithium-basierte Katalysatoren scheinen das beste System zu sein, wie in diesem von der Gruppe von Karthish Manthiram am MIT entwickelten
Lithium ist das einzige Metall, das spontan mit Distickstoff reagieren kann, um ein Metallnitrid zu bilden – und dabei die Distickstoff-Dreifachbindung bricht. Die Fähigkeit von Lithium, Ammoniak zu erzeugen, wurde Mitte der 1990er Jahre von japanischen Forschern demonstriert – das einzige Protokoll, das Chorkendorff reproduzieren konnte.
Der Lithium-vermittelte Ansatz zu Ammoniak ist derzeit der einzige, der zweifelsfrei funktioniert, stimmt MacFarlane zu. Der Nachteil von Lithium ist, dass es mit einem hohen Energieaufwand verbunden ist, da eine Überspannung von mehr als 3 V erforderlich ist. Das ist eine Menge Energie, die in Form von Wärme verloren geht. Deshalb wurde es bisher nicht aufgegriffen und weiterentwickelt“, sagt MacFarlane.
Aber was für das Protokoll spricht, ist die Tatsache, dass es definitiv funktioniert – und es bietet viele Möglichkeiten für zukünftige Forschung. Der Lithium-vermittelte Ansatz ist im Moment unser Hauptansatz“, sagt MacFarlane. Eine offensichtliche Möglichkeit, das Energieproblem zu lösen, ist die Untersuchung anderer Metalle und ihrer Metallnitride, die diesen Prozess mit geringeren Energiekosten und einem weniger negativen Energiepotenzial durchführen würden“, sagt er.
In Chorkendorffs Labor liegt der Schwerpunkt darauf, zu verstehen, was Lithium überhaupt effektiv macht. ‚Wir finden vor allem heraus, was tatsächlich auf der Oberfläche sitzt, um diesen Prozess auszuführen. Wir nutzen das Synchrotron in Stanford und versuchen, ein Modell für diesen Prozess zu erstellen.‘
Vor ein paar Jahren waren die Raten so niedrig, dass wir nicht einmal wussten, ob wir Ammoniak herstellen
Manthiram hat unterdessen nach Möglichkeiten gesucht, das Problem anzugehen, Gase in einer elektrochemischen Zelle auf Flüssigkeitsbasis effizient zur Reaktion zu bringen. Wir haben gezeigt, wie man eine Gasdiffusionselektrode verwenden kann, um Stickstoffgas viel effektiver in den Reaktor einzuführen, Transportbeschränkungen zu überwinden und dadurch Ammoniak mit viel schnelleren Raten und höherer Selektivität für die Herstellung von Ammoniak gegenüber Wasserstoff herzustellen“, sagt er. Das Team erzielte eine Rekordausbeute an Ammoniak.
Bislang arbeitet der Gasdiffusionsreaktor nur über wenige Minuten und bei einem extremen Überpotential. ‚Sie erzwingen ihn gewissermaßen – aber trotz der Nachteile gefällt mir die Arbeit sehr gut‘, sagt Chorkendorff.
Das Team – und das Feld – hat noch viel Arbeit vor sich, um den Prozess in eine praktische Lösung für die Düngung von Pflanzen oder für die Speicherung und den Transport von erneuerbarer Energie zu verwandeln, sagt Manthiram. Aber wenn wir uns daran erinnern, wo wir auf diesem Gebiet vor ein paar Jahren standen, waren die Raten so niedrig, dass wir nicht einmal wussten, ob wir Ammoniak herstellen. Ich denke, unsere Arbeit zeigt, dass wir endlich an einem Punkt angelangt sind, an dem die Raten so hoch sind, dass man eigentlich kein Kontroll-Experiment mit markiertem Stickstoff durchführen muss, um zu zeigen, dass das Ammoniak echt ist. Es gibt einfach keine Möglichkeit, dass es bei diesen Konzentrationen zufälliges Ammoniak geben könnte.‘ Obwohl er sich beeilt hinzuzufügen, dass das Team immer noch Kontrollexperimente durchführt.
Für den Moment nimmt das Team das inhärente Überspannungsproblem von Lithium in Kauf. Wir haben uns damit abgefunden, diesen Preis zu zahlen, denn es gibt kein anderes System, das auch nur annähernd so gut funktioniert wie das, was wir mit Lithium erreicht haben“, sagt Manthiram. Es würde mich überraschen, wenn im nächsten Jahrzehnt nicht andere Methoden auftauchen würden, die diesen Preis nicht zahlen“, fügt er hinzu. Aber das ist der aktuelle Stand der Dinge.“
James Mitchell Crow ist Wissenschaftsautor in Melbourne, Australien