
Das aktuelle Modell der atomaren Struktur ist das quantenmechanische Modell. Die traditionelle Chemie beginnt mit der Untersuchung von Elementarteilchen, Atomen, Molekülen, Substanzen, Metallen, Kristallen und anderen Aggregaten der Materie. Materie kann in festen, flüssigen, gasförmigen und Plasmazuständen untersucht werden, isoliert oder in Kombination. Die Wechselwirkungen, Reaktionen und Umwandlungen, die in der Chemie untersucht werden, sind in der Regel das Ergebnis von Wechselwirkungen zwischen Atomen, die zu Umlagerungen der chemischen Bindungen führen, die die Atome zusammenhalten. Solche Verhaltensweisen werden in einem Chemielabor untersucht.
Das Chemielabor verwendet stereotypisch verschiedene Formen von Laborglasgeräten. Glasgeräte sind jedoch nicht zentral für die Chemie, und ein großer Teil der experimentellen (wie auch der angewandten/industriellen) Chemie wird ohne sie durchgeführt.

Eine chemische Reaktion ist eine Umwandlung einiger Substanzen in eine oder mehrere andere Substanzen. Die Grundlage einer solchen chemischen Umwandlung ist die Umordnung von Elektronen in den chemischen Bindungen zwischen den Atomen. Sie kann symbolisch durch eine chemische Gleichung dargestellt werden, die meist Atome als Subjekte enthält. Die Anzahl der Atome auf der linken und rechten Seite in der Gleichung für eine chemische Umwandlung ist gleich. (Wenn die Anzahl der Atome auf beiden Seiten ungleich ist, wird die Umwandlung als Kernreaktion oder radioaktiver Zerfall bezeichnet.) Die Art der chemischen Reaktionen, die eine Substanz durchlaufen kann, und die Energieänderungen, die damit einhergehen können, werden durch bestimmte Grundregeln eingeschränkt, die als chemische Gesetze bekannt sind.
Energie- und Entropiebetrachtungen sind in fast allen chemischen Studien unweigerlich wichtig. Chemische Substanzen werden in Bezug auf ihre Struktur, Phase sowie ihre chemische Zusammensetzung klassifiziert. Sie können mit den Werkzeugen der chemischen Analytik, z. B. der Spektroskopie und Chromatographie, analysiert werden. Wissenschaftler, die sich mit chemischer Forschung beschäftigen, werden als Chemiker bezeichnet. Die meisten Chemiker spezialisieren sich auf eine oder mehrere Teildisziplinen. Mehrere Konzepte sind für das Studium der Chemie wesentlich; einige von ihnen sind:
Materie
In der Chemie wird Materie als alles definiert, was Ruhemasse und Volumen hat (es nimmt Raum ein) und aus Teilchen besteht. Die Teilchen, aus denen Materie besteht, haben auch eine Ruhemasse – nicht alle Teilchen haben eine Ruhemasse, wie z. B. das Photon. Materie kann eine reine chemische Substanz oder ein Stoffgemisch sein.
Atom

Das Atom ist die Grundeinheit der Chemie. Es besteht aus einem dichten Kern, dem Atomkern, der von einem Raum umgeben ist, der von einer Elektronenwolke eingenommen wird. Der Kern besteht aus positiv geladenen Protonen und ungeladenen Neutronen (zusammen Nukleonen genannt), während die Elektronenwolke aus negativ geladenen Elektronen besteht, die den Kern umkreisen. In einem neutralen Atom gleichen die negativ geladenen Elektronen die positive Ladung der Protonen aus. Der Kern ist dicht; die Masse eines Nukleons ist etwa 1.836 mal so groß wie die eines Elektrons, der Radius eines Atoms ist jedoch etwa 10.000 mal so groß wie der seines Kerns.
Das Atom ist auch die kleinste Einheit, die die chemischen Eigenschaften des Elements beibehält, wie Elektronegativität, Ionisierungspotential, bevorzugte Oxidationsstufe(n), Koordinationszahl und bevorzugte Arten von Bindungen, die gebildet werden (z.B., metallisch, ionisch, kovalent).
Element
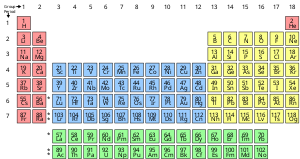
Ein chemisches Element ist ein reiner Stoff, der aus einer einzigen Atomart besteht, die durch eine bestimmte Anzahl von Protonen in den Atomkernen charakterisiert ist, die als Ordnungszahl bezeichnet und durch das Symbol Z dargestellt wird. Die Massenzahl ist die Summe der Anzahl von Protonen und Neutronen in einem Kern. Obwohl alle Kerne aller zu einem Element gehörenden Atome die gleiche Ordnungszahl haben, müssen sie nicht unbedingt die gleiche Massenzahl haben; Atome eines Elements, die unterschiedliche Massenzahlen haben, werden als Isotope bezeichnet. Zum Beispiel sind alle Atome mit 6 Protonen im Kern Atome des chemischen Elements Kohlenstoff, aber Atome des Kohlenstoffs können Massenzahlen von 12 oder 13 haben.
Die Standarddarstellung der chemischen Elemente ist das Periodensystem, das die Elemente nach ihrer Ordnungszahl ordnet. Das Periodensystem ist in Gruppen (Spalten) und Perioden (Zeilen) unterteilt. Das Periodensystem ist nützlich, um periodische Trends zu erkennen.
Verbindung

Hauptartikel: Chemische Verbindung
Eine Verbindung ist ein reiner chemischer Stoff, der aus mehr als einem Element besteht. Die Eigenschaften einer Verbindung haben wenig Ähnlichkeit mit denen ihrer Elemente. Die Standardnomenklatur von Verbindungen wird von der International Union of Pure and Applied Chemistry (IUPAC) festgelegt. Organische Verbindungen werden nach dem organischen Nomenklatursystem benannt. Die Namen für anorganische Verbindungen werden nach dem anorganischen Nomenklatursystem gebildet. Wenn eine Verbindung mehr als eine Komponente hat, dann werden sie in zwei Klassen eingeteilt, die elektropositiven und die elektronegativen Komponenten. Darüber hinaus hat der Chemical Abstracts Service eine Methode zur Indizierung von chemischen Substanzen entwickelt. In diesem Schema ist jede chemische Substanz durch eine Nummer identifizierbar, die CAS-Registrierungsnummer.
Molekül

Ein Molekül ist der kleinste unteilbare Teil einer reinen chemischen Substanz, der seine eigenen chemischen Eigenschaften hat, d.h. sein Potenzial, eine bestimmte Reihe von chemischen Reaktionen mit anderen Substanzen einzugehen. Diese Definition funktioniert jedoch nur für Stoffe, die aus Molekülen bestehen, was auf viele Stoffe nicht zutrifft (siehe unten). Moleküle sind typischerweise eine Reihe von Atomen, die durch kovalente Bindungen miteinander verbunden sind, so dass die Struktur elektrisch neutral ist und alle Valenzelektronen entweder in Bindungen oder in einsamen Paaren mit anderen Elektronen gepaart sind.
Damit existieren Moleküle als elektrisch neutrale Einheiten, im Gegensatz zu Ionen. Wenn diese Regel gebrochen wird und das „Molekül“ eine Ladung erhält, wird das Ergebnis manchmal als molekulares Ion oder polyatomares Ion bezeichnet. Die diskrete und getrennte Natur des molekularen Konzepts erfordert jedoch normalerweise, dass molekulare Ionen nur in gut getrennter Form vorliegen, wie z. B. ein gerichteter Strahl in einem Vakuum in einem Massenspektrometer. Geladene polyatomare Ansammlungen, die sich in Festkörpern befinden (z. B. gewöhnliche Sulfat- oder Nitrat-Ionen), werden in der Chemie im Allgemeinen nicht als „Moleküle“ betrachtet. Einige Moleküle enthalten ein oder mehrere ungepaarte Elektronen, wodurch Radikale entstehen. Die meisten Radikale sind vergleichsweise reaktiv, aber einige, wie z. B. Stickstoffmonoxid (NO), können stabil sein.

Die „inerten“ oder Edelgaselemente (Helium, Neon, Argon, Krypton, Xenon und Radon) bestehen aus Einzelatomen als kleinste diskrete Einheit, aber die anderen isolierten chemischen Elemente bestehen entweder aus Molekülen oder aus Netzwerken von Atomen, die auf irgendeine Weise miteinander verbunden sind. Identifizierbare Moleküle bilden bekannte Substanzen wie Wasser, Luft und viele organische Verbindungen wie Alkohol, Zucker, Benzin und die verschiedenen Pharmazeutika.
Allerdings bestehen nicht alle Substanzen oder chemischen Verbindungen aus diskreten Molekülen, und in der Tat sind die meisten festen Substanzen, aus denen die feste Kruste, der Mantel und der Kern der Erde bestehen, chemische Verbindungen ohne Moleküle. Diese anderen Arten von Substanzen, wie z. B. ionische Verbindungen und Netzwerkfeststoffe, sind so organisiert, dass es keine identifizierbaren Moleküle an sich gibt. Stattdessen werden diese Substanzen in Form von Formeleinheiten oder Einheitszellen als kleinste sich wiederholende Struktur innerhalb der Substanz diskutiert. Beispiele für solche Substanzen sind Mineralsalze (z. B. Kochsalz), Feststoffe wie Kohlenstoff und Diamant, Metalle und die bekannten Kieselsäure- und Silikatminerale wie Quarz und Granit.
Eines der Hauptmerkmale eines Moleküls ist seine Geometrie, die oft als Struktur bezeichnet wird. Während die Struktur von zwei-, drei- oder vieratomigen Molekülen trivial sein kann (linear, winkelpyramidal etc.), kann die Struktur von mehratomigen Molekülen, die aus mehr als sechs Atomen (mehrerer Elemente) bestehen, entscheidend für ihre chemische Natur sein.
Stoff und Gemisch






Beispiele für reine chemische Substanzen. Von links nach rechts: die Elemente Zinn (Sn) und Schwefel (S), Diamant (ein Allotrop des Kohlenstoffs), Saccharose (reiner Zucker) sowie Natriumchlorid (Salz) und Natriumbicarbonat (Backpulver), die beide ionische Verbindungen sind.
Ein chemischer Stoff ist eine Art von Materie mit einer bestimmten Zusammensetzung und einer Reihe von Eigenschaften. Eine Ansammlung von Stoffen wird als Gemisch bezeichnet. Beispiele für Gemische sind Luft und Legierungen.
Mol und Stoffmenge
Das Mol ist eine Maßeinheit, die eine Stoffmenge (auch chemische Menge genannt) angibt. Ein Mol ist so definiert, dass es genau 6,02214076×1023 Teilchen (Atome, Moleküle, Ionen oder Elektronen) enthält, wobei die Anzahl der Teilchen pro Mol als Avogadro-Konstante bezeichnet wird. Die molare Konzentration ist die Menge einer bestimmten Substanz pro Volumen einer Lösung und wird üblicherweise in mol/dm3 angegeben.
Phase

Diagramm, das die Beziehungen zwischen den Phasen und die Begriffe zur Beschreibung der Phasenwechsel zeigt.
Hauptartikel: Phase
Neben den spezifischen chemischen Eigenschaften, die verschiedene chemische Klassifizierungen unterscheiden, können Chemikalien in mehreren Phasen existieren. Größtenteils sind die chemischen Klassifizierungen unabhängig von diesen Bulk-Phasenklassifizierungen; einige exotischere Phasen sind jedoch mit bestimmten chemischen Eigenschaften unvereinbar. Eine Phase ist ein Satz von Zuständen eines chemischen Systems, die ähnliche strukturelle Eigenschaften über einen Bereich von Bedingungen, wie Druck oder Temperatur, aufweisen.
Physikalische Eigenschaften, wie Dichte und Brechungsindex, tendieren dazu, in für die Phase charakteristische Werte zu fallen. Die Phase der Materie wird durch den Phasenübergang definiert, d.h. wenn Energie, die in das System hineingegeben oder aus dem System herausgenommen wird, in die Umgestaltung der Struktur des Systems geht, anstatt die Volumenbedingungen zu verändern.
Manchmal kann die Unterscheidung zwischen Phasen kontinuierlich sein, anstatt eine diskrete Grenze zu haben‘ in diesem Fall wird die Materie als überkritischer Zustand betrachtet. Wenn drei Zustände aufgrund der Bedingungen zusammentreffen, wird dies als Tripelpunkt bezeichnet, und da dieser invariant ist, ist dies eine bequeme Art, eine Reihe von Bedingungen zu definieren.
Die bekanntesten Beispiele für Phasen sind Feststoffe, Flüssigkeiten und Gase. Viele Stoffe weisen mehrere feste Phasen auf. Zum Beispiel gibt es drei Phasen von festem Eisen (alpha, gamma und delta), die je nach Temperatur und Druck variieren. Ein Hauptunterschied zwischen den festen Phasen ist die Kristallstruktur bzw. die Anordnung der Atome. Eine weitere in der Chemie häufig anzutreffende Phase ist die wässrige Phase, die den Zustand von in wässriger Lösung (d.h. in Wasser) gelösten Substanzen bezeichnet.
Zu den weniger bekannten Phasen gehören Plasmen, Bose-Einstein-Kondensate und fermionische Kondensate sowie die paramagnetischen und ferromagnetischen Phasen magnetischer Materialien. Während es sich bei den meisten bekannten Phasen um dreidimensionale Systeme handelt, ist es auch möglich, Analoga in zweidimensionalen Systemen zu definieren, was wegen seiner Relevanz für Systeme in der Biologie Beachtung gefunden hat.
Bindung

Atome, die in Molekülen oder Kristallen aneinander haften, werden als miteinander verbunden bezeichnet. Eine chemische Bindung kann man sich als das mehrpolige Gleichgewicht zwischen den positiven Ladungen in den Kernen und den um sie schwingenden negativen Ladungen vorstellen. Mehr als einfache Anziehung und Abstoßung charakterisieren die Energien und Verteilungen die Verfügbarkeit eines Elektrons zur Bindung an ein anderes Atom.
Eine chemische Bindung kann eine kovalente Bindung, eine Ionenbindung, eine Wasserstoffbrückenbindung oder einfach aufgrund der Van-der-Waals-Kraft sein. Jeder dieser Arten von Bindungen wird ein bestimmtes Potential zugeschrieben. Diese Potentiale erzeugen die Wechselwirkungen, die die Atome in Molekülen oder Kristallen zusammenhalten. In vielen einfachen Verbindungen können die Valenzbindungstheorie, das Valenzschalen-Elektronenpaar-Abstoßungsmodell (VSEPR) und das Konzept der Oxidationszahl verwendet werden, um die molekulare Struktur und Zusammensetzung zu erklären.
Eine Ionenbindung entsteht, wenn ein Metall ein oder mehrere seiner Elektronen verliert und zu einem positiv geladenen Kation wird, und die Elektronen dann von dem Nichtmetallatom gewonnen werden und zu einem negativ geladenen Anion werden. Die beiden gegensätzlich geladenen Ionen ziehen sich gegenseitig an, und die Ionenbindung ist die elektrostatische Anziehungskraft zwischen ihnen. Zum Beispiel verliert Natrium (Na), ein Metall, ein Elektron, um ein Na+ Kation zu werden, während Chlor (Cl), ein Nicht-Metall, dieses Elektron gewinnt, um Cl- zu werden. Die Ionen werden durch elektrostatische Anziehung zusammengehalten, und es entsteht die Verbindung Natriumchlorid (NaCl), auch Kochsalz genannt.

Bei einer kovalenten Bindung teilen sich zwei Atome ein oder mehrere Valenzelektronenpaare: Die daraus resultierende elektrisch neutrale Gruppe von gebundenen Atomen wird als Molekül bezeichnet. Die Atome teilen sich die Valenzelektronen so, dass für jedes Atom eine Edelgas-Elektronenkonfiguration (acht Elektronen in der äußersten Schale) entsteht. Atome, die dazu neigen, sich so zu verbinden, dass sie jeweils acht Elektronen in ihrer Valenzschale haben, werden als Oktettregel bezeichnet. Einige Elemente wie Wasserstoff und Lithium benötigen jedoch nur zwei Elektronen in ihrer äußersten Schale, um diese stabile Konfiguration zu erreichen; man sagt, dass diese Atome der Duett-Regel folgen und auf diese Weise die Elektronenkonfiguration des Edelgases Helium erreichen, das zwei Elektronen in seiner äußeren Schale hat.
In ähnlicher Weise können Theorien aus der klassischen Physik verwendet werden, um viele ionische Strukturen vorherzusagen. Bei komplizierteren Verbindungen, wie z. B. Metallkomplexen, ist die Valenzbindungs-Theorie weniger anwendbar und alternative Ansätze, wie die Molekülorbital-Theorie, werden in der Regel verwendet. Siehe Diagramm zu elektronischen Orbitalen.
Energie
Im Kontext der Chemie ist Energie eine Eigenschaft eines Stoffes als Folge seiner atomaren, molekularen oder Aggregatstruktur. Da eine chemische Umwandlung mit einer Veränderung einer oder mehrerer dieser Strukturarten einhergeht, ist sie immer mit einer Energiezunahme oder -abnahme der beteiligten Stoffe verbunden. Ein Teil der Energie wird zwischen der Umgebung und den Reaktionspartnern in Form von Wärme oder Licht übertragen; daher können die Produkte einer Reaktion mehr oder weniger Energie haben als die Reaktionspartner.
Eine Reaktion wird als exergonisch bezeichnet, wenn der Endzustand auf der Energieskala niedriger ist als der Anfangszustand; bei endergonischen Reaktionen ist die Situation umgekehrt. Eine Reaktion heißt exotherm, wenn die Reaktion Wärme an die Umgebung abgibt; bei endothermen Reaktionen nimmt die Reaktion Wärme aus der Umgebung auf.
Chemische Reaktionen sind immer nur möglich, wenn die Reaktanten eine Energiebarriere, die Aktivierungsenergie, überwinden. Die Geschwindigkeit einer chemischen Reaktion (bei gegebener Temperatur T) ist mit der Aktivierungsenergie E, durch den Boltzmannschen Besetzungsfaktor e – E / k T {\displaystyle e^{-E/kT}}

– das ist die Wahrscheinlichkeit eines Moleküls, bei der gegebenen Temperatur T eine Energie größer oder gleich E zu haben. Diese exponentielle Abhängigkeit einer Reaktionsgeschwindigkeit von der Temperatur ist als Arrhenius-Gleichung bekannt.Die für das Auftreten einer chemischen Reaktion notwendige Aktivierungsenergie kann in Form von Wärme, Licht, Elektrizität oder mechanischer Kraft in Form von Ultraschall vorliegen.
Das verwandte Konzept der freien Energie, das auch Überlegungen zur Entropie einbezieht, ist in der chemischen Thermodynamik ein sehr nützliches Mittel zur Vorhersage der Durchführbarkeit einer Reaktion und zur Bestimmung des Gleichgewichtszustands einer chemischen Reaktion. Eine Reaktion ist nur dann durchführbar, wenn die Gesamtänderung der freien Gibbs-Energie negativ ist, Δ G ≤ 0.

; wenn sie gleich Null ist, sagt man, dass sich die chemische Reaktion im Gleichgewicht befindet.
Es gibt nur begrenzt mögliche Energiezustände für Elektronen, Atome und Moleküle. Diese werden durch die Regeln der Quantenmechanik bestimmt, die eine Quantisierung der Energie eines gebundenen Systems erfordern. Die Atome/Moleküle, die sich in einem höheren Energiezustand befinden, werden als angeregt bezeichnet. Die Moleküle/Atome eines Stoffes in einem angeregten Energiezustand sind oft viel reaktiver, d.h. zugänglicher für chemische Reaktionen.
Die Phase eines Stoffes wird immer von seiner Energie und der Energie seiner Umgebung bestimmt. Wenn die zwischenmolekularen Kräfte eines Stoffes so groß sind, dass die Energie der Umgebung nicht ausreicht, um sie zu überwinden, liegt er in einer geordneteren Phase wie flüssig oder fest vor, wie es bei Wasser (H2O) der Fall ist; bei Raumtemperatur eine Flüssigkeit, weil seine Moleküle durch Wasserstoffbrücken gebunden sind. Wohingegen Schwefelwasserstoff (H2S) bei Raumtemperatur und Standarddruck ein Gas ist, da seine Moleküle durch schwächere Dipol-Dipol-Wechselwirkungen gebunden sind.
Die Übertragung von Energie von einem chemischen Stoff auf einen anderen hängt von der Größe der Energiequanten ab, die von einem Stoff abgegeben werden. Wärmeenergie wird jedoch oft leichter von fast jeder Substanz auf eine andere übertragen, weil die Phononen, die für Schwingungs- und Rotationsenergieniveaus in einer Substanz verantwortlich sind, viel weniger Energie haben als Photonen, die für die elektronische Energieübertragung herangezogen werden. Da also Schwingungs- und Rotationsenergieniveaus enger beieinander liegen als elektronische Energieniveaus, wird Wärme im Vergleich zu Licht oder anderen Formen von elektronischer Energie leichter zwischen Substanzen übertragen. So wird z. B. ultraviolette elektromagnetische Strahlung nicht so effektiv von einer Substanz auf eine andere übertragen wie thermische oder elektrische Energie.
Das Vorhandensein von charakteristischen Energieniveaus für verschiedene chemische Substanzen ist nützlich für deren Identifizierung durch die Analyse von Spektrallinien. In der chemischen Spektroskopie werden oft verschiedene Arten von Spektren verwendet, z.B. IR, Mikrowelle, NMR, ESR, etc. Die Spektroskopie wird auch verwendet, um die Zusammensetzung von weit entfernten Objekten – wie Sternen und fernen Galaxien – durch die Analyse ihrer Strahlungsspektren zu identifizieren.

Der Begriff chemische Energie wird oft verwendet, um das Potential einer chemischen Substanz zu bezeichnen, eine Umwandlung durch eine chemische Reaktion zu erfahren oder andere chemische Substanzen umzuwandeln.
Reaktion

Wenn sich ein chemischer Stoff durch die Wechselwirkung mit einem anderen Stoff oder mit Energie verändert, spricht man von einer chemischen Reaktion. Eine chemische Reaktion ist also ein Konzept, das sich auf die „Reaktion“ einer Substanz bezieht, wenn sie in engen Kontakt mit einer anderen kommt, sei es als Gemisch oder als Lösung; wenn sie einer Form von Energie ausgesetzt ist oder beides. Sie führt zu einem gewissen Energieaustausch zwischen den Bestandteilen der Reaktion sowie mit der Systemumgebung, die aus Gefäßen – oft Laborglas – bestehen kann.
Chemische Reaktionen können zur Bildung oder Dissoziation von Molekülen führen, d. h. Moleküle brechen auseinander, um zwei oder mehr Moleküle zu bilden, oder es kommt zu einer Neuanordnung von Atomen innerhalb oder zwischen Molekülen. Chemische Reaktionen beinhalten in der Regel das Herstellen oder Aufbrechen von chemischen Bindungen. Oxidation, Reduktion, Dissoziation, Säure-Base-Neutralisation und molekulare Umordnung sind einige der gebräuchlichsten Arten von chemischen Reaktionen.
Eine chemische Reaktion kann symbolisch durch eine chemische Gleichung dargestellt werden. Während bei einer nichtkernigen chemischen Reaktion die Anzahl und die Art der Atome auf beiden Seiten der Gleichung gleich sind, gilt dies bei einer Kernreaktion nur für die Kernteilchen, nämlich Protonen und Neutronen.
Die Schrittfolge, in der die Umordnung chemischer Bindungen im Verlauf einer chemischen Reaktion abläuft, nennt man ihren Mechanismus. Man kann sich vorstellen, dass eine chemische Reaktion in einer Reihe von Schritten abläuft, von denen jeder eine unterschiedliche Geschwindigkeit haben kann. So sind im Verlauf einer Reaktion viele Reaktionszwischenstufen mit unterschiedlicher Stabilität denkbar. Reaktionsmechanismen werden vorgeschlagen, um die Kinetik und den relativen Produktmix einer Reaktion zu erklären. Viele physikalische Chemiker haben sich darauf spezialisiert, die Mechanismen verschiedener chemischer Reaktionen zu erforschen und vorzuschlagen. Einige empirische Regeln, wie die Woodward-Hoffmann-Regeln, sind oft nützlich, wenn man einen Mechanismus für eine chemische Reaktion vorschlägt.
Nach dem IUPAC-Goldbuch ist eine chemische Reaktion „ein Prozess, der zu einer Umwandlung von chemischen Spezies führt.“ Dementsprechend kann eine chemische Reaktion eine Elementarreaktion oder eine stufenweise Reaktion sein. Ein zusätzlicher Vorbehalt besteht darin, dass diese Definition auch Fälle einschließt, in denen die Umwandlung von Konformeren experimentell beobachtbar ist. An solchen nachweisbaren chemischen Reaktionen sind normalerweise Gruppen von molekularen Einheiten im Sinne dieser Definition beteiligt, aber es ist oft konzeptionell bequem, den Begriff auch für Veränderungen zu verwenden, die einzelne molekulare Einheiten betreffen (d. h. „mikroskopische chemische Ereignisse“).
Ionen und Salze

Ein Ion ist eine geladene Spezies, ein Atom oder ein Molekül, das ein oder mehrere Elektronen verloren oder gewonnen hat. Wenn ein Atom ein Elektron verliert und somit mehr Protonen als Elektronen hat, ist das Atom ein positiv geladenes Ion oder Kation. Wenn ein Atom ein Elektron gewinnt und somit mehr Elektronen als Protonen hat, ist das Atom ein negativ geladenes Ion oder Anion. Kationen und Anionen können ein kristallines Gitter aus neutralen Salzen bilden, wie zum Beispiel die Na+ und Cl- Ionen, die Natriumchlorid oder NaCl bilden. Beispiele für mehratomige Ionen, die sich bei Säure-Base-Reaktionen nicht aufspalten, sind Hydroxid (OH-) und Phosphat (PO43-).
Plasma besteht aus gasförmiger Materie, die vollständig ionisiert wurde, meist durch hohe Temperatur.
Säure und Basizität

Hauptartikel: Säure-Base-Reaktion
Ein Stoff kann oft als Säure oder als Base klassifiziert werden. Es gibt mehrere verschiedene Theorien, die das Säure-Base-Verhalten erklären. Die einfachste ist die Arrhenius-Theorie, die besagt, dass eine Säure eine Substanz ist, die Hydronium-Ionen produziert, wenn sie in Wasser gelöst wird, und eine Base ist eine Substanz, die Hydroxid-Ionen produziert, wenn sie in Wasser gelöst wird. Nach der Brønsted-Lowry-Säure-Base-Theorie sind Säuren Substanzen, die in einer chemischen Reaktion ein positives Wasserstoff-Ion an eine andere Substanz abgeben; im weiteren Sinne ist eine Base die Substanz, die dieses Wasserstoff-Ion aufnimmt.
Eine dritte gängige Theorie ist die Lewis-Säure-Base-Theorie, die auf der Bildung neuer chemischer Bindungen beruht. Die Lewis-Theorie erklärt, dass eine Säure eine Substanz ist, die in der Lage ist, ein Elektronenpaar von einer anderen Substanz während des Prozesses der Bindungsbildung aufzunehmen, während eine Base eine Substanz ist, die ein Elektronenpaar zur Bildung einer neuen Bindung bereitstellen kann. Nach dieser Theorie sind die entscheidenden Dinge, die ausgetauscht werden, Ladungen. Es gibt noch mehrere andere Möglichkeiten, eine Substanz als Säure oder Base zu klassifizieren, wie die Geschichte dieses Konzepts zeigt.
Die Säurestärke wird üblicherweise mit zwei Methoden gemessen. Eine Messung, die auf der Arrhenius-Definition der Säurestärke basiert, ist der pH-Wert, der eine Messung der Hydroniumionenkonzentration in einer Lösung ist, die auf einer negativen logarithmischen Skala ausgedrückt wird. Daher haben Lösungen mit einem niedrigen pH-Wert eine hohe Hydroniumionenkonzentration und können als saurer bezeichnet werden. Das andere Maß, das auf der Brønsted-Lowry-Definition basiert, ist die Säuredissoziationskonstante (Ka), die die relative Fähigkeit einer Substanz misst, als Säure gemäß der Brønsted-Lowry-Definition einer Säure zu wirken. Das heißt, Substanzen mit einer höheren Ka spenden in chemischen Reaktionen eher Wasserstoffionen als solche mit niedrigeren Ka-Werten.
Redox
Redoxreaktionen (Reduktion-Oxidation) umfassen alle chemischen Reaktionen, bei denen Atome ihre Oxidationsstufe ändern, indem sie entweder Elektronen gewinnen (Reduktion) oder verlieren (Oxidation). Stoffe, die die Fähigkeit haben, andere Stoffe zu oxidieren, werden als oxidativ bezeichnet und sind als Oxidationsmittel, Oxidationsmittel oder Oxidationsmittel bekannt. Ein Oxidationsmittel entzieht einer anderen Substanz Elektronen. Umgekehrt werden Stoffe, die die Fähigkeit haben, andere Stoffe zu reduzieren, als Reduktionsmittel bezeichnet.
Ein Reduktionsmittel gibt Elektronen an einen anderen Stoff ab und wird somit selbst oxidiert. Und weil es Elektronen „spendet“, wird es auch als Elektronendonator bezeichnet. Oxidation und Reduktion beziehen sich korrekt auf eine Änderung der Oxidationszahl – eine tatsächliche Übertragung von Elektronen kann nie stattfinden. Daher ist die Oxidation besser definiert als eine Erhöhung der Oxidationszahl und die Reduktion als eine Verringerung der Oxidationszahl.
Gleichgewicht
Obwohl der Begriff des Gleichgewichts in allen Wissenschaften weit verbreitet ist, taucht er im Kontext der Chemie immer dann auf, wenn mehrere verschiedene Zustände der chemischen Zusammensetzung möglich sind, wie z. B. in einem Gemisch aus mehreren chemischen Verbindungen, die miteinander reagieren können, oder wenn ein Stoff in mehr als einer Art von Phase vorliegen kann.
Ein System von chemischen Stoffen im Gleichgewicht ist, obwohl es eine unveränderte Zusammensetzung hat, meist nicht statisch; Moleküle der Stoffe reagieren weiterhin miteinander, so dass ein dynamisches Gleichgewicht entsteht. Der Begriff beschreibt also den Zustand, in dem die Parameter wie die chemische Zusammensetzung über die Zeit unverändert bleiben.
Chemische Gesetze
Chemische Reaktionen unterliegen bestimmten Gesetzen, die zu grundlegenden Konzepten in der Chemie geworden sind. Einige von ihnen sind:
- Avogadrosches Gesetz
- Beer-Lambertsches Gesetz
- Boylesches Gesetz (1662, Zusammenhang zwischen Druck und Volumen)
- Charles’s law (1787, Zusammenhang zwischen Volumen und Temperatur)
- Fick’s laws of diffusion
- Gay-Lussac’s law (1809,
- Le Chatelier’s principle
- Henry’s law
- Hess’s law
- Der Energieerhaltungssatz führt zu den wichtigen Konzepten des Gleichgewichts, der Thermodynamik und der Kinetik.
- Der Satz von der Erhaltung der Masse bleibt auch in der modernen Physik in isolierten Systemen erhalten. Die spezielle Relativitätstheorie zeigt jedoch, dass aufgrund der Masse-Energie-Äquivalenz immer dann, wenn nicht-materielle „Energie“ (Wärme, Licht, kinetische Energie) aus einem nicht-isolierten System entfernt wird, ein Teil der Masse mit verloren geht. Hohe Energieverluste führen zum Verlust von wägbaren Mengen an Masse, ein wichtiges Thema in der Kernchemie.
- Gesetz der eindeutigen Zusammensetzung, obwohl in vielen Systemen (insbesondere Biomakromolekülen und Mineralien) die Verhältnisse dazu neigen, große Zahlen zu erfordern, und häufig als Bruch dargestellt werden.
- Gesetz der multiplen Proportionen
- Raoults Gesetz