Die Enolisierung oder Keto-Enol Tautomerie ist ein Prozess der Umwandlung eines Ketons oder eines Aldehyds in ein entsprechendes Enol (unter sauren Bedingungen) oder ein Enolat (unter basischen Bedingungen). Dieser Prozess kann auch bei Estern auftreten. Ich werde mich in diesem Beitrag jedoch auf Aldehyde und Ketone konzentrieren, um ihn nicht mit den Details und Nuancen zu überfrachten.
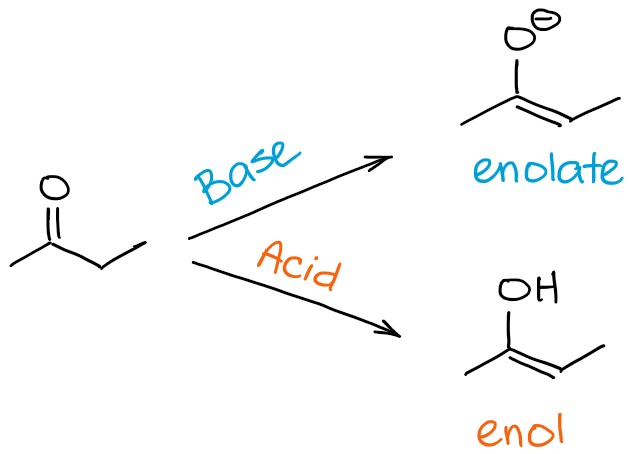
So, was ist der Unterschied zwischen einer Enolisierung und einer Keto-Enol-Tautomerisierung? Die kurze Antwort lautet: eigentlich keinen 😊
Wenn wir uns auf die Enolisierung beziehen, meinen wir speziell den Prozess, der Sie von einem Keton oder einem Aldehyd zu einem Enol oder einem Enolat führt. Wenn wir uns auf eine Keto-Enol-Tautomerisierung beziehen, meinen wir das Gleichgewicht im Allgemeinen. Wenn ich also sage, dass mein Molekül die Keto-Enol-Tautomerisierung durchläuft, kann ich die Richtung des Prozesses andeuten, aber ich weise im Allgemeinen nicht per se darauf hin. Die Richtung der Keto-Enol-Tautomerisierung kann jedoch oft aus dem Kontext der Reaktion abgeleitet werden.
Zusammenfassend gesagt, wenn Sie sagen, dass Molekül „A“ eine Enolisierung erfährt, bedeutet das, dass „A“ zu einem Enol oder einem Enolat wird. Wenn man sagt, dass ein Molekül „B“ eine Keto-Enol-Tautomerisierung durchläuft, kann es eine Enolisierung bedeuten, wenn B ein Carbonyl ist, oder es kann einen umgekehrten Prozess bedeuten, wenn B bereits ein Enol oder ein Enolat ist.
Basenkatalysierte Enolisierung
Während die Enolisierung sowohl unter basischen als auch unter sauren Bedingungen stattfinden kann, ist die basenkatalysierte Enolisierung die häufigere Art, diese Reaktion durchzuführen. Daher halte ich es für eine gute Idee, zuerst die Enolisierung unter basischen Bedingungen zu besprechen.
Unter basischen Bedingungen wirkt ein Keton oder ein Aldehyd als Brønsted-Säure, die ein Proton von einem α-Kohlenstoff an eine Base in der Lösung abgibt. Dieser Prozess ergibt ein resonanzstabilisiertes Enolat-Anion:

Da in diesem Gleichgewicht unser Carbonyl als Säure wirkt, muss es ausreichend sauer sein, um das Proton abzugeben. Alternativ muss die Base ausreichend stark sein, um dieses Gleichgewicht in Richtung des Produkts zu treiben.
Wie sauer sind die Wasserstoffatome an den α-Kohlenstoffen?
Das Enolat-Anion ist eine resonanzstabilisierte Spezies, daher spielt das Ausmaß der Resonanzstabilisierung eine sehr wichtige Rolle für die Säure von Carbonylverbindungen. Wir wissen, dass die konjugierte Base umso stabiler ist, je mehr Resonanzträger wir für sie gewinnen können. Und je stabiler die konjugierte Base ist, desto saurer ist die ursprüngliche Säure. So werden die Wasserstoffe zwischen zwei C=O-Bindungen deutlich saurer sein als die neben nur einem C=O.
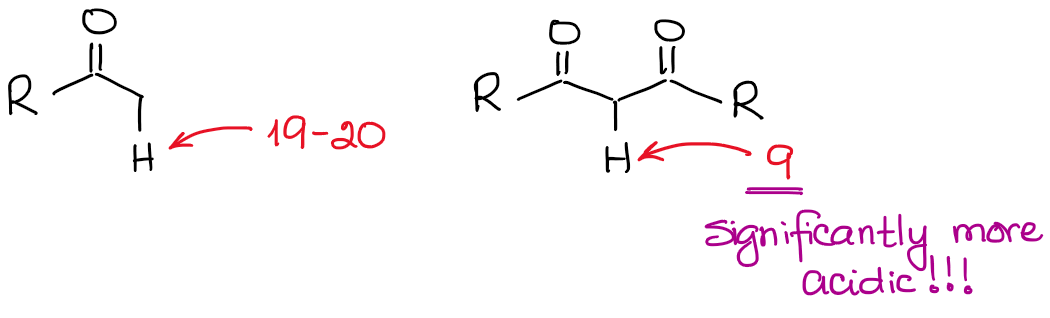
Wenn wir die konjugierten Basen in beiden Fällen vergleichen, werden wir sehen, dass das Dicarbonyl eine bessere Resonanzstabilisierung der negativen Ladung durch ein ausgedehnteres konjugiertes System hat.
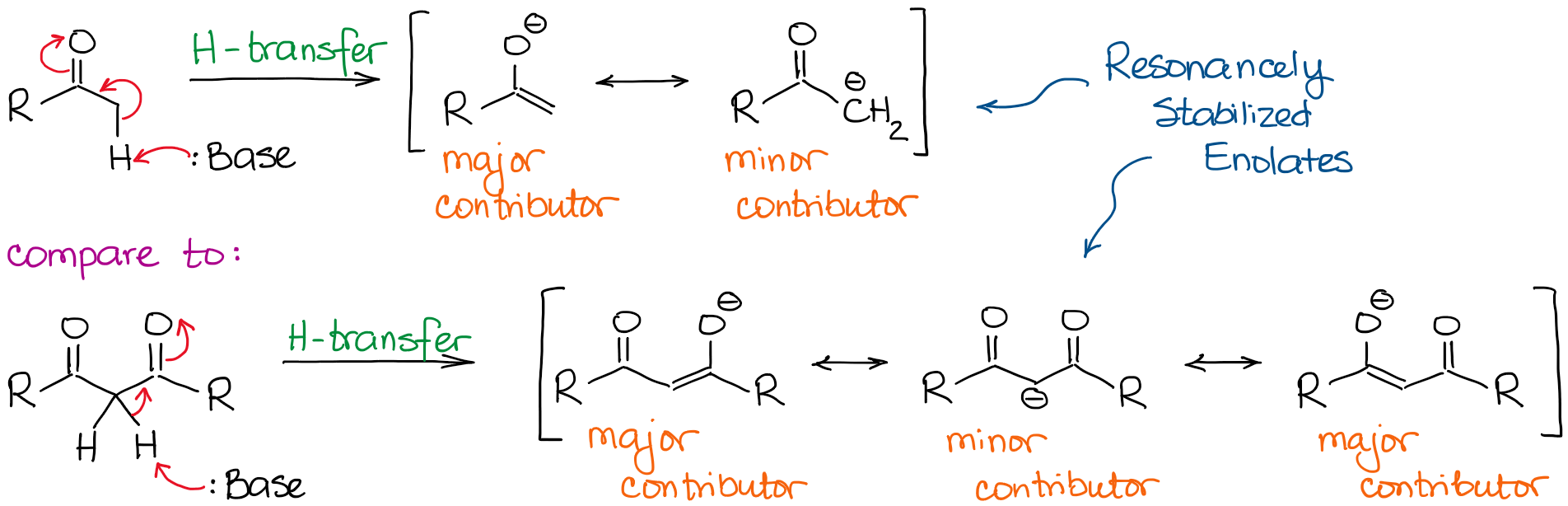
Ein zusätzlicher großer Resonanzbeitrag im Dicarbonyl-Anion macht das Molekül etwa 10000000000 mal saurer! Die Natur eines Ketons oder eines Aldehyds ist hier also ziemlich klar: Je mehr C=O-Bindungen neben einem Wasserstoff liegen, desto saurer wird es.
Einfluss einer Base auf das Enolisierungsgleichgewicht
Basen haben sehr unterschiedliche Stärken. Daher ist die Wahl einer Base wichtig, wenn Sie Ihr Gleichgewicht zum Abschluss bringen wollen. Schauen wir uns ein paar Basen an, die wir typischerweise in Reaktionen der organischen Chemie sehen:
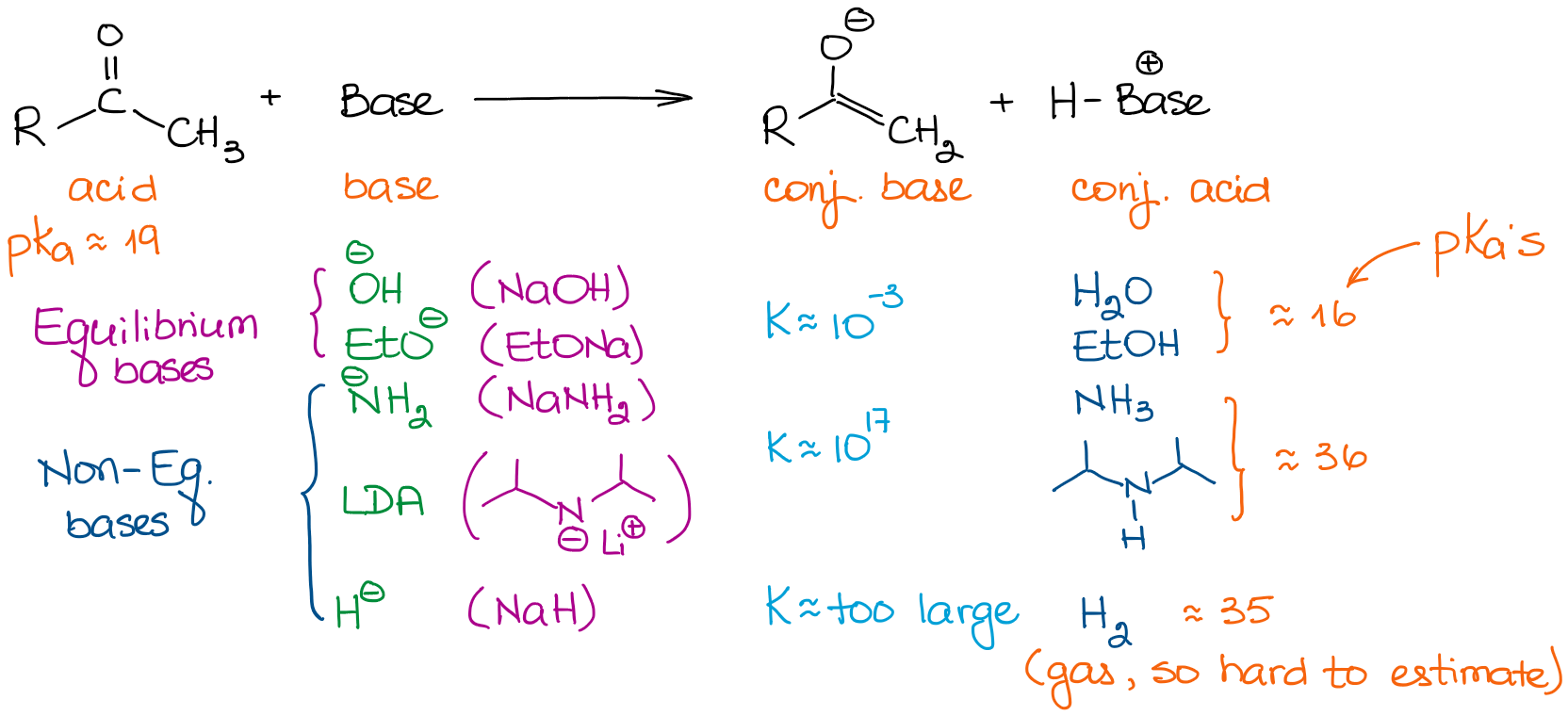
Wenn wir es mit den einfachen Aldehyden und Ketonen zu tun haben, können wir alle Basen in zwei Kategorien einteilen: Gleichgewichts- und Nicht-Gleichgewichtsbasen. Die Gleichgewichtsbasen sind relativ schwach. Das bedeutet, dass sie das Gleichgewicht nur in sehr geringem Maße antreiben können. Daher wird die tatsächliche Konzentration eines Enolats in der Lösung sehr klein sein. Die Reaktion wird auch in einem konstanten Gleichgewicht zwischen dem Ausgangsmaterial und einem Enolat ablaufen. Diese Basen begünstigen die Bildung von thermodynamisch stabileren Enolaten. Diese Enolate werden als thermodynamische Enolate bezeichnet.
Nicht-Gleichgewichtsbasen sind dagegen sehr stark. Dies führt zu einer Protonentransfer- (Säure-Base-) Reaktion mit sehr großen Gleichgewichtskonstanten. Wenn wir eine Gleichgewichtskonstante über 103 haben, ist das Gleichgewicht so gut wie vollständig in Richtung der Produkte verschoben. Eine Enolisierung mit einer Base wie LDA ergibt also praktisch eine 100%ige Enolisierung. Somit ist die Konzentration des anfänglichen Aldehyds oder Ketons praktisch Null.
Carbonyls mit einer C=O-Bindung vs. β-Dicarbonyls
Wie ich oben schon erwähnt habe, sind β-Dicarbonyls deutlich saurer als normale Aldehyde und Ketone. Betrachten wir die Gleichgewichtskonstante in den folgenden beiden Fällen:
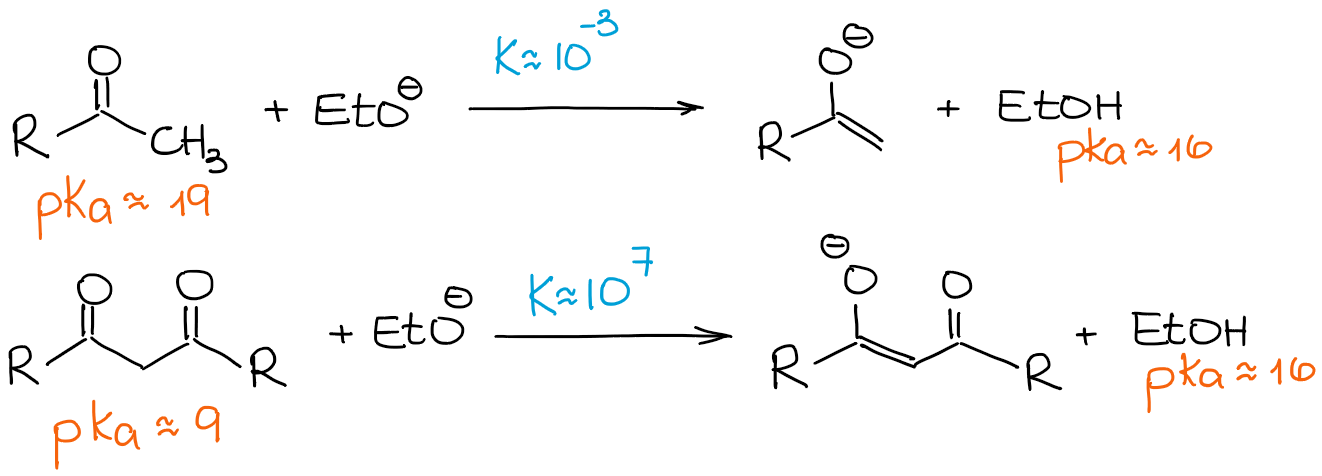
Da eine β-Dicarbonyl so viel saurer ist als ein normaler Aldehyd oder ein Keton, treibt sogar eine schwache Base das Gleichgewicht in Richtung der Produkte, die eine 100%ige Enolisierung ergeben. Wir werden also jede Enolisierungsreaktion des β-Dicarbonyls als einen Prozess mit 100% Enolat und 0% Ausgangsmaterial betrachten, unabhängig von einer Base.
Warum ist die Wahl einer Base wichtig?
Einige Reaktionen können sehr empfindlich darauf reagieren, was in der Lösung ist und wie die Konzentrationen der Reaktanten sind. Zum Beispiel sind Aldehyde elektrophil, während die Enolate nucleophil sind. Wenn ich also eine schwache Nicht-Gleichgewichtsbase verwende, die eine Menge des Ausgangsmaterials in der Lösung belässt, kann es zu einer unerwünschten Reaktion zwischen einem Enolat und einem Ausgangsaldehyd kommen. Im Allgemeinen werden die schwachen Gleichgewichtsbasen nur dann verwendet, wenn keine große Konkurrenz zwischen den möglichen Produkten zu erwarten ist. Wenn mehrere Reaktionen möglich sind und kein einzelnes Hauptprodukt das Gleichgewicht dominiert, werden wir immer starke Nicht-Gleichgewichtsbasen verwenden.
Große vs. kleine Basen
Die Größe einer Base kann ein entscheidender Faktor im Enolisierungsprozess sein, wenn mehrere enolisierbare Positionen in einem Molekül konkurrieren. Betrachten wir die Enolisierung von 2-Methylbutanon durch zwei starke Basen:
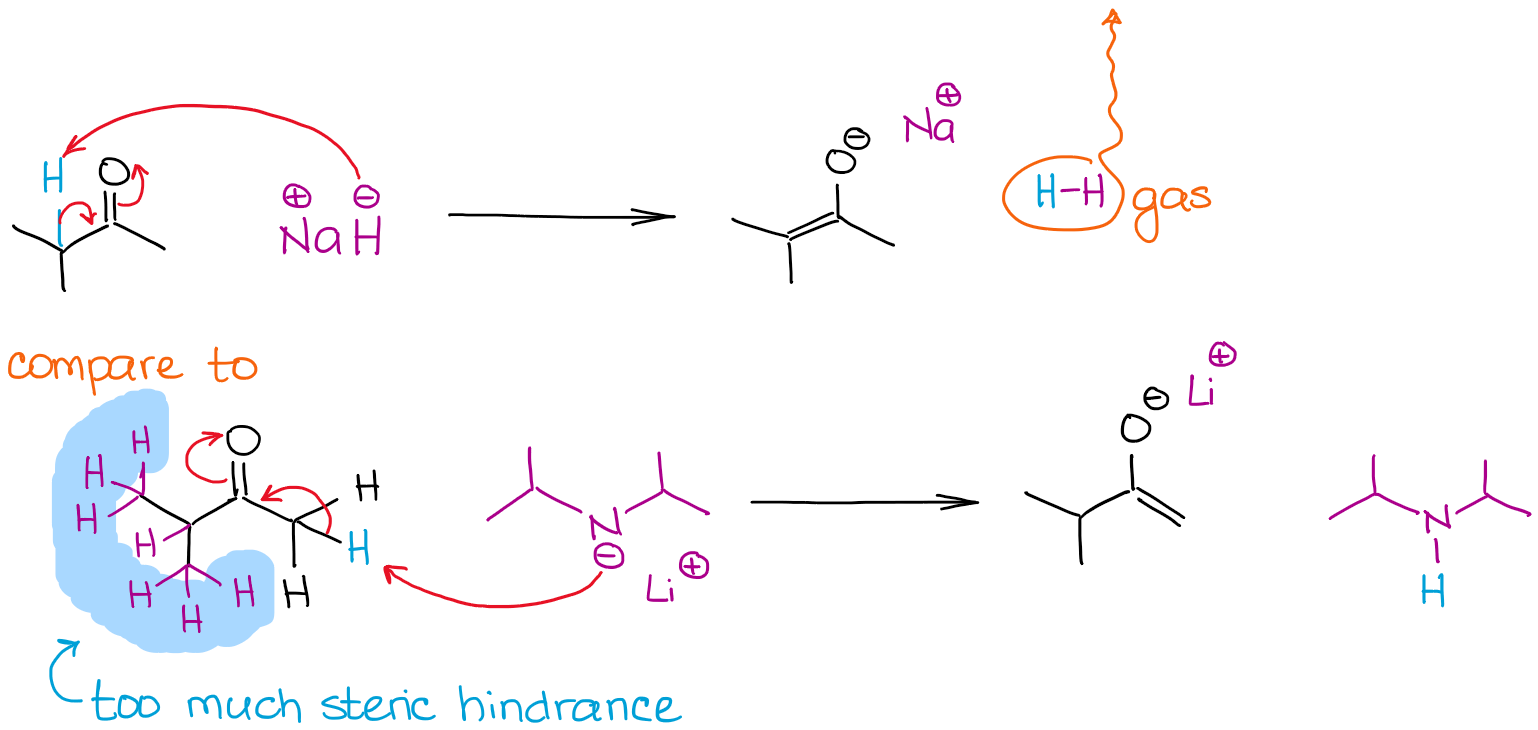
Beide Reaktionen ergeben eine 100%ige Enolisierung aufgrund der Verwendung von sehr starken Nicht-Gleichgewichtsbasen. Allerdings ergibt die Reaktion mit Natriumhydrid (NaH) ein thermodynamisch stabileres Enolat. Im Gegensatz zu LDA ist das Hydrid-Anion sehr klein, so dass es leicht ein sterisch gehindertes Proton erreichen und ein thermodynamisch stabileres Enolat ergeben kann. LDA ist sehr sperrig und daher sehr empfindlich gegenüber sterischen Hinderungsgründen. Das bedeutet, dass es sich weniger sterisch gehinderte und leichter zugängliche enolisierbare Wasserstoffe sucht.
Das thermodynamisch weniger stabile Enolat wie in der Reaktion mit LDA nennen wir ein kinetisches Enolat. Hier wird auch die Additionsreihenfolge der Reagenzien relevant. Um ein kinetisches Enolat zu erhalten, sollte man immer ein Carbonyl an die Base addieren, und nicht umgekehrt! Einige Dozenten sind da sehr pingelig, also denken Sie daran.
Thermodynamische vs. kinetische Enolate
Ich habe jetzt schon ein paar Mal thermodynamische und kinetische Enolate erwähnt, also denke ich, dass es eine gute Idee ist, diese ein wenig genauer zu besprechen.
Was genau zählt für die thermodynamische Stabilität eines Enolats?
Große Enolat-Resonanzträger haben eine negative Ladung am Sauerstoffatom und eine doppelte C=C-Bindung.
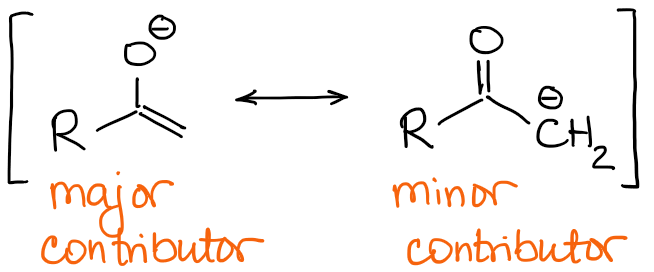
Der Hauptunterschied zwischen den Enolaten wird also die Art der Doppelbindung sein. Wenn wir auf das Beispiel mit 2-Methylbutanon von oben zurückblicken, können wir sehen, dass die beiden möglichen Enolate eine qualitativ unterschiedliche Doppelbindung haben:

Achten Sie immer auf die Anzahl der Substituenten an Ihrer Doppelbindung. Je mehr Substituenten Sie an einer Doppelbindung haben, desto stabiler ist sie. Das thermodynamische Enolat wird also immer die am meisten belegte Doppelbindung haben.
Ein kinetisches Enolat ist dasjenige, das sich schneller bildet. Denken Sie an die Reaktion mit LDA. LDA ist eine sehr starke Nicht-Gleichgewichtsbase. Sobald sie sich das Proton geschnappt hat, gibt sie es nicht mehr zurück. Es ist auch eine sehr sperrige Base und kann sich keinen Wasserstoff aus der Mitte des Moleküls schnappen. Also wird sie sich das holen, was sterisch leichter zugänglich ist. Eine Base wie LDA schnappt sich also schnell ein Proton, von einer sterisch weniger behinderten Stelle, und gibt es nicht zurück oder lässt das Gleichgewicht zu, was ein weniger stabiles Enolat ergibt.
Warum ist es wichtig, ein Carbonyl zu einer Base hinzuzufügen, um ein kinetisches Enolat herzustellen?
Wenn Sie ein kinetisches Enolat wollen, muss Ihre Base immer im Überschuss sein. Enolate sind selbst basisch! Wenn Sie also ein Carbonyl im Überschuss haben, dann kann das Enolat schnell ein Gleichgewicht mit ihr herstellen.
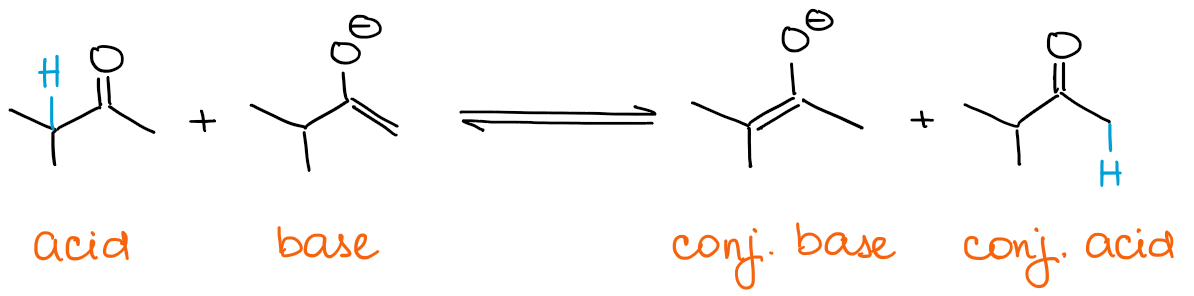
Ein Gleichgewicht wird immer die thermodynamisch stabilere Spezies bevorzugen. Das bedeutet, dass Sie immer ein thermodynamisches Enolat erhalten werden, wenn Sie einen Überschuss an einem Carbonyl und nicht an einer Base haben.
Denken Sie also daran:
Schwache und kleine starke Basen = thermodynamisches Enolat
Voluminöse starke Basen = kinetisches Enolat
Die Anwendung dieser einfachen Faustregel wird Ihnen dabei helfen, zu bestimmen, welches Enolat Sie in Ihrer Reaktion haben werden oder herstellen müssen.
Säurekatalysierte Enolisierung
Am Anfang dieses Beitrags habe ich erwähnt, dass die Enolisierung auch unter sauren Bedingungen möglich ist. Da Aldehyde und Ketone nicht besonders basisch sind, wollen Sie eine sehr starke Säure verwenden, um diesen Prozess zu katalysieren. Typischerweise verwendet man Schwefel- oder Tosylsäure als Katalysator.
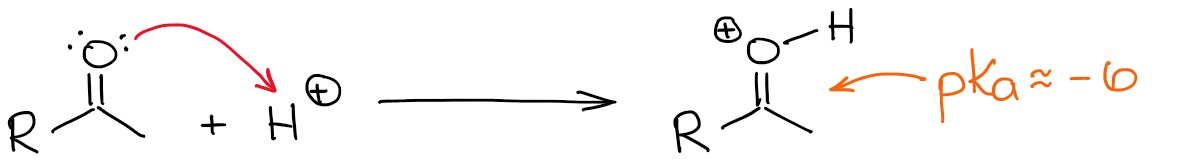
Der sauerste Wasserstoff in einem protonierten Carbonyl ist natürlich der am Sauerstoff. Wenn man jedoch eine C=O-Bindung durch Hinzufügen eines Protons stärker polarisiert, wird auch die α-Position saurer. So ist es nun etwas einfacher, die α-Position zu deprotonieren und ein Enol zu bilden.
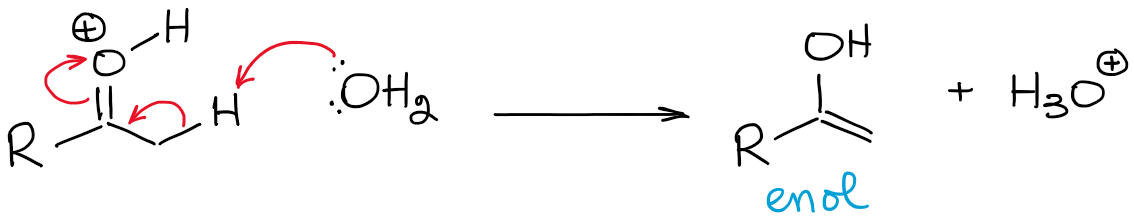
Dieses Gleichgewicht ist äußerst ungünstig und begünstigt das Carbonyl insgesamt. Daher wird man unter sauren Bedingungen niemals eine hohe Konzentration eines Enols haben, es sei denn, es gibt eine Art Stabilisierungseffekt, der das Enol begünstigt (was selten der Fall ist).
Während alle möglichen Enolprodukte gebildet werden können, wird diese Reaktion immer die Bildung eines thermodynamischen Enols begünstigen.
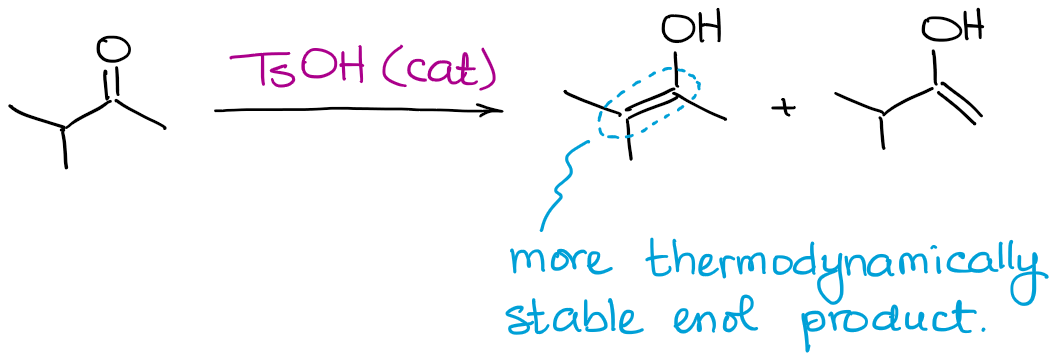
Genauso wie bei den Enolaten, ist ein thermodynamisches Enol dasjenige, das mehr Substituenten an der Doppelbindung hat.
Welche Faktoren beeinflussen die säurekatalysierte Enolisierung?
Alles, was ein Enol stabiler machen kann, hilft dem Gleichgewicht. Die häufigsten Faktoren sind die Wasserstoffbrückenbindungen und die erweiterte Konjugation.
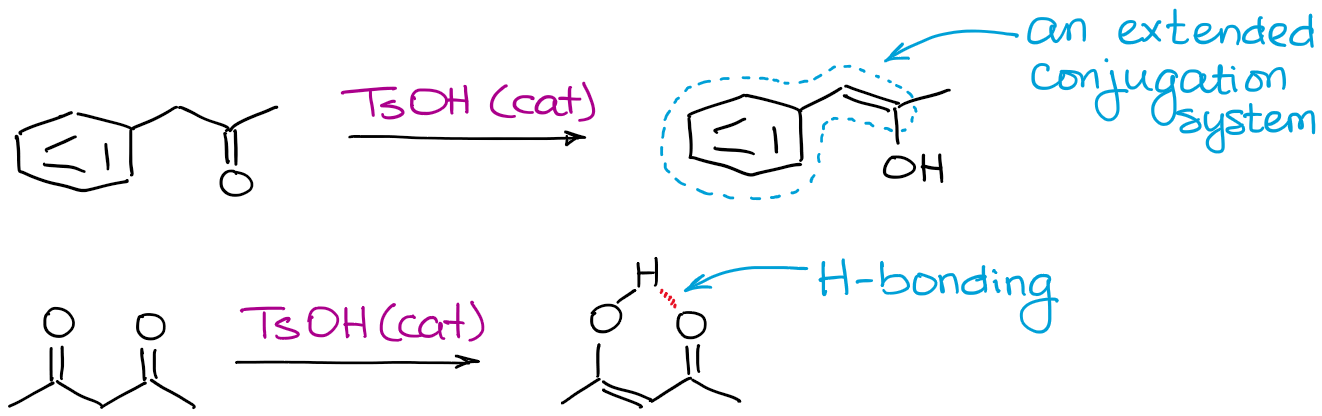
Warum sich die Mühe machen mit säure-katalysierten Enolisierung, wenn es so viele Probleme damit gibt?
Ihre Verbindung könnte empfindlich gegenüber Basen sein. Außerdem könnte es einfacher sein, mehrere Schritte zu kombinieren, wenn sie unter den gleichen Bedingungen stattfinden. Wir kombinieren oft die säurekatalysierte Enolisierung mit anderen Reaktionsschritten, die ebenfalls unter sauren Bedingungen ablaufen.
Sie müssen jedoch bedenken, dass elektronenziehende Gruppen in der Nähe eines Carbonyls dieses noch weniger basisch machen, als es ohnehin schon ist. Wenn Sie also z. B. ein Halogen in der α-Position haben, wird es sehr schwierig sein, die Bildung eines Enols zu erzwingen.

Überprüfen Sie immer auf EWG’s in der α-Position, bevor Sie eine Enolbildung vermuten! Jegliche EWGs, die keine Resonanzstabilisierung der Doppelbindung bieten, werden den Enolisierungsprozess erheblich erschweren.
Was ist in der Prüfung zu erwarten?
Professoren stellen selten Fragen, die direkt auf die Bildung von Enolen oder Enolaten abzielen. Fragen zur Enolisierung werden immer als etwas anderes getarnt sein. Enolisierungsfragen werden typischerweise wie folgt formuliert:
- Finden Sie den sauersten Wasserstoff im folgenden Molekül… oder
- Zeichnen Sie das Produkt… (die Reaktion wird ein Enol oder ein Enolat als Zwischenprodukt haben)
Natürlich können sie auch eine direkte Frage stellen. Meiner Erfahrung nach sind jedoch die Keto-Enol-Tautomerisierungen und Enolisierungen in der Regel das zugrunde liegende Konzept, das eine bestimmte Frage antreibt.