Protein des Monats
November 2006
Mehr zum PROTEIN dieses Monats |
|
Weitere Proteine von INTERESSANT |
|
Molekül des Monats: Fibrin |
|
ExPASy Protein Spotlight |
Blutgerinnung, oder Gerinnung, ist eine schnelle Reaktion auf eine Gewebeschädigung, bei der die Exposition von gewebefaktorhaltigen Zellen in den Blutkreislauf durch Schädigung der Gefäßwände ein schnelles Kaskadensystem in Gang setzt. Diese Enzymkaskade verwendet eine Reihe von Enzymen, die in schneller Abfolge arbeiten, um eine kleine Reaktion zu einer großen am Ort der Schädigung zu verstärken (siehe Abbildung 1). Einmal aktiviert, bindet und aktiviert der Tissue Factor (TF) den Faktor VII (FVII) und löst damit die Kaskade aus. TF/FVII wird durch Autospaltung zu TF/FVIIa aktiviert, das zusammen mit dem KofaktorFVIIIa FIX in FIXa umwandelt; FXa kann dann FX in FXa umwandeln, das zusammen mit dem Kofaktor FVa FII (Prothrombin) in FIIa (Thrombin) umwandelt; schließlich wandelt FIIacon Fibrinogen in Fibrin um, was zu Fibrinablagerungen und der Aktivierung von Thrombozyten zur Bildung von Blutgerinnseln führt. Die Aktivierung von FXIII zu FXIIIa kann diese Blutgerinnsel durch Quervernetzung stabilisieren.
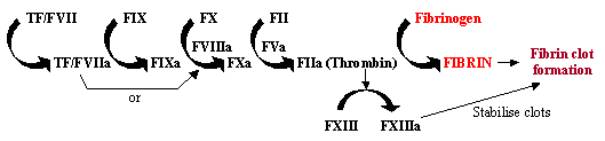
Abbildung 1. Blutgerinnungskaskade
Fibrinogen,Finishing the Coagulation Cascade
Fibrinogen wurde erstmals 1876 von Hammarsten aus Pferdeplasma isoliert, obwohl ein inaktiver Vorläufer des Fibrins bereits 1859 von Deni deCommercy vorgeschlagen wurde. Fibrinogen kann eine markierbare Umwandlung von löslichen Monomeren (Fibrogen) zu einem unlöslichen Polymergel (polymerisiertes Fibrin) durchlaufen.
Fibrinogen ist ein Plasmaglykoprotein, das in der Leber synthetisiert wird und für die Hämostase (Stoppen des Blutverlustes aus beschädigtem Gewebe), die Wundheilung, die Fibrinolyse, Entzündungen, die Angiogenese, zelluläre und Matrix-Interaktionen und Neoplasien wichtig ist. Diese Prozesse beinhalten die Umwandlung von Fibrinogen in Fibrin und oft auch die Interaktion von Fibrin(ogen) mit verschiedenen Proteinen und Zellen. Normalerweise hat der Mensch etwa 2,5 g Fibrinogen/L Blut, jedoch kann die Fibrinogenkonzentration in Zeiten physiologischen Stresses um bis zu 200-400 % ansteigen (hauptsächlich durch die Wirkung von Makrophagen-abgeleitetem Interleukin-6).
Fibrinogen ist ein großes, komplexes Glykoprotein, das aus drei Paaren von Polypeptiden besteht: zwei Aa, zwei Bb und zwei g. Diese Polypeptide sind durch 29 Disulfidbindungen miteinander verbunden, von denen einige in Abbildung 2 unten dargestellt sind. Die Polypeptide sind so ausgerichtet, dass sich alle sechs N-terminalen Enden treffen und die zentrale E-Domäne bilden. Auf beiden Seiten der E-Domäne erstrecken sich zwei Regionen von Coiled Coil Alpha-Helices, die jeweils aus einem Aa-, einem Bb- und einem g-Polypeptid bestehen. Jeder Coiled Coil-Bereich endet in einer globulären D-Domäne, die aus den C-terminalen Enden von Bb und g sowie einem Teil von Aa besteht. Das C-terminale Ende von Aa ragt dann als langer Strang aus jeder D-Domäne heraus; diese Aa-Ausstülpungen können bei der Fibringerinnsel-Vernetzung miteinander und mit der E-Domäne interagieren. Sowohl die E- als auch die D-Domäne enthalten wichtige Bindungsstellen für die Umwandlung von Fibrinogen in Fibrin, für die Fibrin-Assemblierung und -Vernetzung sowie für die Thrombozytenaggregation. Gebundene Kalziumionen sind wichtig für die Aufrechterhaltung der Struktur von Fibrinogen.
Die N-terminalen Enden sowohl des Aa- als auch des Bb-Polypeptids werden von Thrombin gespalten, um lösliches Fibrinogen in gelbildendes Fibrin zu verwandeln. Nach der Abspaltung vom Fibrinogen werden die N-terminalen Enden als Fibrinopeptid A (vom Aapolypeptid) und Fibrinopeptid B (vom Bbpolypeptid) bezeichnet.
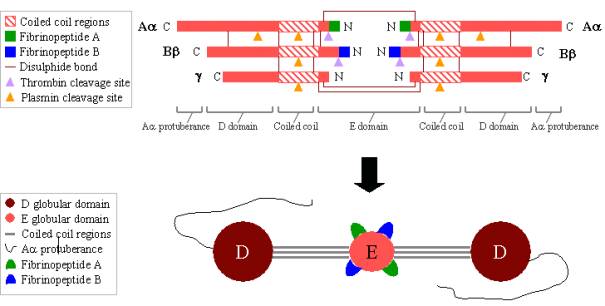
Abbildung 2. Fibrinogen:
Oben – Polypeptidorganisation von Fibrinogen.
Unten – Domänenorganisation von Fibrinogen.
Blutgerinnselbildung
Um ein Blutgerinnsel zu bilden, muss Fibrinogen zunächst durch Thrombin gespalten werden, um die Fibrinopeptide zu entfernen. Die Entfernung der Fibrinopeptide A und B von den N-terminalen Enden von Aa und Bb legt „Knöpfe“ auf der E-Domäne frei, die mit den „Löchern“ interagieren können, die immer auf den D-Domänen vorhanden sind. Fibrinmoleküle können sich durch die Interaktion der E-Domäne eines Fibrinmoleküls mit den D-Domänen von vier anderen Fibrinmolekülen miteinander verbinden und dadurch zu gestaffelten Oligomeren polymerisieren, die sich zu Protofibrillen aufbauen. Wenn die Fibrinoligomere aggregieren, verlängern sich diese Protofibrillen weiter zu langen Fasern, die sich umeinander wickeln können, um mehrsträngige, dicke Bündel zu bilden, und die sich zu einem dreidimensionalen Netzwerk verschränkter Fasern, dem Fibringerinnsel, verzweigen können. Das Fibringerinnsel wird dann durch Faktor XIIIa, eine Transglutaminase, stabilisiert, wobei die Zymogenform des Faktors XIII durch die Wirkung von Thrombin in aktiven Faktor XIIIa umgewandelt wird (siehe Abbildung 1). Faktor XIII vernetzt die Glutaminreste eines Fibrinmoleküls mit den Lysinresten eines anderen Fibrinmoleküls durch Bildung starker Isopeptidbindungen. Diese Quervernetzung erfolgt zwischen den C-terminalen Enden (Aa-Protuberanzen) der Aa-Polypeptide sowie (langsamer) an anderen Stellen, wie z. B. zwischen den C-terminalen Enden der g-Ketten. Diese Quervernetzungen tragen dazu bei, das Fibringerinnsel zu stärken und es widerstandsfähiger gegen physikalische und chemische Schäden zu machen.
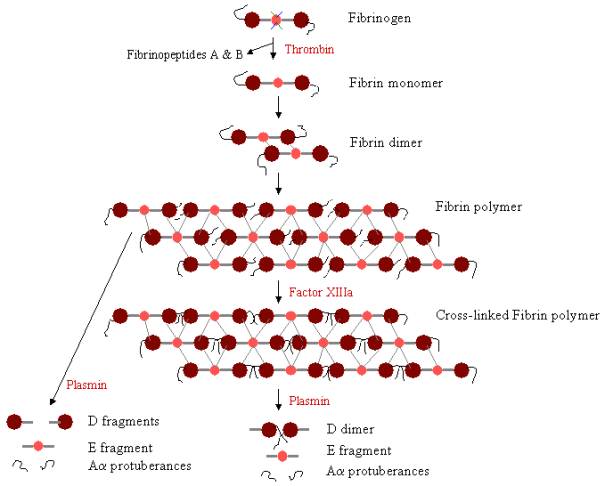
Abbildung 3. Fibrinpolymerisation und Lyse: Weg der Fibrinpolymerisation und des Fibrinabbaus. Die Noppen der E-Domäne binden an die Löcher von bis zu vier D-Domänen (graue Linien) und bilden ein langes, faseriges Gitterwerk. Das Gerinnsel wird dann durch Quervernetzung stabilisiert. Das Gerinnsel kann abgebaut werden, wobei verschiedene Abbauprodukte entstehen, wenn es quervernetzt wurde.