Compétences à développer
- Décrire comment les électrons sont regroupés dans les atomes.
Bien que nous ayons discuté de la disposition générale des particules subatomiques dans les atomes, nous avons peu parlé de la façon dont les électrons occupent l’espace autour du noyau. Se déplacent-ils autour du noyau de façon aléatoire, ou existent-ils dans un certain arrangement ordonné ?
La théorie moderne du comportement des électrons est appelée mécanique quantique. Elle fait les déclarations suivantes sur les électrons dans les atomes :
- Les électrons dans les atomes ne peuvent avoir que certaines énergies spécifiques. On dit que les énergies des électrons sont quantifiées.
- Les électrons sont organisés selon leurs énergies en ensembles appelés coquilles. En général, plus l’énergie d’une coquille est élevée, plus elle est éloignée (en moyenne) du noyau. Les coquilles n’ont pas de distances spécifiques et fixes par rapport au noyau, mais un électron dans une coquille de plus haute énergie passera plus de temps plus loin du noyau qu’un électron dans une coquille de plus basse énergie.
- Les coquilles sont encore divisées en sous-ensembles d’électrons appelés sous-coquilles. La première coquille n’a qu’une seule sous coquille, la deuxième coquille a deux sous coquilles, la troisième coquille a trois sous coquilles, et ainsi de suite. Les sous-coquilles de chaque coquille sont étiquetées, dans l’ordre, par les lettres s, p, d et f. Ainsi, la première coquille n’a qu’une sous-coquille s, la deuxième coquille a une sous-coquille s et une sous-coquille p, la troisième coquille a des sous-coquilles s, p et d, et ainsi de suite.
- Des sous-coquilles différentes contiennent un nombre maximal d’électrons différent. Toute sous coquille s peut contenir jusqu’à 2 électrons ; la sous coquille p jusqu’à 6 électrons ; la sous coquille d jusqu’à 10 ; et la sous coquille f jusqu’à 14.
C’est la disposition des électrons dans les coquilles qui a le plus d’effet sur les propriétés chimiques, nous nous concentrerons donc principalement sur les coquilles ici.
Nous utilisons des chiffres pour indiquer dans quelle coquille se trouve un électron. La première coquille, la plus proche du noyau et avec les électrons les moins énergétiques, est la coquille 1. Cette première coquille ne possède qu’une seule sous-coquille (appelée 1s) et peut contenir un maximum de 2 électrons. C’est pourquoi il y a deux éléments dans la première ligne du tableau périodique (H & He).
Parce que la première coquille ne peut contenir qu’un maximum de 2 électrons, le troisième électron doit aller dans la deuxième coquille. Par conséquent, le lithium (Li), qui possède trois électrons au total, aura deux électrons dans la première coquille et un électron dans la deuxième coquille. Remarquez que le lithium est le premier élément de la deuxième rangée du tableau périodique.
La deuxième coquille a deux sous-coquilles (étiquetées 2s et 2p). La sous-coquille 2s contient un maximum de 2 électrons, et la sous-coquille 2p contient un maximum de 6 électrons. Cela signifie que la deuxième coquille peut contenir un maximum de huit électrons (2+6=8). Remarquez qu’il y a huit éléments dans la deuxième rangée du tableau périodique.
Ce sont uniquement les électrons de la coquille la plus externe, appelée coquille de VALENCE, qui ont tendance à réagir (être gagnés, perdus ou partagés). Vous pouvez imaginer que, si deux atomes se heurtent, ce sont les électrons extérieurs qui interagissent en premier. Voici une liste des électrons totaux, des électrons par coquille et des électrons de valence pour les 10 premiers éléments.
- L’hydrogène a 1 électron dans la première coquille (donc un électron de valence).
- L’hélium a 2 électrons — tous deux dans la première coquille (donc deux électrons de valence).
- Le lithium a 3 électrons — 2 dans la première coquille, et 1 dans la deuxième coquille (donc un électron de valence).
- Beryllim a 4 électrons — 2 dans la première coquille, et 2 dans la deuxième coquille (donc deux électrons de valence).
- Le bore possède 5 électrons — 2 dans la première coquille, et 3 dans la deuxième coquille (donc trois électrons de valence).
- Le carbone possède 6 électrons — 2 dans la première coquille, et 4 dans la deuxième coquille (donc quatre électrons de valence).
- L’azote a 7 électrons — 2 dans la première coquille, et 5 dans la deuxième coquille (donc cinq électrons de valence).
- L’oxygène a 8 électrons — 2 dans la première coquille, et 6 dans la deuxième coquille (donc six électrons de valence).
- Le fluor a 9 électrons — 2 dans la première coquille, et 7 dans la deuxième coquille (donc sept électrons de valence).
- Le néon a 10 électrons — 2 dans la première coquille, et 8 dans la deuxième coquille (donc huit électrons de valence).
La figure 2.6.1 ci-dessous présente le numéro atomique des éléments du groupe principal. Le numéro atomique définit le nombre de protons dans le noyau de chaque atome. Pour les atomes neutres, le nombre de protons positifs sera égal au nombre total d’électrons négatifs (charge nette nulle). Par exemple, le brome (Br) possède 35 protons et 35 électrons au total. Les tableaux périodiques indiquent toujours le numéro atomique.

Figure 2.6.1 – Numéro atomique de chacun des éléments du groupe principal
Le nombre d’électrons de valence de chaque élément du groupe principal peut être déterminé par la colonne, ou groupe, qu’il occupe sur le tableau périodique. Le tableau 2.6.2 ci-dessous résume le nombre d’électrons de valence pour chaque colonne d’éléments du groupe principal. Par exemple, les éléments de la première colonne (parfois étiquetée IA) ont tous un électron de valence. La deuxième colonne (IIA) a deux électrons de valence. Nous sautons le petit bloc de dix éléments au milieu, car c’est là qu’une sous-coquille se remplit dans le désordre. Les éléments des colonnes IIIA, IVA, VA, VIA, et VIIA, et VIIIA* ont respectivement trois, quatre, cinq, six, sept et huit* électrons de valence.
*Notez que l’hélium (He) n’a que deux électrons de valence. Certains tableaux périodiques placent l’hélium dans la colonne IIA, d’autres dans la colonne VIIIA, et certains dans les deux emplacements.
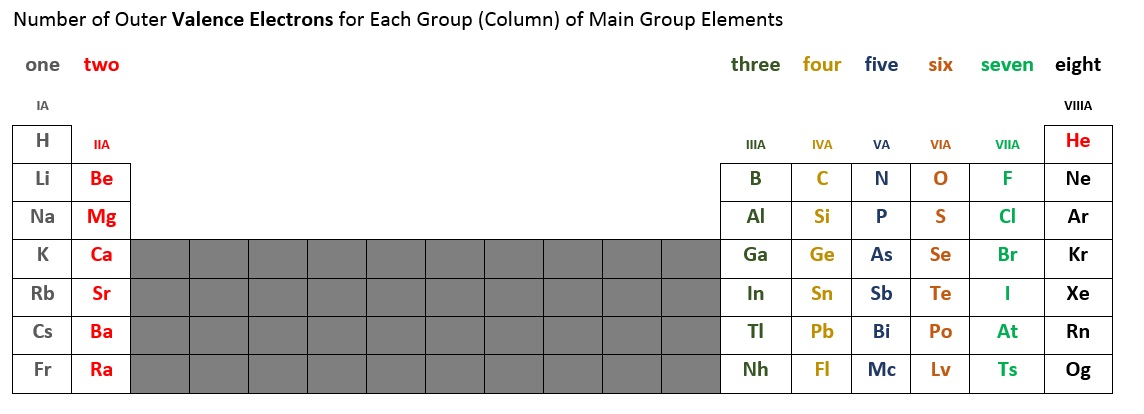
Figure 2.6.2 – Nombre d’électrons de valence pour les éléments du groupe principal
Exemple \(\PageIndex{1}\) : ElectronsS des atomes de phosphore
Combien d’électrons totaux et de valence y a-t-il dans un atome de phosphore neutre ?
SOLUTION
Un atome de phosphore neutre possède 15 électrons totaux. Deux électrons peuvent aller dans la première coquille, huit dans la deuxième coquille, et il en a cinq de plus dans la troisième coquille. La troisième coquille est la coquille de valence externe, il a donc 5 électrons de valence.
Le nombre d’électrons dans chaque coquille devient plus compliqué à mesure que des électrons sont ajoutés parce qu’il y a plus de sous-coquilles utilisées et parce que la coquille commence à se remplir dans le désordre. Pour les éléments dont le numéro atomique est supérieur à 20 (au-delà du calcium), nous nous concentrerons sur le nombre d’électrons totaux et de valence, et non sur le nombre d’électrons dans chaque enveloppe. Nous avons indiqué que les électrons de la coquille externe sont dits de valence. Les coquilles et les électrons intérieurs (de non valence) sont souvent appelés le noyau.
Exemple \(\PageIndex{2}\) : Compter les électrons totaux et de valence dans les atomes de xénon
Combien d’électrons totaux, de valence et de noyau y a-t-il dans un atome de xénon neutre ?
SOLUTION
Le xénon possède 54 électrons totaux, 8 électrons de valence et 46 électrons de noyau.
Exercices de révision des concepts
- Comment les électrons sont-ils organisés dans les atomes ?
- Quel est le nombre maximum d’électrons qui peuvent tenir dans les deux premières coquilles d’un atome ?
- Quelle est la différence entre les électrons de cœur et les électrons de valence ?
Réponses
- Les électrons sont organisés en coquilles et sous-coquilles autour des noyaux.
- La première coquille peut contenir un maximum de deux et la deuxième coquille peut contenir un maximum de huit électrons.
- Les électrons de valence se trouvent dans la coquille (externe) portant le numéro le plus élevé ; tous les autres électrons sont des électrons de noyau.
Key Takeaway
- Les électrons sont organisés en coquilles et sous-coquilles autour du noyau d’un atome.
Contributeurs
-
Anonyme