Basicité des amines hétérocycliques
Lorsqu’un atome d’azote est incorporé directement dans un cycle aromatique, sa basicité dépend du contexte de liaison. Dans un cycle pyridine, par exemple, le doublet solitaire de l’azote occupe une orbitale hybride sp2, et ne fait pas partie du sextet aromatique – c’est essentiellement un azote imine. Son doublet d’électrons est disponible pour former une liaison avec un proton, et l’atome d’azote de la pyridine est donc quelque peu basique.

Dans un cycle pyrrole, en revanche, le doublet d’électrons solitaires de l’azote fait partie du sextet aromatique. Cela signifie que ces électrons sont très stables là où ils sont (dans le système aromatique), et sont beaucoup moins disponibles pour se lier à un proton (et s’ils captent un proton, le système aromatique est détruit). Pour ces raisons, les azotes du pyrrole ne sont pas fortement basiques.

Les exemples de l’aniline, de la pyridine et du pyrrole sont de bons modèles pour prédire la réactivité des atomes d’azote dans des systèmes cycliques plus complexes (dont on trouve une énorme diversité dans la nature). La chaîne latérale du tryptophane, par exemple, contient un azote non basique de type « pyrrole », tandis que l’adénine (une base de l’ADN/ARN) contient les trois types.


Les électrons solitaires de l’azote d’un nitrile sont contenus dans une orbitale hybride sp. Le caractère 50% s d’une orbitale hybride sp signifie que les électrons sont proches du noyau et donc pas significativement basiques.
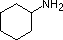
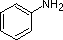
Un examen des concepts de base de l’acide-base devrait être utile à la discussion suivante. Comme l’ammoniac, la plupart des amines sont des bases de Brønsted et de Lewis, mais leur force de base peut être énormément modifiée par les substituants. Il est courant de comparer quantitativement les basicités en utilisant les pKa de leurs acides conjugués plutôt que leurs pKb. Comme pKa + pKb = 14, plus le pKa est élevé, plus la base est forte, contrairement à la relation inverse habituelle entre le pKa et l’acidité. La plupart des alkylamines simples ont des pKa compris entre 9,5 et 11,0, et leurs solutions aqueuses sont basiques (ont un pH de 11 à 12, selon la concentration). Les quatre premiers composés du tableau suivant, y compris l’ammoniac, appartiennent à cette catégorie.
Les cinq derniers composés (cellules colorées) sont des bases nettement plus faibles en raison de trois facteurs. Le premier d’entre eux est l’hybridation de l’azote. Dans la pyridine, l’azote est hybridé sp2, et dans les nitriles (dernière entrée), un azote hybride sp fait partie de la triple liaison. Dans chacun de ces composés (en grisé rouge), la paire d’électrons non liante est localisée sur l’atome d’azote, mais l’augmentation du caractère s la rapproche du noyau d’azote, réduisant sa tendance à se lier à un proton.
|
Compound |
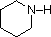 |
 |
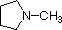 |
NH3 |  |
 |
 |
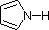 |
 |
CH3C≡N | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| pKa | 11.0 | 10,7 | 10,7 | 9,3 | 5.2 | 4,6 | 1,0 | 0,0 | -1,0 | -10. |
Basicité des amines communes (pKa des ions ammonium conjugués)
Enfin, la très faible basicité du pyrrole (en bleu ombré) reflète l’exceptionnelle délocalisation du doublet électronique azoté associée à son incorporation dans un cycle aromatique. L’indole (pKa = -2) et l’imidazole (pKa = 7,0), voir ci-dessus, ont également des cycles aromatiques hétérocycliques similaires. L’imidazole est plus d’un million de fois plus basique que le pyrrole parce que l’azote sp2 qui fait partie d’une double liaison est structurellement similaire à la pyridine, et a une basicité comparable.
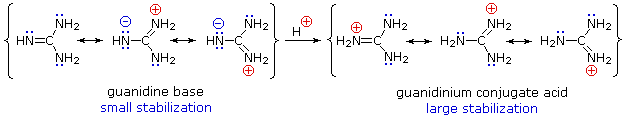
Bien que la délocalisation de la résonance réduise généralement la basicité des amines, un exemple spectaculaire de l’effet inverse se trouve dans le composé guanidine (pKa = 13,6). Ici, comme indiqué ci-dessous, la stabilisation par résonance de la base est faible, en raison de la séparation des charges, tandis que l’acide conjugué est fortement stabilisé par la délocalisation des charges. Par conséquent, les solutions aqueuses de guanidine sont presque aussi basiques que les solutions d’hydroxyde de sodium.
.