20 août 2018
Canule nasale à haut débit (HFNC) – Partie 1 : Comment ça marche
 L’utilisation de canules nasales à haut débit chauffées et humidifiées (HFNC) est devenue de plus en plus populaire dans le traitement des patients souffrant d’insuffisance respiratoire aiguë à travers tous les groupes d’âge. J’ai commencé à l’utiliser en tant que boursier en soins intensifs pédiatriques, mais j’avais peu de connaissances sur son fonctionnement réel. J’ai remarqué que quelques années après l’avoir utilisé avec succès chez les enfants, principalement en cas de bronchiolite grave, nous avons commencé à l’utiliser également dans l’unité de soins intensifs pour adultes. Il semble qu’au cours de ces dernières années, de nombreuses études ont été publiées pour examiner les mécanismes d’action ainsi que son utilisation dans diverses conditions. Dans cette partie, nous allons résumer son fonctionnement et pour la partie 2, nous aborderons les principales indications de son utilisation chez les patients adultes et pédiatriques.
L’utilisation de canules nasales à haut débit chauffées et humidifiées (HFNC) est devenue de plus en plus populaire dans le traitement des patients souffrant d’insuffisance respiratoire aiguë à travers tous les groupes d’âge. J’ai commencé à l’utiliser en tant que boursier en soins intensifs pédiatriques, mais j’avais peu de connaissances sur son fonctionnement réel. J’ai remarqué que quelques années après l’avoir utilisé avec succès chez les enfants, principalement en cas de bronchiolite grave, nous avons commencé à l’utiliser également dans l’unité de soins intensifs pour adultes. Il semble qu’au cours de ces dernières années, de nombreuses études ont été publiées pour examiner les mécanismes d’action ainsi que son utilisation dans diverses conditions. Dans cette partie, nous allons résumer son fonctionnement et pour la partie 2, nous aborderons les principales indications de son utilisation chez les patients adultes et pédiatriques.
Les canules nasales à haut débit chauffées et humidifiées ou comme la plupart les appellent, les canules nasales à haut débit (HFNC), ne sont pas simplement des canules nasales standard montées à la manivelle à des débits très élevés. Elles acceptent le gaz et peuvent le chauffer à 37 °C avec une humidité relative de 100 % et délivrer 0,21 à 1,00 % de fi02 à des débits allant jusqu’à 60 litres/min. Le débit et le fi02 peuvent être titrés indépendamment en fonction des besoins en débit et en fi02 de votre patient.

Il y a 2 sociétés principales, qui fabriquent ces appareils : Vapotherm qui possède un appareil pouvant délivrer des débits allant jusqu’à 50 litres/min et Fisher Paykall qui propose à la fois l’Optiflow ainsi que les appareils AIRVO 2 qui peuvent tous deux délivrer des débits allant jusqu’à 60 litres/min.
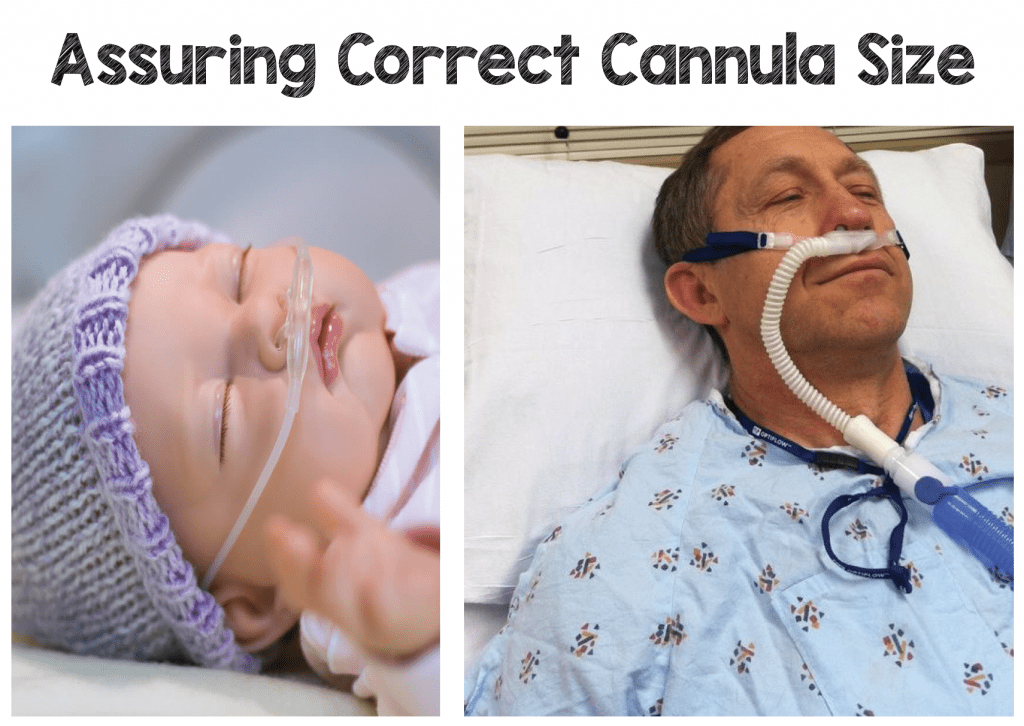
 Chaque entreprise propose des canules de plus petite taille pour les nouveau-nés prématurés ainsi que pour les enfants de différents âges jusqu’aux canules pour adultes. Chaque canule doit s’adapter parfaitement aux narines du patient et empêcher l’entraînement de l’air ambiant autour de la canule, ce qui peut se produire avec les canules nasales standard. Chaque fabricant aura également un débit maximal pour chaque taille de canule correspondant à la taille et à l’âge du patient.
Chaque entreprise propose des canules de plus petite taille pour les nouveau-nés prématurés ainsi que pour les enfants de différents âges jusqu’aux canules pour adultes. Chaque canule doit s’adapter parfaitement aux narines du patient et empêcher l’entraînement de l’air ambiant autour de la canule, ce qui peut se produire avec les canules nasales standard. Chaque fabricant aura également un débit maximal pour chaque taille de canule correspondant à la taille et à l’âge du patient.
Comment ça marche:
L’oxygène chauffé & Humidifié:
L’oxygène chauffé et humidifié présente un certain nombre d’avantages par rapport à l’oxygénothérapie standard. L’oxygénothérapie standard délivrée par une canule nasale ou un autre dispositif tel qu’un non-récupérateur, est froide (non réchauffée) et sèche (non humidifiée). Cela peut entraîner une inflammation des voies respiratoires, ce qui peut augmenter la résistance des voies respiratoires et altérer la fonction mucociliaire, entraînant éventuellement une diminution de la clairance des sécrétions (1). De plus, une quantité importante de calories peut également être dépensée chez les individus pour à la fois réchauffer et humidifier le gaz pendant la respiration normale (2).
LesHFNC peuvent réchauffer (à 37oC) et humidifier le gaz, ce qui peut diminuer l’inflammation des voies respiratoires, maintenir la fonction mucociliaire, améliorer la clairance du mucus et réduire la dépense calorique dans l’insuffisance respiratoire aiguë (1-2).
Demandes respiratoires :
Un avantage évident, mais qui mérite d’être mentionné, est que le haut débit peut vous donner un très haut débit de gaz. Ceci est important car les patients en insuffisance respiratoire aiguë peuvent être extrêmement tachypnéiques, et donc leurs débits inspiratoires de pointe, qui peuvent normalement être de 30L/min – 60L/min, peuvent atteindre jusqu’à 120 L/min (3). Donc si vous placez votre patient tachypnéique avec un débit PIF de 120L/min et un volume minute >20L/min sur un masque NRB de 15L/min, vous ne l’aidez peut-être pas autant que vous le pensez. J’aborderai ce point un peu plus tard dans cette revue lorsque nous discuterons du concept de dilution de l’oxygène.
Capacité résiduelle fonctionnelle :
Vous avez peut-être cherché le point qui dit que le Hi Flow fournit une PEP et vous ne l’avez pas trouvé ? Il y a eu un certain débat sur la quantité réelle de PEEP qu’un appareil à haut débit peut fournir. Il a été démontré que le HFNC fournit jusqu’à 1 mm de Hg de PEP pour chaque 10L/min de débit délivré avec une respiration à bouche fermée. (4-5)
Je ne suis pas sûr de croire que cela soit vrai pour tous les patients, et ce parce qu’il existe de nombreux facteurs qui peuvent affecter la quantité de PEEP qui peut réellement être délivrée à un patient. Des facteurs tels que la taille du patient (obèse, adulte, enfant), le débit en litres délivré (L/Min), et la respiration bouche ouverte versus bouche fermée (la pression peut s’échapper lorsque les patients ont la bouche ouverte) peuvent tous affecter la quantité de PEEP délivrée (4)
Le débat peut continuer, mais il semble bien que l’HFNC puisse augmenter le volume résiduel fonctionnel (FRC) d’un patient ou le volume pulmonaire à la fin de l’expiration quelque chose que la PEEP améliore habituellement. Une étude de Riera J. et al a montré que l’utilisation de HFNC augmentait l’impédance pulmonaire en fin d’expiration (EELI), ce qui implique une amélioration du FRC (6). Ils ont utilisé la tomographie par impédance électrique (TIE), une méthode d’imagerie non invasive et en temps réel qui fournit une image de ventilation transversale du poumon pour démontrer une augmentation de l’impédance pulmonaire de fin d’expiration (EELI).
Il semble également que l’utilisation de l’HFNC puisse diminuer la précharge en augmentant la pression intra-thoracique, encore une autre caractéristique communément attribuée à la PEP. Roca et al ont démontré dans une étude séquentielle par intervalles sur 10 patients (insuffisance cardiaque NYHA III mais pas dans une exacerbation aiguë de l’ICC) que l’utilisation du Hi Flow provoquait un effondrement inspiratoire de la veine cave inférieure (VCI) par rapport à la ligne de base des patients, mesuré par échocardiogramme (7).
Le Hi Flow semble provoquer un recrutement alvéolaire et une augmentation de la CRF ainsi qu’une augmentation de la pression intrathoracique probablement en raison de la PEP ajoutée, cependant il n’est pas certain que peut-être un autre mécanisme puisse être responsable de ces résultats.
Léger :
Les patients préfèrent souvent l’utilisation de l’HFNC à celle de la ventilation à pression positive non invasive (CPAP ou BPAP) car le masque à ajustement serré peut être inconfortable pour certains patients. Ils peuvent même la préférer à la NC standard car les gaz réchauffés et humidifiés n’assèchent pas leurs muqueuses comme le fait l’oxygénothérapie standard (5). Cela peut conduire à une meilleure observance de l’HFNC et peut-être à une amélioration de l’oxygénation et du travail respiratoire de votre patient.
Dilution de l’O2:
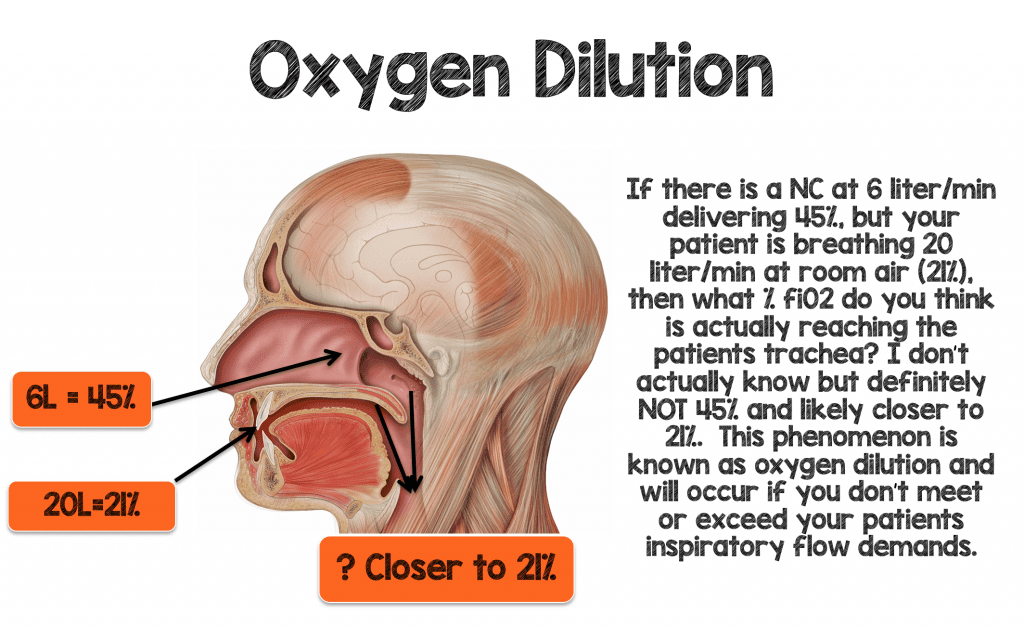
On m’a appris lors de ma rotation en soins intensifs en tant qu’interne que chaque litre de canule nasale délivrera ~4% de fiO2 au-dessus de l’air ambiant (21%). Ainsi, 1 litre/min via la CN devrait délivrer ~ 25% de fiO2, et 2 litres/min devraient délivrer 29% de fiO2 (voir tableau 1 ci-dessous). J’ai cru pendant des années que cette » règle du 1:4 » était vraie, mais voyons si elle a un sens pour un patient en détresse respiratoire aiguë

Imaginez un homme de 70 kg respirant à 30-40 bpm avec des volumes courants normaux (~500 ml) et développant une certaine hypoxémie. La ventilation minute de ce patient se situerait entre 15 et 20 litres/minute. Vous décidez de placer ce patient sous 6 litres/minute de NC, ce qui devrait théoriquement fournir une fiO2 de ~ 45% (6L x 4% = 24 + Air ambiant (21%) = 45%) si la « règle du 1:4 » est vraie. Si ce patient respire 15-20L par la bouche et par les narines (autour de la canule nasale) à 21%, alors croyez-vous que ce patient obtiendra effectivement 45% de fiO2 délivrée à la trachée ?
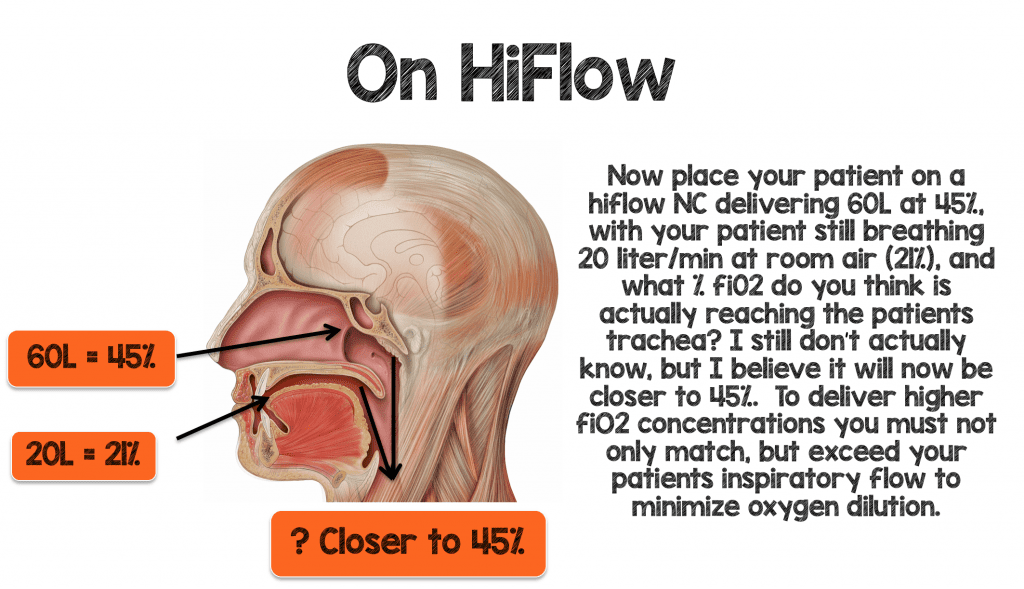
Pour délivrer efficacement des quantités plus élevées de fiO2 à votre patient, vous devez non seulement correspondre, mais dépasser la ventilation minute et les demandes inspiratoires de votre patient pour minimiser la dilution de l’oxygène.
Extraction de l’espace mort :
Nous réinhalons normalement un tiers de notre volume courant précédemment expiré et au lieu de respirer 21 % (air ambiant) et des quantités négligeables de dioxyde de carbone ; nous pouvons réinhaler plutôt 15-16 % d’oxygène et 5-6 % de dioxyde de carbone. Cela est dû au fait que l’air précédemment expiré (pauvre en oxygène et contenant un peu de dioxyde de carbone) n’est pas entièrement expiré et reste dans les voies aériennes supérieures. Lorsque votre patient prend sa prochaine inspiration à partir du gaz atmosphérique, tout ce gaz ne pénètre pas dans les alvéoles. En fait, c’est un mélange du nouveau gaz atmosphérique (21% d’02, CO2 négligeable) et de leur gaz précédemment expiré (<21% d’oxygène et un peu de CO2). Chez les patients souffrant d’insuffisance respiratoire aiguë, le pourcentage de gaz que nous réinspirons devient plus important et, par conséquent, nous pouvons réinspirer de plus grandes quantités de dioxyde de carbone lorsque nous tirons nos respirations d’un réservoir mixte de nos voies aériennes supérieures. Une autre façon de le dire est que notre espace mort augmente en cas d’insuffisance respiratoire aiguë.
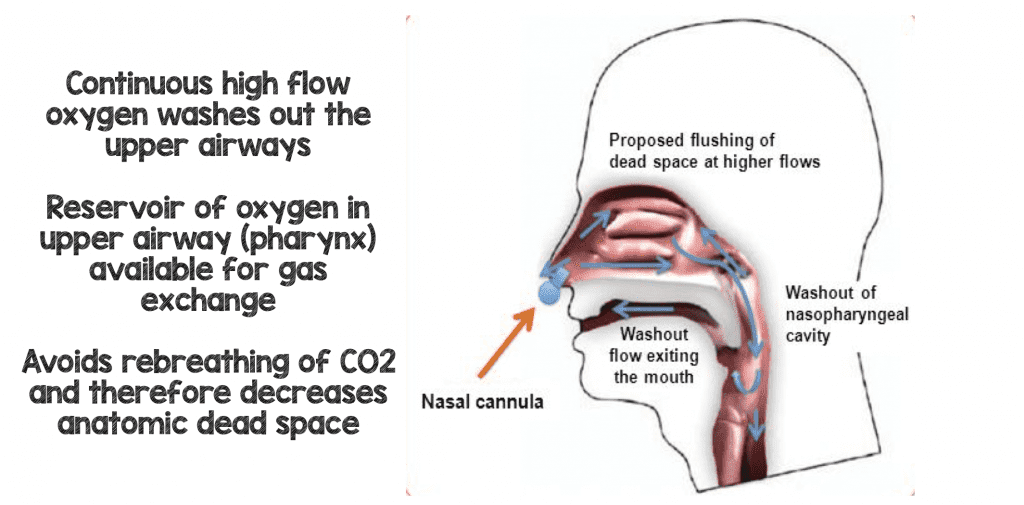
L’un des principaux avantages de l’HFNC (certains affirment que c’est en fait le principal avantage) est qu’il vous donne un flux continu de gaz frais à haut débit remplaçant ou lavant l’espace mort pharyngé du patient (l’ancien gaz pauvre en oxygène et riche en CO2). Chaque souffle que le patient réinspire maintenant sera lavé du dioxyde de carbone et remplacé par un gaz riche en oxygène améliorant l’efficacité de la respiration (8).

Poste invité co-écrit par

Thomas Lettich, D.O.
Médecine interne/pédiatrie Médecin résident
Geisinger Medical Center
Danville, Pennsylvanie
- Chidekel, A et al. Les effets de l’humidification du gaz avec une canule nasale à haut débit sur les cellules épithéliales des voies respiratoires humaines en culture. Pulmonary Medicine 2012. PMID : 22988501
- Dysart, K et al. Recherche sur la thérapie à haut débit : Mécanismes d’action. Médecine respiratoire 2009. PMID : 19467849
- Katz, JA et al. Travail inspiratoire avec et sans pression positive continue des voies aériennes chez les patients souffrant d’insuffisance respiratoire aiguë. Anesthésiologie 1985. PMID : 3904528
- Parke R et al. Pressions délivrées par l’oxygène nasal à haut débit pendant toutes les phases du cycle respiratoire. Soins respiratoires 2013. PMID : 23513246
- Frat JP et al. Oxygénothérapie nasale à haut débit et ventilation non invasive dans la gestion de l’insuffisance respiratoire hypoxémique aiguë. Annales de médecine translationnelle 2017). PMID : 28828372
- Riera J et al. Effet de la canule nasale à haut débit et de la position du corps sur le volume pulmonaire end-expiratoire : Une étude de cohorte utilisant la tomographie par impédance électrique. Médecine respiratoire 2013. PMID : 23050520
- Roca O et al. Patients with New York Heart Association Class III Heart Failure may Benefit with High Flow Nasal Cannula Supportive Therapy : High Flow Nasal Cannula in Heart Failure. Journal Crit Care 2013. PMID : 23602035
- Möller W et al. Le haut débit nasal dégage l’espace mort anatomique dans les modèles de voies aériennes supérieures. Journal of Applied Physiology 2015). PMID : 25882385
Soutenez le spectacle en payant & réclamant 0,5hrs de FMC/CEH en cliquant sur le logo ci-dessous

Post révision par les pairs par : Salim R. Rezaie, MD (Twitter : @srrezaie)
- Bio
- Derniers messages
Frank Lodeserto MD
Derniers messages de Frank Lodeserto MD (voir tous)
- L’essai RELAx : Quelle est la PEP optimale chez les patients sans SDRA ? – 1er février 2021
- Mise à jour du COVID-19 : le vaccin Pfizer COVID-19 – 15 décembre 2020
- La lymphohistiocytose hémophagocytaire (HLH) : Un diagnostic zébré que nous devrions tous connaître – 30 juillet 2020
.