Dans ce billet, nous abordons le phénomène de diffraction du second ordre à travers un monochromateur et les problèmes qu’il peut causer en spectroscopie de fluorescence.
C’est le deuxième d’une série de billets de blog (lire le premier billet de blog) où nous discutons des erreurs les plus courantes commises, et des artefacts expérimentaux qui apparaissent lors de la mesure des spectres de fluorescence. Cette liste a été initialement inspirée par la » Rogue’s Gallery of Fluorescence Artefacts and Errors » (Galerie des artefacts et des erreurs de fluorescence) de l’excellent livre » Introduction to Fluorescence » (Introduction à la fluorescence) de David M. Jameson1. Ces articles de blog s’appuieront sur cette liste avec l’expérience de nos propres ingénieurs d’exploitation et scientifiques d’application sur les erreurs courantes qu’ils observent lorsqu’ils répondent aux questions des clients, visitent des laboratoires et… se font parfois eux-mêmes.
Qu’est-ce que la diffraction de second ordre ?
En spectroscopie de fluorescence, des monochromateurs sont utilisés pour sélectionner les longueurs d’onde d’excitation et d’émission. Un spectromètre de fluorescence typique sera composé de deux monochromateurs ; un monochromateur d’excitation pour sélectionner la longueur d’onde d’excitation souhaitée et un monochromateur d’émission pour sélectionner quelle longueur d’onde atteint le détecteur. Pour plus d’informations sur le fonctionnement d’un spectromètre de fluorescence, lisez notre article « Introduction aux mesures de fluorescence & Instrumentation ».
Les monochromateurs utilisent des réseaux de diffraction afin d’isoler la longueur d’onde souhaitée de la lumière large bande incidente. La lumière à large bande est éclairée sur le réseau de diffraction et les différentes longueurs d’onde qui composent la lumière sont diffractées à différents angles afin de satisfaire l’équation du réseau,
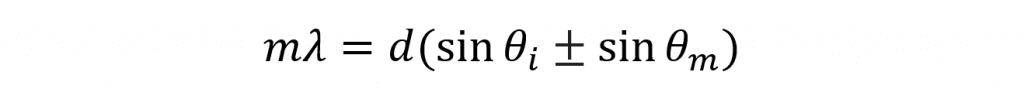
où m est l’ordre de la diffraction, λ est la longueur d’onde de la lumière diffractée, d est l’espacement des sillons du réseau, est l’angle entre la lumière incidente et la normale du réseau, θί est l’angle entre la lumière diffractée et la normale du réseau. On peut voir que pour une constante, chaque longueur d’onde de la lumière sera diffractée à un angle différent, ce qui permet au monochromateur d’isoler la longueur d’onde désirée. On peut également voir que pour constant et constant λ l’équation est satisfaite avec des angles différents selon l’ordre de diffraction m qui peut prendre des valeurs entières positives et négatives (…-2, -1, 0, 1, 2…). Une valeur de ±1 est appelée diffraction de premier ordre et se produit au plus près de la normale du réseau et présente l’intensité la plus élevée. De même, une valeur de ±2 est appelée diffraction de second ordre et se produit à un angle plus faible et est plus faible en intensité. La diffraction aux ordres supérieurs suit un schéma similaire d’augmentation de l’angle par rapport à la normale et de réduction de l’intensité.
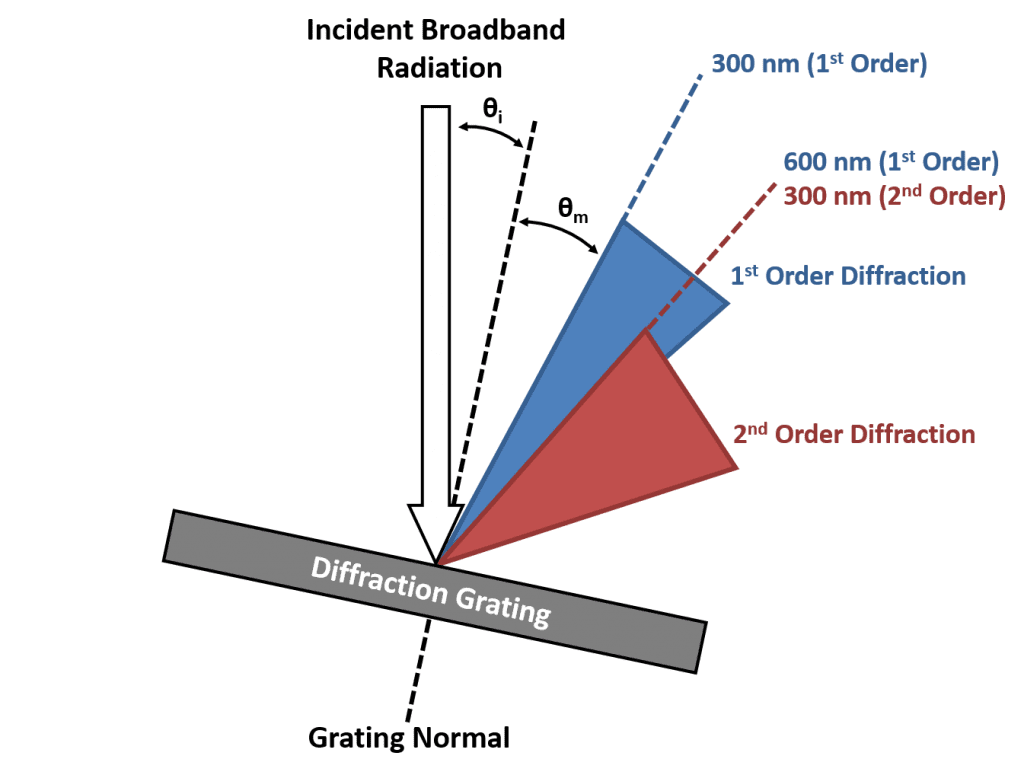
Dans un monochromateur, c’est uniquement la diffraction de premier ordre (soit +1 ou -1) qui est utilisée pour sélectionner la longueur d’onde souhaitée et les ordres supérieurs sont indésirables. Cependant, en raison de la large gamme de longueurs d’onde diffractées, les plages d’angle occupées par la diffraction de premier et de second ordre ne sont pas uniques. Ceci est illustré dans la figure 1 où le cône bleu représente la plage d’angles où la lumière est diffractée de premier ordre et le cône rouge est la plage d’angles où la lumière a été diffractée de second ordre et il y a une région de chevauchement partagée entre ces plages. Cette zone partagée peut également être vue à partir de l’équation du réseau. Considérons une lumière à 600 nm qui est diffractée de premier ordre (m = 1, λ = 600 nm) et une lumière à 300 nm qui est diffractée de second ordre (m = 2, λ = 300) ; il est clair que le côté gauche de l’équation du réseau est le même dans les deux cas et que l’angle de la lumière diffractée doit donc être équivalent. La conséquence de ceci est que lorsque le monochromateur est réglé pour transmettre 600 nm, une petite fraction de lumière de 300 nm sera également transmise, ce qui peut être problématique pour la spectroscopie de fluorescence.
L’apparition de la diffraction du second ordre dans les spectres de fluorescence
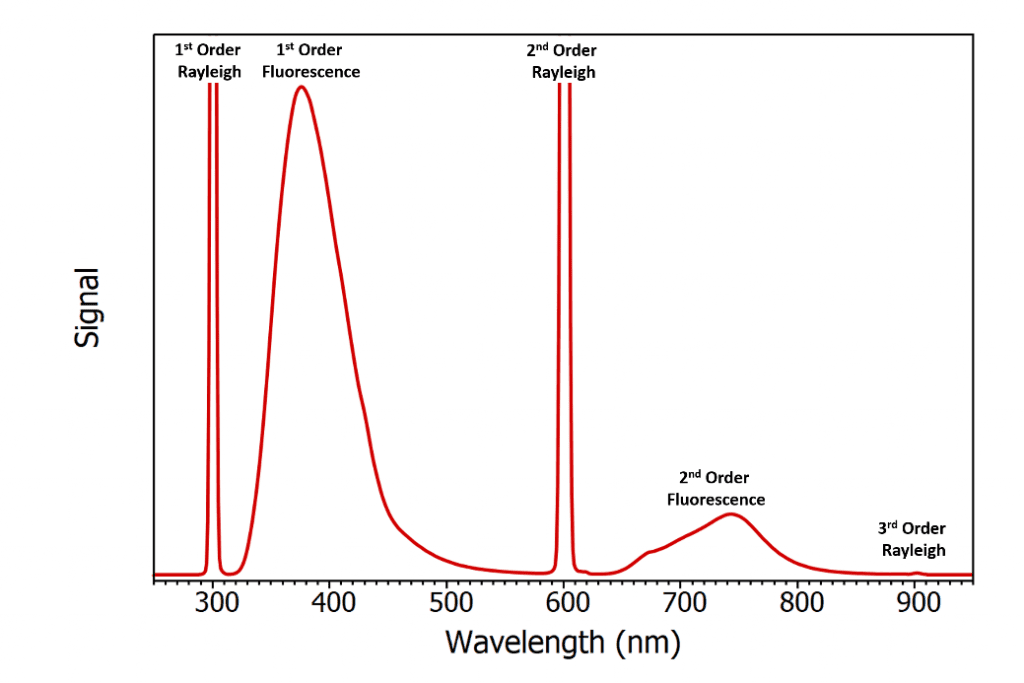
La diffraction du second ordre est un problème particulier pour les échantillons diffusants tels que les poudres, les cristaux et les suspensions colloïdales. Pour montrer l’effet de la diffraction du second ordre sur les spectres de fluorescence, un échantillon fluorescent diffusant a été préparé en mélangeant une solution du colorant fluorescent 2-aminopyridine avec du Ludox qui est une suspension colloïdale de nanoparticules de silice et sert de diffuseur. La solution a été excitée à 300 nm et le spectre d’émission a été mesuré sur une plage de 250 nm à 950 nm comme le montre la figure 2 en utilisant le spectromètre de photoluminescence FLS1000 avec le filtre de tri d’ordre (voir section suivante) du monochromateur d’émission désactivé.Le premier pic à 300 nm correspond à la diffusion Rayleigh de la lumière d’excitation de 300 nm qui a été diffractée au premier ordre dans le monochromateur d’émission. Il est suivi par la fluorescence de premier ordre de la 1-aminopyridine qui atteint un pic à 380 nm. Ces pics sont ensuite répétés comme des artefacts de second ordre avec un pic de diffusion de Rayleigh à 600 nm et un pic de fluorescence à 760 nm. Un faible pic de diffusion de Rayleigh de troisième ordre peut également être observé à 900 nm. La confusion entre les artefacts de deuxième ordre et la véritable émission de fluorescence est une erreur courante chez les utilisateurs inexpérimentés de la fluorescence et a même été à l’origine de rapports erronés dans la littérature. Un exemple de cela est la publication d’un article qui signalait de nouvelles bandes d’émission faibles de grande longueur d’onde du tryptophane et de la tyrosine à 675 nm et 600 nm qui s’ajoutaient à l’émission UV bien connue de ces résidus protéiques.3 Six mois plus tard, Hutnik et al. ont publié une réfutation qui montrait que la supposée fluorescence de grande longueur d’onde était simplement la diffraction de second ordre de la véritable émission UV du tryptophane et de la tyrosine à 340 nm et 300 nm4.
Suppression de la diffraction de second ordre à l’aide de filtres de tri d’ordre
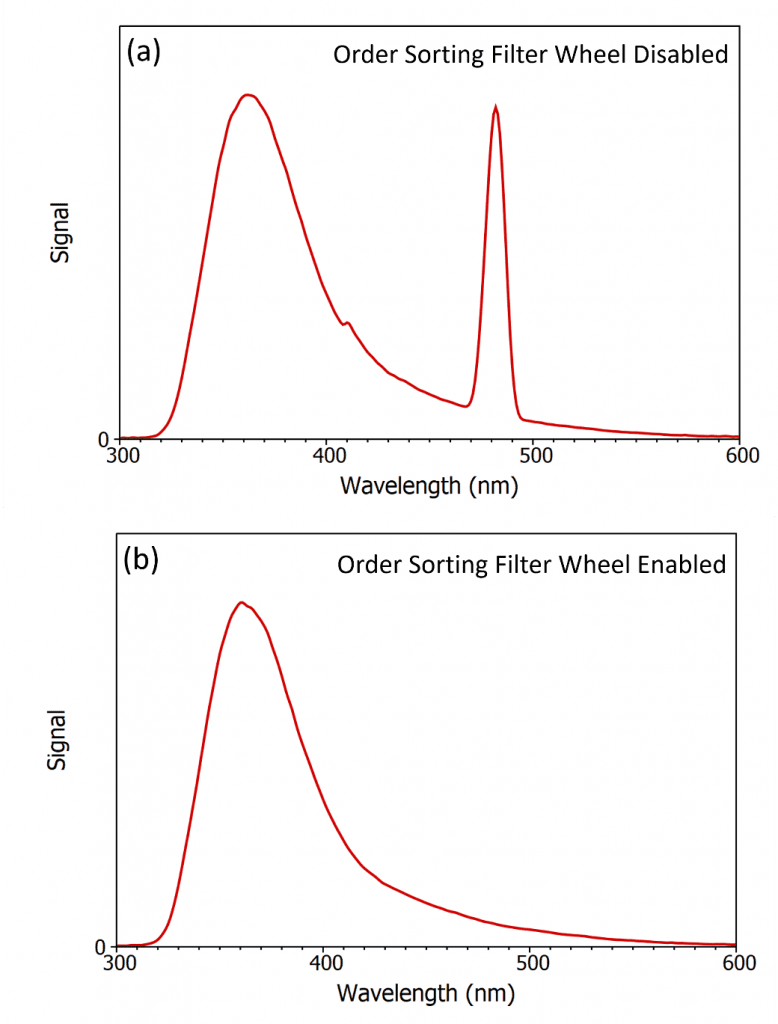
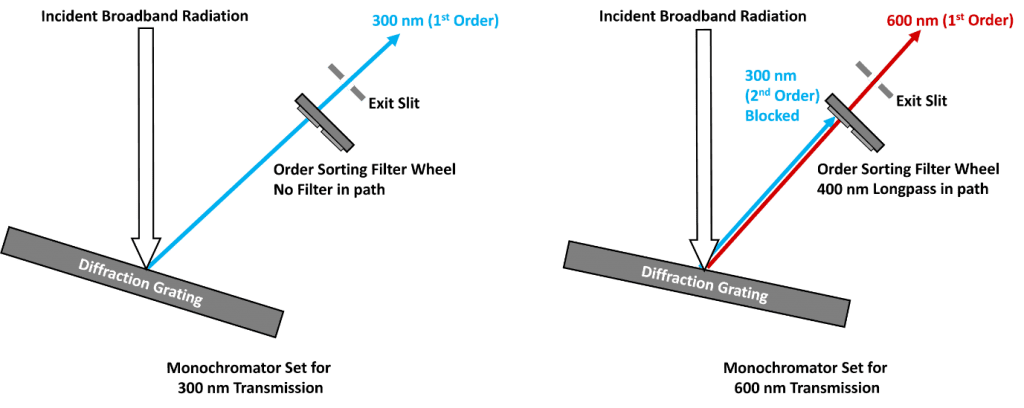
L’erreur et la publication d’un artefact de second ordre est un exemple extrême, mais un problème plus courant est que la diffusion de second ordre chevauche souvent l’émission de fluorescence qui est mesurée et déforme le spectre. La figure 3a montre le spectre d’émission du même échantillon de Ludox / 2-aminopyridide que celui utilisé à la figure 2, mais la longueur d’onde d’excitation a été déplacée à 240 nm et la gamme d’émission a été réduite. La diffusion de second ordre se situe maintenant à 480 nm et chevauche la queue de la fluorescence de la 2-aminopyridine, ce qui empêche une mesure précise du spectre.La solution à ce problème consiste à utiliser des filtres de tri d’ordre à l’intérieur du monochromateur. Les filtres de triage sont des filtres passe-haut qui ne transmettent que les longueurs d’onde supérieures à la longueur d’onde de coupure du filtre. Le principe des filtres de tri d’ordre à l’intérieur du monochromateur est illustré à la figure 4, où les filtres de tri d’ordre sont montés dans une roue à filtres située devant la fente de sortie. Lorsque le monochromateur est réglé pour transmettre 300 nm, le réseau de diffraction est tourné de façon à ce que la lumière diffractée de 300 nm soit dirigée vers la fente de sortie du monochromateur et la roue à filtres est tournée de façon à ce qu’il n’y ait pas de filtre passe-bas dans le trajet lumineux et que la lumière de 300 nm sorte du monochromateur comme souhaité (image de gauche). Lorsque le monochromateur est réglé pour transmettre une lumière de 600 nm, le réseau de diffraction est tourné de façon à ce que la lumière de 600 nm diffractée de premier ordre soit dirigée vers la fente de sortie, accompagnée d’une petite quantité de lumière de 300 nm de second ordre. La roue de filtre est tournée de façon à ce qu’il y ait un filtre passe long de 400 nm devant la fente de sortie qui transmet la lumière désirée de 600 nm tout en bloquant la lumière indésirable de 300 nm (image de droite).
L’intérêt des filtres de tri d’ordre est illustré sur la figure 3b où le spectre a été remesuré avec la roue de filtre de tri d’ordre automatisé du monochromateur d’émission du FLS1000 désormais activée. Le filtre de triage par ordre élimine le pic de diffusion de second ordre à 480 nm et le véritable spectre de la 2-aminopyridine est obtenu. Les spectromètres FLS1000 et FS5 d’Edinburgh Instruments sont équipés de roues de filtre de triage d’ordre sur les monochromateurs d’excitation et d’émission en standard. Ces roues à filtres sont activées par défaut et sont entièrement automatisées, le logiciel Fluoracle® des FLS1000 et FS5 sélectionnant les filtres appropriés à utiliser en fonction du choix de la longueur d’onde d’excitation et des longueurs d’onde d’émission. Ces roues à filtres automatiques permettent à l’utilisateur de mesurer des spectres de fluorescence larges sans jamais se soucier des artefacts de second ordre qui faussent leurs mesures.
Nous espérons que ce billet de blog vous a aidé à comprendre la présence d’artefacts de second ordre dans les spectres de fluorescence et comment ils peuvent être évités en utilisant des filtres de tri d’ordre.
- Introduction à la fluorescence, D. M. Jameson, CRC Press (2014)
- Principes de la spectroscopie de fluorescence 3e, J. R. Lakowicz, Springer (2006)
- Macías, M. C. Pinto, C. Gutiérrez-Mérino, Long-Wavelength Fluorescence of Tyrosine and Tryptophan Solutions, Biochem Int. 15, 961-969 (1987)
- M. Hutnik, A. G. Szabo, Long-Wavelength Fluorescence of Tyrosine and Tryptophan : a Classic Example of Second Order Diffraction, Biochem Int. 16, 587-591 (1988)
Spectromètres pour prévenir la diffraction de second ordre
Les spectromètres FS5 et FLS1000 établissent la norme en matière de spectroscopie de photoluminescence en régime permanent et résolue dans le temps, tant pour la recherche fondamentale que pour les applications de routine en laboratoire. Pour plus d’informations sur nos FLS1000 et FS5, pourquoi ne pas contacter un membre de notre équipe à l’adresse [email protected].
Rester en contact
Si vous avez apprécié cet article de blog, et que vous voulez être le premier à voir toutes les dernières nouvelles, applications et informations sur les produits, alors inscrivez-vous à notre newsletter peu fréquente via le bouton rouge d’inscription ci-dessous, et suivez-nous sur les médias sociaux.