L’énolisation ou une tautomérie céto-énol est un processus de conversion d’une cétone ou d’un aldéhyde en un énol (dans des conditions acides) ou un énolate (dans des conditions basiques) correspondant. Ce processus peut également se produire dans les esters. Je vais cependant me concentrer sur les aldéhydes et les cétones dans ce post, afin de ne pas le surcharger avec les détails et les nuances.
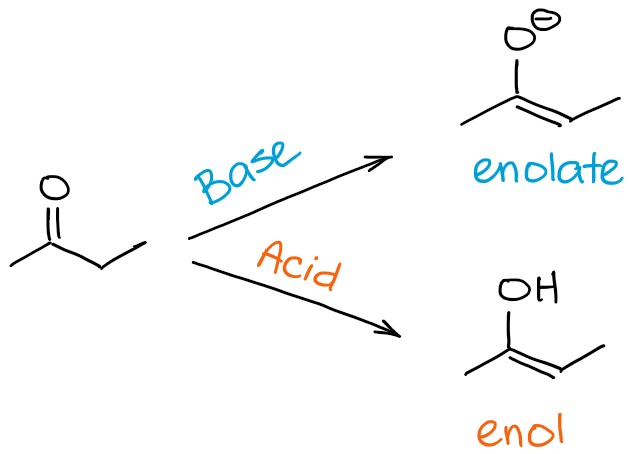
Alors, quelle est la différence entre une énolisation et un processus de tautomérisation céto-énolique ? Une réponse courte est aucune vraiment 😊
Lorsque nous faisons référence à l’énolisation, nous faisons spécifiquement référence au processus qui vous fait passer d’une cétone ou d’un aldéhyde à un énol ou un énolate. Lorsque nous faisons référence à une tautomérie céto-énol, nous parlons de l’équilibre en général. Ainsi, en disant que ma molécule subit la tautomérisation céto-énol, je peux impliquer la direction du processus, mais je ne l’indique généralement pas en soi. La direction de la tautomérisation du céto-énol, cependant, peut souvent être déduite du contexte de la réaction.
En bref, si vous dites que la molécule « A » subit une énolisation, cela signifie que « A » devient un énol ou un énolate. Si vous dites qu’une molécule « B » subit une tautomérisation céto-énol, cela peut signifier une énolisation si B est un carbonyle, ou cela peut signifier un processus inverse si B est déjà un énol ou un énolate.
Énolisation catalysée par une base
Bien que l’énolisation puisse se produire dans des conditions basiques ou acides, l’énolisation catalysée par une base est une façon plus courante de faire cette réaction. Ainsi, je pense que c’est une bonne idée de passer en revue l’énolisation dans des conditions basiques d’abord.
Dans des conditions basiques, une cétone ou un aldéhyde agit comme un acide de Brønsted donnant un proton d’un carbone α à une base dans la solution. Ce processus donne un anion énolate stabilisé par résonance :

Puisque dans cet équilibre notre carbonyle agit comme un acide, il doit être suffisamment acide pour donner le proton. Alternativement, la base doit être suffisamment forte pour conduire cet équilibre vers le produit.
Combien sont acides les hydrogènes sur les carbones α ?
L’anion énolate est une espèce stabilisée par résonance, donc l’étendue de la stabilisation par résonance joue un rôle très important dans l’acidité des composés carbonylés. Nous savons, que plus nous pouvons dessiner de contributeurs de résonance pour la base conjuguée, plus elle est stable. Et plus la base conjuguée est stable, plus l’acide d’origine est acide. Ainsi, les hydrogènes situés entre deux liaisons C=O seront significativement plus acides que ceux situés à côté d’un seul C=O.
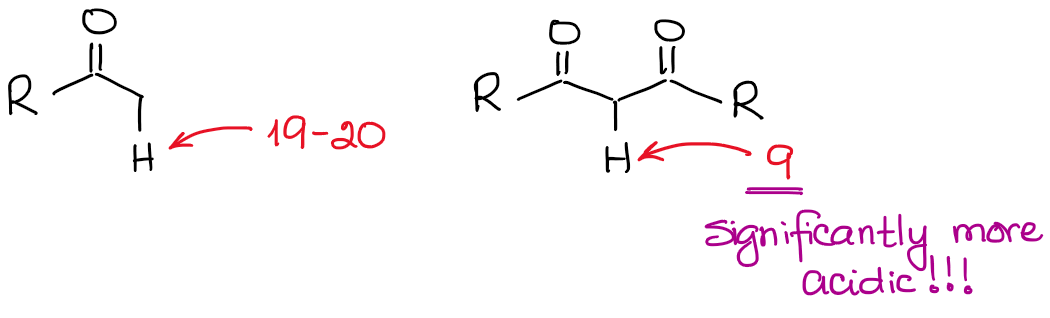
Si nous comparons les bases conjuguées dans les deux cas, nous verrons que le dicarbonyle a une meilleure stabilisation de la résonance de la charge négative grâce à un système conjugué plus étendu.
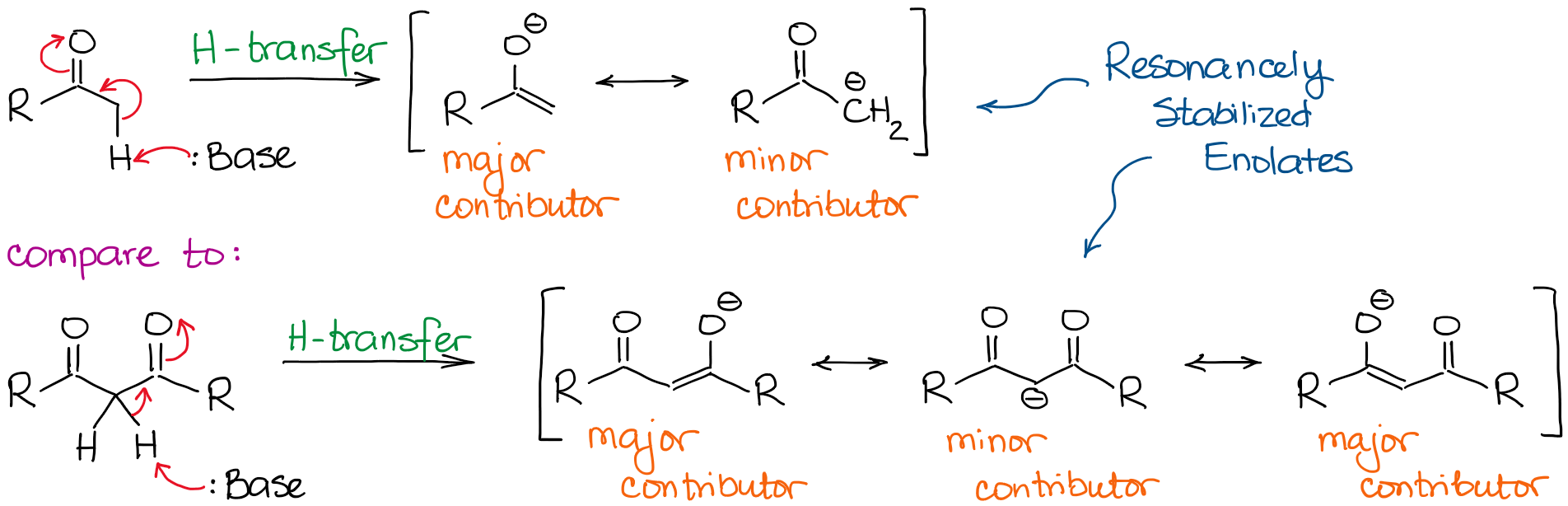
Un contributeur de résonance majeur supplémentaire dans l’anion dicarbonyle rend la molécule environ 10000000000 fois plus acide ! Ainsi, la nature d’une cétone ou d’un aldéhyde est assez claire ici : plus il y a de liaisons C=O à côté d’un hydrogène, plus elle devient acide.
Effet d’une base sur l’équilibre d’énolisation
Les bases ont des forces très différentes. Ainsi, le choix d’une base est important si vous voulez conduire votre équilibre à son terme. Examinons quelques bases que nous voyons généralement dans les réactions de chimie organique :
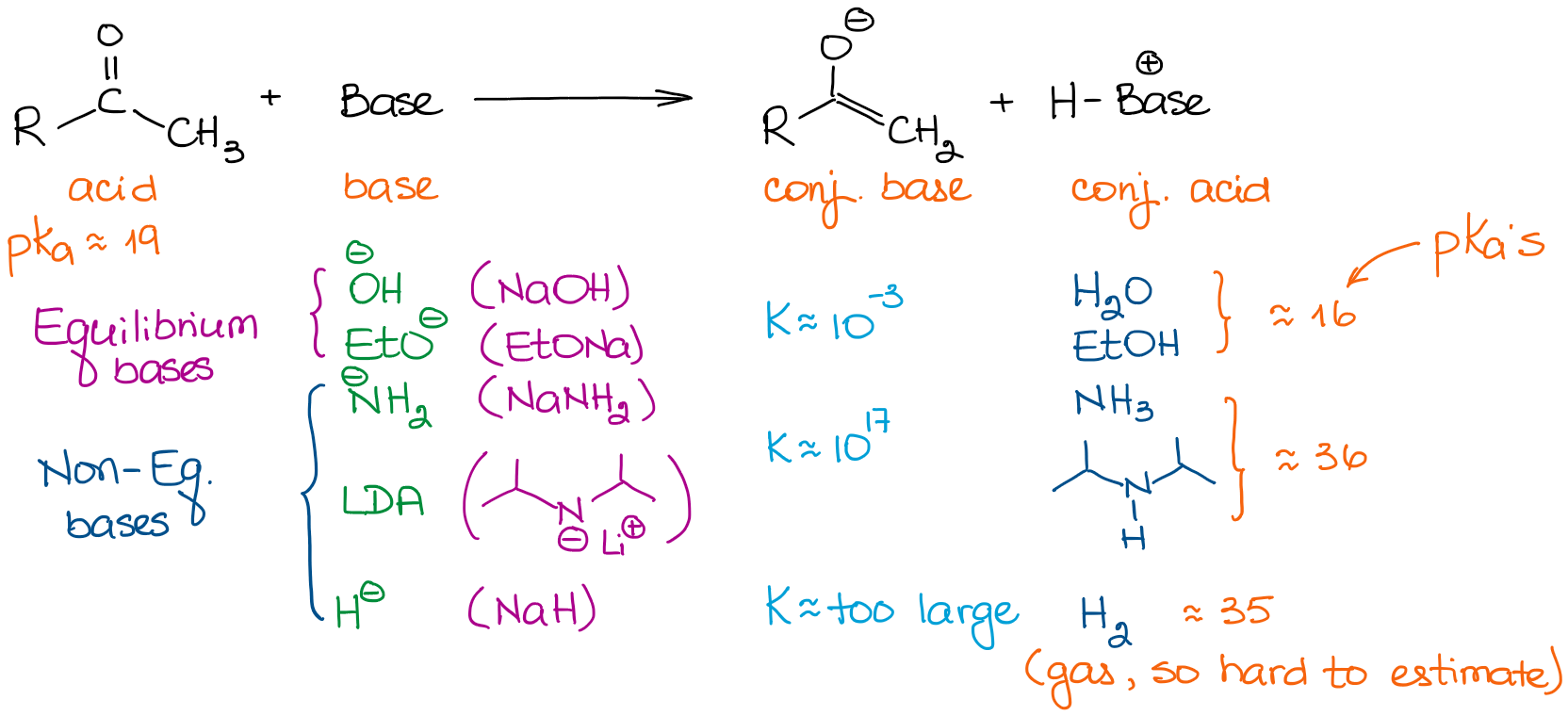
Lorsque nous traitons des aldéhydes et des cétones simples, nous pouvons classer toutes les bases en deux catégories : les bases d’équilibre et les bases de non-équilibre. Les bases d’équilibre sont relativement faibles. Cela signifie qu’elles ne peuvent conduire l’équilibre que dans une mesure très modeste. Ainsi, la concentration réelle d’un énolate dans la solution sera très faible. La réaction sera également en équilibre constant entre le produit de départ et un énolate. Ces bases favorisent la formation d’énolates plus stables sur le plan thermodynamique. Ces énolates sont appelés énolates thermodynamiques.
Les bases hors équilibre, cependant, sont très fortes. Cela conduit à une réaction de transfert de protons (acide-base) avec des constantes d’équilibre très grandes. Quand on a une constante d’équilibre supérieure à 103, l’équilibre est à peu près complètement déplacé vers les produits. Ainsi, une énolisation avec une base comme le LDA donne pratiquement 100% d’énolisation. Ainsi, la concentration de l’aldéhyde initial ou d’une cétone est pratiquement nulle.
Carbonyles avec une liaison C=O vs β-Dicarbonyles
Comme je l’ai mentionné plus haut, les β-dicarbonyles sont significativement plus acides que les aldéhydes et les cétones ordinaires. Examinons une constante d’équilibre dans les deux cas suivants :
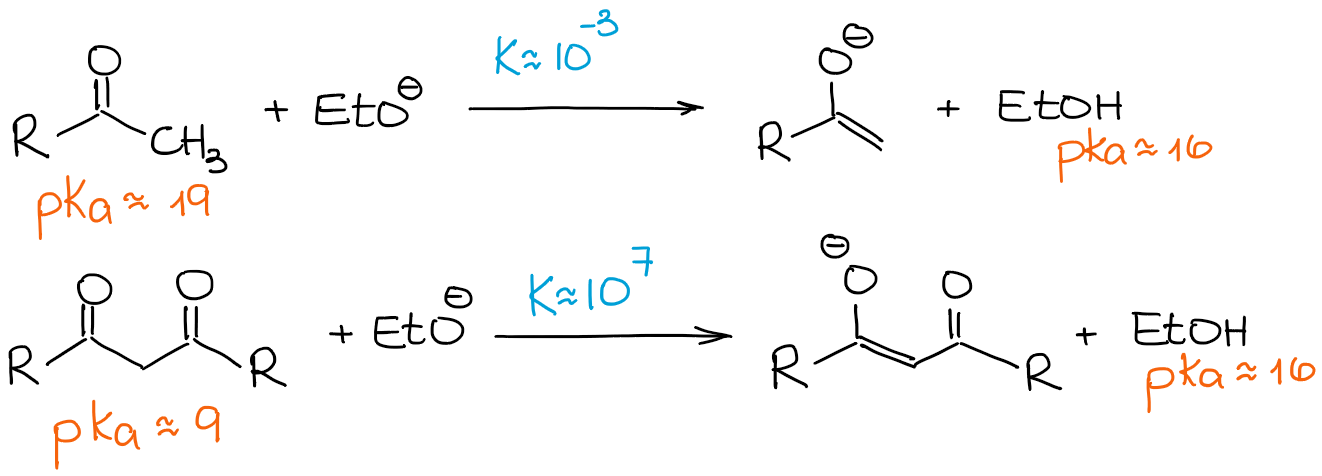
Puisqu’un β-dicarbonyle est tellement plus acide qu’un aldéhyde ou une cétone ordinaire, même une base faible fait pencher l’équilibre vers les produits donnant une énolisation à 100%. Donc, nous allons regarder toute réaction d’énolisation des β-dicarbonyles comme un processus de 100% d’énolate et 0% de matière première, indépendamment d’une base.
Pourquoi le choix d’une base est important ?
Certaines réactions peuvent être très sensibles à ce qui se trouve dans la solution et quelles sont les concentrations des réactifs. Par exemple, les aldéhydes sont électrophiles alors que les énolates sont nucléophiles. Ainsi, si j’utilise une base faible non équilibrée qui laisse une grande partie du produit de départ dans la solution, je peux commencer à voir une réaction indésirable entre un énolate et un aldéhyde initial. En général, on n’utilise les bases faibles à l’équilibre que lorsqu’on ne s’attend pas à une grande compétition entre les produits possibles. Si plusieurs réactions sont possibles et qu’aucun produit majeur ne domine l’équilibre, nous utiliserons toujours des bases fortes hors équilibre.
Bases volumineuses vs petites bases
La taille d’une base peut être un facteur déterminant dans le processus d’énolisation lorsque plusieurs positions énolisables dans une molécule sont en compétition. Examinons l’énolisation de la 2-méthylbutanone par deux bases fortes :
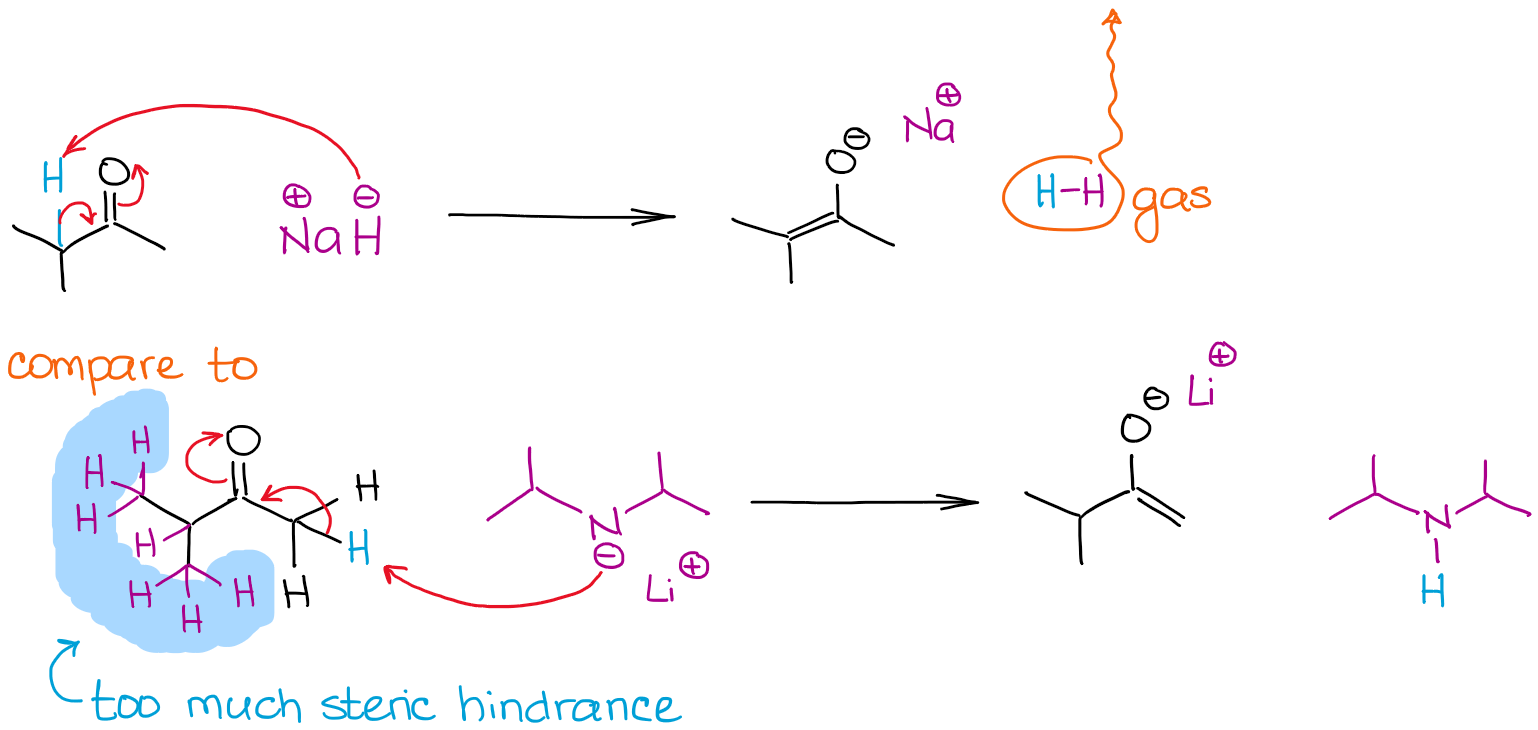
Les deux réactions donnent une énolisation de 100% en raison de l’utilisation de bases très fortes hors équilibre. Cependant, la réaction avec l’hydrure de sodium (NaH) donne un énolate plus stable thermodynamiquement. Contrairement au LDA, l’anion hydrure est très petit et peut donc facilement atteindre un proton plus stériquement encombré et donner un énolate thermodynamique. Le LDA est très volumineux et donc très sensible à tout obstacle stérique. Cela signifie, qu’il va s’attaquer à des hydrogènes énolisables moins encombrés stériquement et plus accessibles.
Nous appelons l’énolate moins stable thermodynamiquement comme dans la réaction avec le LDA un énolate cinétique. C’est également là que l’ordre d’addition des réactifs devient pertinent. Pour obtenir un énolate cinétique, vous devez toujours ajouter un carbonyle à la base, et non l’inverse ! Certains instructeurs sont pointilleux à ce sujet, alors gardez cela à l’esprit.
Enolates thermodynamiques vs cinétiques
À présent, j’ai mentionné les énolates thermodynamiques et cinétiques à quelques reprises, alors je pense que ce serait une bonne idée de les revoir un peu plus en détail.
Qu’est-ce qui compte exactement pour la stabilité thermodynamique d’un énolate ?
Les principaux contributeurs à la résonance énolate ont une charge négative sur l’atome d’oxygène et une double liaison C=C.
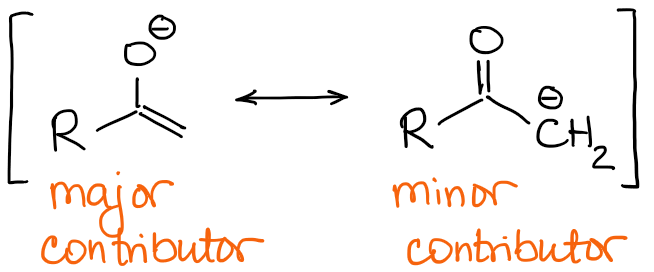
Donc, la nature de la double liaison sera la principale différence entre les énolates. Si l’on reprend l’exemple avec la 2-méthylbutanone du dessus, on peut voir que les deux énolates possibles ont une double liaison qualitativement différente :

Toujours regarder le nombre de substituants sur votre double liaison. Plus vous avez de substituants sur une double liaison, plus elle est stable. Ainsi, l’énolate thermodynamique aura toujours la double liaison la plus occupée.
Un énolate cinétique est celui qui se forme plus rapidement. Pensez à la réaction avec le LDA. Le LDA est une base très forte hors équilibre. Dès qu’elle arrache le proton, elle ne va pas le rendre. C’est aussi une base très volumineuse et elle ne peut pas saisir un hydrogène au milieu de la molécule. Donc, elle va s’attaquer à celui qui est le plus accessible stériquement. Ainsi, une base comme la LDA arrache un proton rapidement, à partir d’un site moins stériquement encombré, et ne le rend pas ou permet l’équilibre donnant un énolate moins stable.
Pourquoi est-il important d’ajouter un carbonyle à une base pour faire un énolate cinétique ?
Si vous voulez un énolate cinétique, votre base doit toujours être en excès. Les énolates sont eux-mêmes des bases ! Donc, si vous avez un carbonyle en excès, alors l’énolate peut rapidement établir un équilibre avec lui.
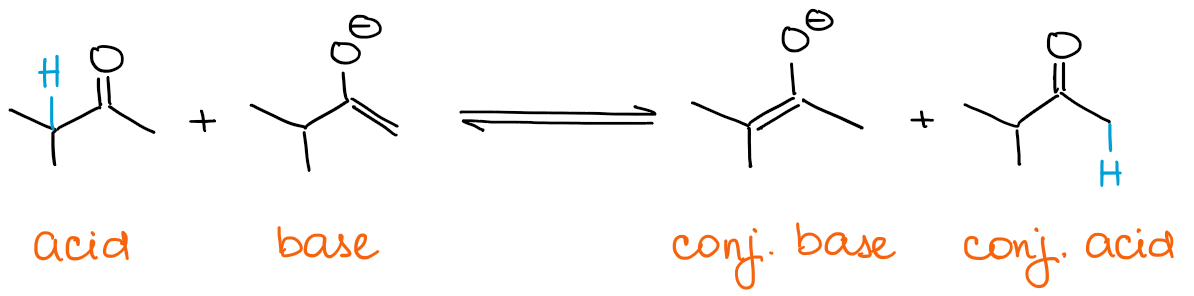
Tout équilibre favorisera toujours les espèces les plus stables thermodynamiquement. Cela signifie que vous obtiendrez toujours un énolate thermodynamique si vous avez un excès de carbonyle et non de base.
Donc, souvenez-vous que :
Les bases fortes faibles et petites = énolate thermodynamique
Les bases fortes volumineuses = énolate cinétique
L’utilisation de cette simple règle empirique vous aidera à déterminer quel énolate vous aurez ou devrez fabriquer dans votre réaction.
Enolisation catalysée par les acides
Au tout début de ce post, j’ai mentionné que l’énolisation est également possible dans des conditions acides. Comme les aldéhydes et les cétones ne sont pas particulièrement basiques, vous voulez utiliser un acide très fort pour catalyser ce processus. Typiquement, on utilise des acides sulfurique ou tosylique comme catalyseurs.
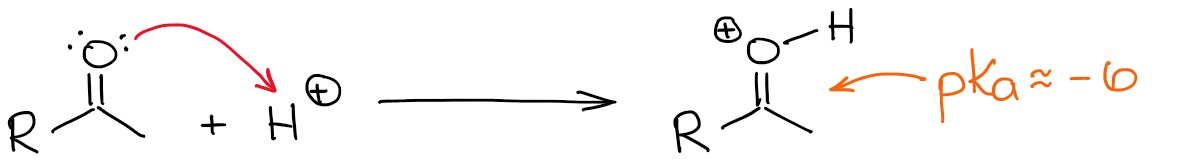
L’hydrogène le plus acide dans un carbonyle protoné est bien sûr celui de l’oxygène. Cependant, rendre une liaison C=O plus polarisée en lui ajoutant un proton, rend la position α plus acide également. Il est donc maintenant un peu plus facile de déprotoner la position α et de fabriquer un énol.
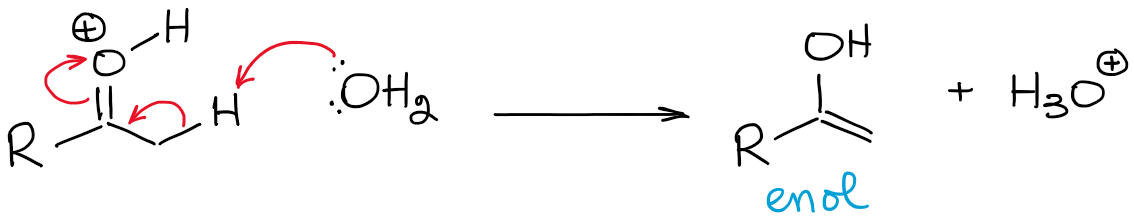
Cet équilibre est extrêmement défavorable et favorise globalement le carbonyle. Ainsi, vous n’aurez jamais une concentration élevée d’un énol dans des conditions acides, à moins qu’il y ait une sorte d’effet de stabilisation rendant l’énol favorable (rare).
Bien que tous les produits énol possibles puissent être produits, cette réaction favorisera toujours la formation d’un énol thermodynamique.
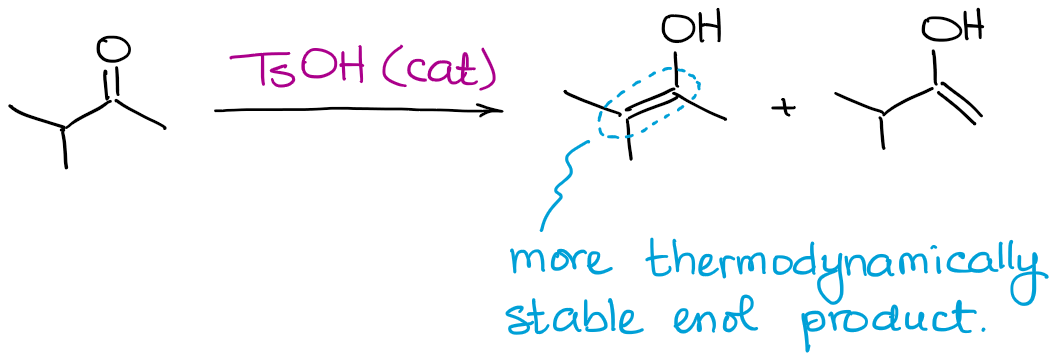
Comme dans le cas des énolates, un énol thermodynamique est celui qui a le plus de substituants sur la double liaison.
Quels facteurs influencent l’énolisation catalysée par un acide ?
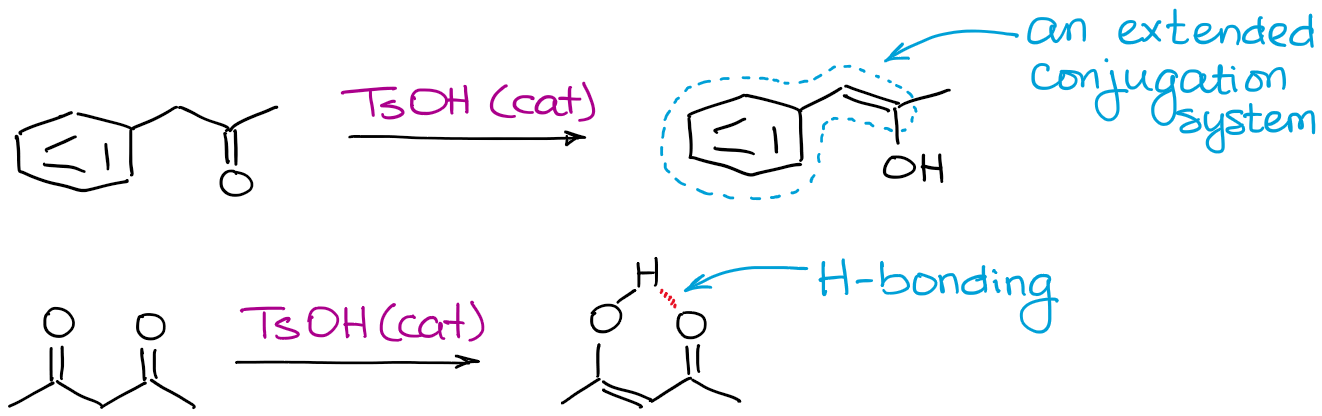
Tout ce qui peut rendre un énol plus stable favorisera l’équilibre. Les facteurs les plus courants sont la liaison hydrogène et la conjugaison étendue.
Pourquoi s’embêter avec l’énolisation catalysée par l’acide ?catalysée par un acide si elle présente tant de problèmes ?
Votre composé pourrait être sensible aux bases. De plus, il pourrait être plus facile de combiner plusieurs étapes lorsqu’elles se produisent dans les mêmes conditions. Nous combinons souvent l’énolisation catalysée par les acides avec d’autres étapes d’une réaction qui se produisent également dans des conditions acides.
Vous devez cependant garder à l’esprit que les groupes attracteurs d’électrons à proximité d’un carbonyle le rendront encore moins basique qu’il ne l’est déjà. Ainsi, si vous avez, par exemple, un halogène en position α, il sera vraiment difficile de forcer la formation d’un énol.

Vérifiez toujours la présence de GTE en position α-avant de supposer toute formation d’énol ! Tout GFE qui n’offre pas de stabilisation de résonance à la double liaison défavorisera considérablement le processus d’énolisation.
À quoi s’attendre à l’examen ?
Les professeurs posent rarement des questions ciblant spécifiquement la formation d’énols ou d’énolates directement. Les questions sur l’énolisation seront toujours déguisées en quelque chose d’autre. Les questions d’énolisation sont généralement formulées comme suit :
- Trouver l’hydrogène le plus acide dans la molécule suivante… ou
- Dessiner le produit… (la réaction aura un énol ou un énolate comme intermédiaire)
Bien sûr, ils pourraient poser une question directe. Cependant, d’après mon expérience, la tautomérisation céto-énol et les énolisations sont généralement le concept sous-jacent qui motive une certaine question.