La protéine du mois
Novembre 2006
Plus sur la protéine du mois |
|
AUTRES PROTEINES D’INTERET INTEREST |
|
Molécule du mois : Fibrine |
|
ExPASy Protein Spotlight |
La coagulation du sang, ou coagulation, est une réponse rapide aux lésions tissulaires, où l’exposition des cellules contenant le facteur tissulaire dans la circulation sanguine par des lésions des parois des vaisseaux initie un système rapide de cascades. Cette cascade enzymatique utilise une série d’enzymes qui travaillent en succession rapide pour amplifier une petite réponse en une grande réponse au site de la lésion (voir Figure 1). Une fois activé, le facteur tissulaire (TF) se lie au facteur VII (FVII) et l’active, initiant ainsi la cascade. Le TF/FVII est activé par autoclivage en TF/FVIIa, qui, avec le cofacteur FVIIIa, convertit le FIX en FIXa ; le FXa peut ensuite convertir le FX en FXa, qui, avec le cofacteur FVa, convertit le FII (prothrombine) en FIIa (thrombine) ; enfin, le FIIaconvertit le fibrinogène en fibrine, ce qui entraîne le dépôt de fibrine et l’activation des plaquettes pour former des caillots sanguins. L’activation du FXIII en FXIIIa peut stabiliser ces caillots sanguins en les réticulant.
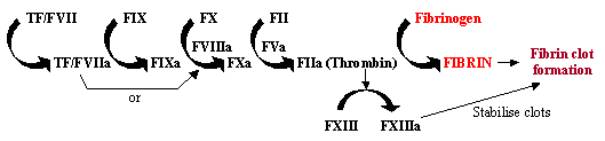
Figure 1. Cascade de coagulation du sang
Fibrinogène, fin de la cascade de coagulation
Le fibrinogène a été isolé pour la première fois du plasma de cheval par Hammarsten en 1876, bien qu’un précurseur inactif de la fibrine ait été proposé dès 1859 par Deni deCommercy. Le fibrinogène peut subir une transformation marquée, passant de monomères solubles (fibrine) à un polymère insoluble (fibrine polymérisée).
Le fibrinogène est une plasmaglycoprotéine synthétisée dans le foie, essentielle à l’hémostase (arrêt de la perte de sang des tissus endommagés), à la cicatrisation des plaies, à la fibrinolyse, à l’inflammation, à l’angiogenèse, aux interactions cellulaires et matricielles et à la néoplasie. Ces processus impliquent la conversion du fibrinogène en fibrine, et souvent l’interaction de la fibrine (ogène) avec diverses protéines et cellules. Les gens portent habituellement environ 2,5 g de fibrinogène/L de sang, cependant, les concentrations de fibrinogène peuvent augmenter jusqu’à 200-400% pendant les périodes de stress physiologique (principalement en raison des actions de l’interleukine-6 dérivée des macrophages).
Le fibrinogène est une glycoprotéine complexe de grande taille composée de trois paires de polypeptides : deux Aa, deux Bb et deux g. Ces polypeptides sont reliés entre eux par 29 liaisons disulfures,dont certaines sont représentées sur la figure 2 ci-dessous. Les polypeptides sont orientés de façon à ce que les six extrémités N-terminales se rejoignent pour former le domaine E central. Deux régions d’hélices alpha enroulées s’étendent de part et d’autre du domaine E, chacune étant constituée d’un polypeptide Aa, d’un polypeptide Bb et d’un polypeptide G. Chaque région d’hélices enroulées se termine par une extrémité de l’hélice. Chaque région d’hélices enroulées se termine par un domaine D globulaire constitué des extrémités C-terminales de Bb et g, ainsi que d’une partie de Aa. L’extrémité C-terminale de Aa dépasse ensuite de chaque domaine D sous forme de long brin ; ces protubérances de Aa peuvent interagir entre elles et avec le domaine E pendant la réticulation du caillot de fibrine. Les domaines E et D contiennent tous deux des sites de liaison importants pour la conversion du fibrinogène en fibrine, pour l’assemblage et la réticulation de la fibrine et pour l’agrégation plaquettaire. Les ions calcium liés sont importants pour aider à maintenir la structure du fibrinogène.
Les extrémités N-terminales des polypeptides Aa et Bb sont clivées par la thrombine afin de transformer le fibrinogène soluble en fibrine gélifiante. Une fois clivées du fibrinogène, les extrémités N-terminales sont connues sous le nom de fibrinopeptide A (d’après Aapolypeptide) et de fibrinopeptide B (d’après Bbpolypeptide).
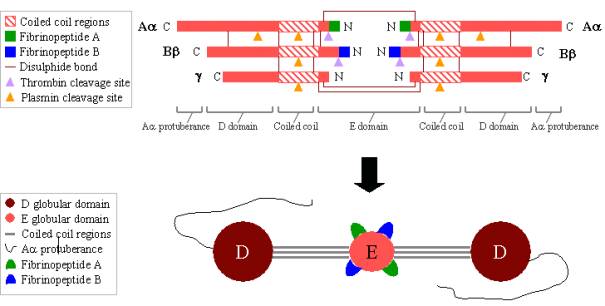
Figure 2. Fibrinogène:
TOP – organisation polypeptidique du fibrinogène.
BOTTOM – organisation des domaines du fibrinogène.
Formation du caillot sanguin
Pour former un caillot sanguin, le fibrinogène doit d’abord être clivé par la thrombine pour éliminer les fibrinopeptides. L’élimination des fibrinopeptides A et B des extrémités N-terminales de Aa et Bb expose des « boutons » sur le domaine E, qui peuvent interagir avec les « trous » toujours présents sur les domaines D. Les molécules de fibrine peuvent se lier aux molécules de fibrinogène. Les molécules de fibrine peuvent se lier entre elles par l’interaction du domaine E d’une molécule de fibrine avec les domaines D de quatre autres molécules de fibrine, se polymérisant ainsi pour former des oligomères décalés qui se transforment en protofibrilles. Au fur et à mesure que les oligomères de fibrine s’agrègent, ces protofibrilles continuent de s’allonger pour former de longues fibres qui peuvent s’enrouler les unes autour des autres pour former des faisceaux épais et multibrins, et qui peuvent se ramifier en un réseau tridimensionnel de fibres enchevêtrées, le caillot de fibrine. Le caillot de fibrine est ensuite stabilisé par le facteur XIIIa, une transglutaminase, où la forme zymogène du facteur XIII est convertie en facteur XIIIa actif sous l’action de la thrombine (voir figure 1). Le facteur XIII réticule les résidus de glutamine d’une molécule de fibrine aux résidus de lysine d’une autre molécule de fibrine en formant de fortes liaisons isopeptidiques. Cette réticulation se produit entre les extrémités C-terminales (protubérances Aa) des polypeptides Aa, ainsi que (plus lentement) à d’autres endroits, par exemple entre les extrémités C-terminales des chaînes g. Ces liaisons croisées contribuent à renforcer la fibrine. Ces liaisons croisées contribuent à renforcer le caillot de fibrine, le rendant plus résistant aux dommages physiques et chimiques.
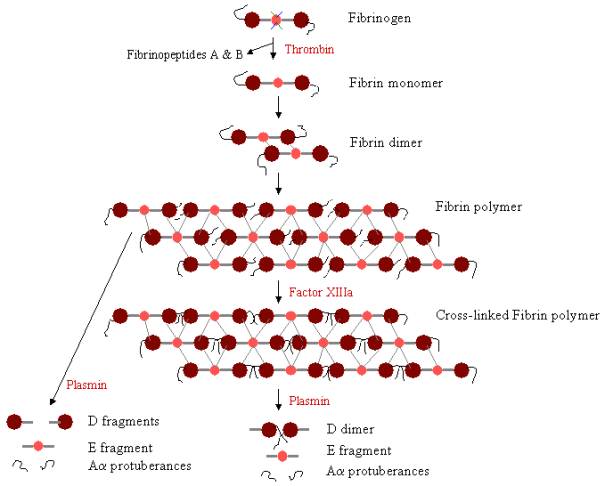
Figure 3. Polymérisation et lyse de la fibrine : Voie de polymérisation et de lyse de la fibrine. Les boutons du domaine E se lient aux trous de jusqu’à quatre domaines D (lignes grises), formant un long treillis fibreux. Le caillot est ensuite stabilisé par réticulation. Le caillot peut être dégradé, donnant différents produits de dégradation s’il a été réticulé.
.