Karthish Manthiram rêve d’un avenir électrifié. L’ingénieur chimiste du MIT fait partie d’un groupe croissant de chercheurs qui explorent les moyens par lesquels l’électrochimie alimentée par les énergies renouvelables pourrait remplacer les combustibles fossiles comme base de l’industrie chimique.
‘La vision globale est de penser à un avenir dans lequel la fabrication chimique commence avec seulement du dioxyde de carbone, de l’eau et de l’azote’, dit Manthiram. ‘Si nous commençons avec ces trois matières premières, et que nous avons de l’électricité renouvelable, alors nous pouvons envisager d’utiliser le dioxyde de carbone comme source d’atomes de carbone, d’utiliser l’eau pour les oxygènes et les hydrogènes, et le diazote comme source d’azote, et commencer à coudre ensemble des molécules organiques relativement complexes’, dit-il.
Dans ce monde futur dont nous rêvons, nous pourrions fabriquer de l’ammoniac à partir de l’air, de l’eau et de l’électricité renouvelable uniquement
L’ammoniac figure en tête de liste des molécules que les chercheurs en électrochimie veulent fabriquer de cette manière. Ingrédient clé des engrais de synthèse, environ 175 millions de tonnes d’ammoniac sont produites chaque année. Mais les vastes quantités dans lesquelles il est fabriqué, et la nature énergivore de sa production, signifie que les usines d’ammoniac consomment environ 2 % de la production mondiale d’énergie, et produisent une proportion similaire des émissions mondiales de dioxyde de carbone.
Avec la disponibilité rapidement croissante de l’électricité renouvelable, les chercheurs peuvent voir une voie alternative pour l’ammoniac. Dans ce monde futur dont nous rêvons, nous pourrions produire de l’ammoniac à partir de l’air, de l’eau et de l’électricité renouvelable », explique Manthiram. Cette année, le laboratoire de Manthiram a rejoint la poignée de laboratoires dans le monde à avoir montré définitivement que, lorsqu’elle est médiée par un électrocatalyseur au lithium, l’ammoniac pourrait être fabriqué de cette façon.
Dans un jeune domaine de recherche où les premières affirmations de production électrochimique d’ammoniac n’ont souvent pas résisté à l’examen, la poignée de résultats robustes impliquant la production d’ammoniac médiée par le lithium pourrait constituer la base solide à partir de laquelle un avenir propre de l’ammoniac commence à être construit.
Le mal de tête de la scission
Le grand défi de la synthèse de l’ammoniac, électrochimique ou autre, est la nécessité de prendre du diazote dans l’air, et de le casser en deux. La triple liaison qui maintient les deux atomes d’azote ensemble est l’une des plus fortes connues.
Depuis un siècle, les usines d’ammoniac ont surmonté la réticence du diazote à réagir via un processus en deux étapes. Dans la première étape, la réaction de reformage du méthane à la vapeur, l’eau et le méthane sont chauffés sur un catalyseur qui encourage l’échange de partenaires atomiques, produisant un flux de dioxyde de carbone et d’hydrogène. L’hydrogène est ensuite mis à réagir avec de l’azote sur un catalyseur en fer dans le procédé Haber-Bosch, nommé d’après les chimistes allemands Fritz Haber qui a inventé la réaction, et Carl Bosch qui l’a affinée pour l’industrie.
Une grande partie de notre inégalité dans l’accès à la nourriture dans le monde remonte au fait que la production d’ammoniac est centralisée
Ce que Haber a découvert était un moyen de contourner le problème qui, Ce qu’Haber a découvert, c’est un moyen de contourner le problème suivant : aux hautes températures nécessaires pour séparer le diazote, l’équilibre pour la formation de l’ammoniac se situe loin sur la gauche, explique Ib Chorkendorff, chercheur en catalyse à l’Université technique du Danemark et directeur du Centre Villum pour la science des carburants et des produits chimiques durables. La grande invention de Haber a été de réaliser que vous n’obtiendrez pas d’ammoniac à moins de le mettre sous pression », explique M. Chorkendorff. Si vous prenez quatre moles de gaz et que vous les transformez en deux, la pression est d’une grande aide ». Aujourd’hui, les usines Haber Bosch fonctionnent généralement à des pressions supérieures à 200 atmosphères.
Le dioxyde de carbone stœchiométrique que la réaction produit, ainsi que les émissions de carbone impliquées dans la génération des hautes températures et pressions requises, est une raison impérieuse de chercher une approche alternative. Mais même si le dioxyde de carbone n’était pas un gaz piégeant les infrarouges et entraînant un réchauffement de la planète, le processus poserait toujours problème », explique Manthiram. ‘Les températures et les pressions vraiment élevées signifient qu’il n’est tout simplement pas possible de réaliser cette réaction de manière distribuée.’
Le coût de construction des réacteurs à haute pression fait pencher l’équilibre économique fortement vers la construction de très grandes usines d’ammoniac centralisées. Une grande partie de l’inégalité de l’accès à la nourriture dans le monde est due au fait que la production d’ammoniac est centralisée », explique Manthiram. En Afrique subsaharienne, l’infrastructure de distribution est si pauvre que l’engrais finit par coûter deux à trois fois plus cher que la moyenne internationale. Cela limite son utilisation, ce qui entraîne un faible rendement des cultures, la faim, une baisse de la productivité de la main-d’œuvre, une baisse des revenus, ce qui limite encore plus la capacité de payer l’engrais. C’est un énorme problème à résoudre.’
L’ammoniac fabriqué à partir d’air, d’eau et d’électricité renouvelable, à des températures et des pressions ambiantes, pourrait être fabriqué partout où il est nécessaire.
Sentir l’attraction des énergies renouvelables
Les chercheurs tentent depuis des décennies de trouver des alternatives plus vertes à la réaction de Haber-Bosch. La différence cette fois-ci est l’évolution rapide du marché de l’énergie, explique Doug MacFarlane, chimiste à l’université Monash qui dirige le centre d’excellence du Conseil australien de la recherche pour la science des électromatériaux. Au cours des dix dernières années environ, des quantités croissantes d’énergie renouvelable de moins en moins chère sont devenues disponibles », explique Doug MacFarlane. Depuis 2010, le prix de l’énergie solaire a chuté de 80 %, et celui de l’énergie éolienne de 50 %, avec la perspective de nouvelles baisses. ‘Cela a mis l’accent sur les technologies électrochimiques très largement, en utilisant les électrons comme réducteur ultime’, dit-il.

Source : Avec l’aimable autorisation du Science and Technology Facilities Council
Le démonstrateur d’ammoniac vert de Siemens Energy au Royaume-Uni teste la division de l’eau et la chimie de Haber-Bosch
Le laboratoire de MacFarlane – comme de nombreux laboratoires de synthèse électrochimique – s’est d’abord concentré sur la chimie de division de l’eau alimentée par les énergies renouvelables, afin de produire un flux d’hydrogène propre qui pourrait être utilisé comme matière première ou comme carburant. La deuxième vague de recherche a porté sur la réduction du dioxyde de carbone, afin de transformer les émissions de carbone en produits utiles, explique-t-il. Dans la foulée, il y a environ six ans, nous avons commencé à réaliser que nos recherches avaient une troisième perspective, à savoir la réduction de l’azote », explique M. MacFarlane. Ce sont les mêmes idées, le même matériel de laboratoire, mais un substrat et un produit cible différents. Plutôt que de l’hydrogène, la cellule produirait un flux d’ammoniac.
La production d’ammoniac pourrait aller bien au-delà de l’utilisation d’engrais. La chute des prix de l’électricité sous l’impulsion des énergies renouvelables a déjà incité à repenser la réaction traditionnelle de reformage à la vapeur (voir encadré Reformage électrique ci-dessous). Des pays comme l’Australie, qui disposent de ressources solaires et éoliennes bien au-delà de leurs propres besoins, lorgnent sur l’ammoniac synthétisé par voie électrochimique, non seulement pour la production d’engrais plus propres, mais aussi comme carburant vert qui pourrait permettre l’exportation d’énergie renouvelable.
En mai 2020, MacFarlane et ses collègues ont publié une feuille de route exposant la voie potentielle vers une économie verte de l’ammoniac. Le concept de première génération, l’idée de combiner la production conventionnelle d’ammoniac avec la capture du carbone, est déjà supplanté par une approche de deuxième génération, dans laquelle l’hydrogène pour Haber-Bosch provient d’un fractionnement électrochimique de l’eau alimenté par des énergies renouvelables, plutôt que d’un reformage à la vapeur alimenté par le méthane.
Après des décennies de recherche, le fractionnement électrochimique de l’eau a atteint le point où des fractionneurs d’eau à l’échelle industrielle deviennent disponibles, de la part de sociétés comme ITM-Power au Royaume-Uni et Siemens en Allemagne. Siemens a déjà testé le concept de combinaison du fractionnement de l’eau et du procédé Haber-Bosch dans le cadre du Siemens Green Ammonia Demonstrator dans l’Oxfordshire. Dans la région de Pilbara, en Australie occidentale, qui reçoit une énergie solaire annuelle parmi les plus élevées de la planète, Yara Fertilisers se prépare également à expérimenter le changement. Cette usine produit actuellement 5 % de l’ammoniac mondial.
Le principal obstacle à une large adoption de la production d’ammoniac de deuxième génération n’est plus le coût de l’électricité renouvelable, affirme MacFarlane. L’obstacle est le coût d’investissement des cellules d’électrolyse, dit-il. Les électrodes les plus performantes pour la scission de l’eau utilisent des métaux précieux.
Réformage électrique
La première étape de la synthèse conventionnelle de l’ammoniac consiste à générer l’hydrogène qui sera combiné au diazote pour produire de l’ammoniac. Aujourd’hui, cet hydrogène provient du méthane, via la réaction de reformage à la vapeur, entraînée par un ensemble de brûleurs à gaz entourant les tubes recouverts de catalyseur dans lesquels la réaction a lieu.
La quantité de catalyseur peut être réduite d’un ordre de grandeur
Le reformage à la vapeur est tellement endothermique, qu’il génère un gradient de température important à l’intérieur du tube, ce qui peut entraîner l’accumulation de carbone à la surface du catalyseur et le blocage, voire la rupture du tube.
En 2019, Chorkendorff a montré que la réaction pouvait être conduite beaucoup plus efficacement par un chauffage ohmique. Faire passer un courant électrique dans le tube en acier du reformeur de vapeur génère de la chaleur in situ, en raison de la résistivité électrique. ‘Nous obtenons un contact très étroit entre la source de chaleur et le catalyseur, ce qui élimine tous les problèmes de transport de chaleur et nous n’avons aucun gradient de température’, explique Chorkendorff.
A part éviter le dépôt de carbone, le chauffage ohmique offre de nombreux avantages, ajoute Chorkendorff. Le démarrage d’une installation de reformage à la vapeur prend habituellement environ une semaine, mais le système à chauffage ohmique prend environ deux minutes. La quantité de catalyseur peut être réduite d’un ordre de grandeur, et la taille de l’installation de deux ordres de grandeur », ajoute-t-il. Auparavant, le coût de l’électricité rendait le chauffage ohmique prohibitif, mais avec les énergies renouvelables, ce n’est plus le cas, affirme M. Chorkendorff. La société avec laquelle Chorkendorff s’est associé pour mener à bien cette recherche travaille déjà sur une usine pilote, et a des projets pour le chauffage ohmique bien au-delà du reformage à la vapeur, dit-il.
Réduire les coûts
Trouver des alternatives moins coûteuses aux électrodes de platine et d’iridium a été un objectif à long terme du laboratoire de Chorkendorf. En 2005, l’équipe a montré que le sulfure de molybdène constitue un électrocatalyseur puissant pour la réaction d’évolution de l’hydrogène. La partie catalytiquement active du MoS2 s’est avérée se trouver le long des bords du catalyseur, plutôt que sur sa surface plane, ce qui a suscité de nombreuses recherches pour développer des matériaux MoS2 nanostructurés ou en couches qui maximisent la proportion de bords.
Nous savons qu’un catalyseur OER doit être un oxyde et qu’il doit être stable à des pH extrêmes
‘Nous avons beaucoup étudié l’évolution de l’hydrogène, mais nous considérons que c’est résolu – il existe de très bons catalyseurs’, dit Chorkendorff. Le véritable problème est la perte d’énergie due à l’évolution de l’oxygène », affirme-t-il. Les cellules de fractionnement de l’eau produisent de l’hydrogène à la cathode et de l’oxygène à l’anode (voir encadré Entre-temps, à l’anode ci-dessous). Un faible rendement du côté de la réaction d’évolution de l’oxygène (REO) du séparateur d’eau rend l’ensemble du processus plus énergivore et plus coûteux à exploiter. ‘Aujourd’hui, ils fonctionnent avec une efficacité de 70 % maximum, mais normalement pas aussi élevée.’
Malgré des années de travail, la percée du catalyseur OER reste à venir. ‘Rien ne dit que nous ne pouvons pas trouver un matériau, mais nous savons que cela se resserre – nous savons qu’il doit s’agir d’un oxyde, qu’il doit être stable soit dans un acide fort, soit dans une solution alcaline forte’, dit Chorkendorff. Les électrolyseurs fonctionnent à l’un ou l’autre extrême de l’échelle de pH pour maximiser l’efficacité, mais les catalyseurs OER les plus actifs ne sont pas assez stables dans ces conditions pour une utilisation pratique à long terme.
Un concept, introduit par Daniel Nocera, alors au Massachusetts Institute of Technology aux États-Unis, est celui des catalyseurs OER auto-guérissables, qui se forment in situ et se régénèrent continuellement à partir des ions métalliques de l’électrolyte. Les électrocatalyseurs de Nocera ont fonctionné dans des conditions neutres. En 2019, MacFarlane et ses collègues ont démontré un catalyseur OER d’oxyde métallique mixte généré in situ et auto-cicatrisant pour des conditions fortement acides.
En attendant, à l’anode
Pour la plupart des processus électrochimiques – fabrication d’hydrogène ou d’ammoniac, ou réduction du dioxyde de carbone – tous les regards sont tournés vers la cathode. La réaction complémentaire qui a lieu à l’anode est un processus oxydatif qui génère généralement de l’oxygène, un sous-produit inoffensif de l’événement principal.
« Beaucoup de gens considèrent l’oxygène comme un simple déchet », dit Chorkendorff. Mais il existe des utilisations potentiellement précieuses pour ce gaz. Un flux d’oxygène pur est la clé du concept des centrales électriques oxyfuel, qui contournent les problèmes de capture du carbone en brûlant le combustible dans l’oxygène plutôt que dans l’air. ‘Si vous brûlez de la biomasse dans une centrale électrique avec cet oxygène, vous obtenez une qualité de dioxyde de carbone beaucoup plus élevée’, dit Chorkendorff.
Manthiram voit également de la valeur dans la réaction anodique. ‘Nous avons travaillé sur des méthodes par lesquelles vous pouvez utiliser cet oxygène pour la synthèse chimique, au lieu d’essayer de combiner deux atomes d’oxygène pour faire du dioxygène, ce qui est cinétiquement difficile à faire.’ Grâce à des travaux antérieurs, l’équipe savait que l’oxyde de manganèse est un catalyseur qui oxyde l’eau, générant une espèce oxo de manganèse dans le processus. Et si nous pouvions intercepter ce processus en utilisant une oléfine, pour fabriquer un époxyde ? demande Manthiram. C’était une pure conjecture, mais d’une manière ou d’une autre, cela a fonctionné ». En plus de produire des époxydes, l’équipe a montré qu’elle pouvait insérer de l’oxygène dans une liaison carbone-carbone pour produire des lactones. Cela pourrait rendre l’électrolyseur d’eau plus viable économiquement », dit Manthiram. ‘Il n’y a aucun moyen de produire tout l’hydrogène du monde de cette façon – nos besoins en hydrogène sont bien trop importants – mais nous pourrions produire un peu d’hydrogène vraiment bon marché tout en cocréant des lactones qui entrent dans la fabrication de plastiques biodégradables à haut volume, ou des époxydes à haut volume pour fabriquer de l’éthylène glycol.’
Sources peu fiables
La scission de l’eau restant à perfectionner, et sa dépendance continue à la réaction de Haber-Bosch, l’espoir est que la production d’ammoniac vert de deuxième génération soit un tremplin vers l’objectif ultime de produire de l’ammoniac directement par voie électrochimique. Plutôt que de produire du gaz dihydrogène, les atomes d’hydrogène et d’azote pourraient être combinés in situ à la cathode pour fabriquer de l’ammoniac.
Le principal défi consiste à trouver des moyens de favoriser la production d’ammoniac plutôt que la formation de dihydrogène, explique Manthiram. ‘Le réservoir d’électrons à la cathode pourrait réagir avec deux protons en solution pour produire de l’hydrogène ; ou au contraire réagir avec l’azote pour briser la triple liaison, et également recruter six protons, pour produire deux molécules d’ammoniac’, explique Manthiram. ‘Pratiquement n’importe quel catalyseur aura tendance à produire plus d’hydrogène que d’ammoniac.’
Au cours des cinq dernières années environ, un flot d’articles est apparu qui semblait montrer des catalyseurs capables de produire un peu d’ammoniac dans le flux gazeux à prédominance d’hydrogène produit à la cathode. Pendant ce temps, le laboratoire de MacFarlane testait l’idée qu’un bon moyen de supprimer la production d’hydrogène serait d’éliminer une source importante de protons – l’électrolyte. En passant à un électrolyte liquide ionique aprotique, puis en ajoutant simplement la quantité contrôlée d’eau, d’acide ou de base, l’équipe a montré qu’elle pouvait favoriser la production d’ammoniac.
Virtuellement, n’importe quel catalyseur aura tendance à produire plus d’hydrogène que d’ammoniac
‘Le travail aprotique est assez agnostique sur le catalyseur, donc notre approche était toujours de l’appliquer au meilleur catalyseur que nous pouvions trouver’, dit MacFarlane. Chaque fois qu’un article sur un nouveau catalyseur était publié, nous essayions rapidement de répéter le travail de la littérature, puis de l’appliquer à notre travail aprotique. Dans certains cas, après avoir discuté avec les auteurs concernés, nous n’avons jamais réussi à faire fonctionner correctement un catalyseur issu de la littérature. Nous avons fini par devenir des experts de ce qui ne fonctionne pas.’
Bien que la transformation de l’azote en ammoniac soit très difficile, il est trop facile de produire des traces d’ammoniac à partir d’autres sources d’azote. La longue liste des sources possibles d’azote fortuit comprend l’électrode, ou des traces de NO ou de NO2 dans l’alimentation en azote gazeux. Enlevez ou tenez compte de ces sources, et la quantité d’azote convertie en ammoniac par la plupart des systèmes catalytiques est si faible qu’elle ne présente aucun intérêt pratique, affirme MacFarlane.
‘ a été un énorme partisan de la détermination de l’origine réelle de l’ammoniac et de la question de savoir si le catalyseur fait vraiment le travail’, explique Lauren Greenlee, de l’université de l’Arkansas aux États-Unis, qui a été l’un des premiers à travailler sur la production électrocatalytique d’ammoniac, et l’un des premiers à souligner que l’ammoniac fortuit était une préoccupation majeure. ‘Convertir directement le diazote en deux molécules d’ammoniac à la surface du catalyseur est tout simplement un problème très difficile, et je ne sais pas si nous sommes si près de le résoudre.’
Pour l’instant, Greenlee s’est retiré des expériences de production d’ammoniac pour mener des recherches plus fondamentales sur le problème. ‘Nous nous sommes intéressés à la chimie de l’électrolyte, et à travailler pour comprendre la chimie de la surface du catalyseur et comment elle change avec ces électrolytes’, explique Greenlee. ‘Je ne promets pas de fabriquer de l’ammoniac, mais j’espère que nous apprendrons beaucoup sur le catalyseur et que nous contribuerons à ce domaine.’
Looking to lithium
A l’instar de Greenlee et MacFarlane, Chorkendorff a mis en place les expériences de contrôle rigoureuses, notamment en utilisant du diazote radiomarqué, nécessaires pour montrer que l’ammoniac produit provient bien du diazote et non d’une autre source d’azote. Nous avons publié une méthode, car j’en ai assez de lire tous ces articles qui prétendent produire de l’ammoniac, alors qu’ils n’en produisent pas », explique M. Chorkendorff. ‘Je ne connais qu’un seul système qui fabrique de l’ammoniac avec certitude, et c’est la voie médiée par le lithium.’
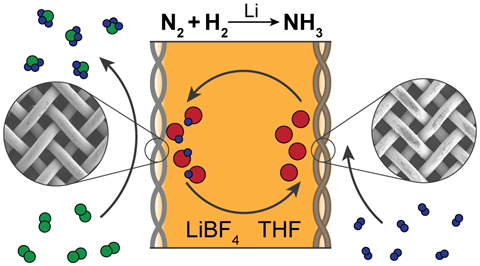
Source : © Nikifar Lazouski et al/Springer Nature Limited 2020
Les catalyseurs à base de lithium semblent être le meilleur système, comme dans celui-ci développé par le groupe de Karthish Manthiram au MIT
Le lithium est le seul métal capable de réagir spontanément avec le diazote pour former un nitrure métallique – en brisant la triple liaison du diazote au cours du processus. La capacité du lithium à générer de l’ammoniac a été démontrée par des chercheurs japonais au milieu des années 1990 – le seul protocole que Chorkendorff a pu reproduire.
L’approche de l’ammoniac par le lithium est actuellement la seule qui, sans l’ombre d’un doute, fonctionne, convient MacFarlane. L’inconvénient du lithium est qu’il implique une lourde pénalité d’efficacité énergétique, nécessitant un surpotentiel de plus de 3V. ‘C’est beaucoup d’énergie qui sera gaspillée, perdue sous forme de chaleur, ce qui explique pourquoi il n’a pas été repris et développé auparavant’, dit MacFarlane.
Mais ce que le protocole a pour lui, c’est le fait qu’il fonctionne définitivement – et il offre de nombreuses directions pour les recherches futures. ‘L’approche médiée par le lithium est notre principale approche pour le moment’, dit MacFarlane. ‘Une façon évidente de résoudre le problème de l’énergie est de chercher d’autres métaux, et leurs nitrures métalliques, qui réaliseraient ce processus à un coût énergétique moindre, un potentiel énergétique moins négatif’, dit-il.
Dans le laboratoire de Chorkendorff, l’accent est mis sur la compréhension de ce qui rend le lithium efficace en premier lieu. ‘Nous cherchons tout d’abord à comprendre ce qui se trouve réellement sur cette surface pour réaliser ce processus. Nous utilisons le synchrotron de Stanford, en essayant de construire un modèle pour ce processus.’
Il y a quelques années, les taux étaient si faibles que nous ne savions même pas si nous fabriquions de l’ammoniac
Manthiram, quant à lui, a cherché des moyens de s’attaquer au problème de faire réagir efficacement les gaz dans une cellule électrochimique à base de liquide. Nous avons démontré que l’on pouvait utiliser une électrode à diffusion gazeuse pour introduire l’azote gazeux de manière beaucoup plus efficace dans le réacteur, surmonter les limitations de transport et produire ainsi de l’ammoniac à des taux beaucoup plus rapides et avec une sélectivité plus élevée pour la production d’ammoniac par rapport à l’hydrogène », explique-t-il. L’équipe a obtenu un rendement record en ammoniac.
Pour l’instant, le réacteur à diffusion gazeuse ne fonctionne que sur quelques minutes, et à un surpotentiel extrême. ‘Ils sont en quelque sorte en train de forcer les choses – mais malgré les inconvénients, j’aime beaucoup cet article’, dit Chorkendorff. ‘Il montre la voie à suivre et la science qui est nécessaire.’
L’équipe – et le domaine – a du pain sur la planche pour transformer le processus en une solution pratique pour fertiliser les cultures, ou pour stocker et transporter l’énergie renouvelable, dit Manthiram. Mais quand on se rappelle où nous en étions dans ce domaine il y a quelques années, les taux étaient si bas que nous ne savions même pas si nous fabriquions de l’ammoniac. Nous en sommes enfin au point, comme le montre notre article, où les taux sont si élevés qu’il n’est pas nécessaire de réaliser une expérience de contrôle avec de l’azote marqué pour démontrer que l’ammoniac est réel. Il est tout simplement impossible qu’il y ait de l’ammoniac fortuit à ces concentrations ». Bien qu’il s’empresse d’ajouter que l’équipe effectue toujours les expériences de contrôle.
Pour l’instant, l’équipe supporte le problème inhérent au surpotentiel du lithium. C’est le prix à payer pour s’engager dans cette voie, et nous avons accepté de payer ce prix, parce qu’il n’y a pas d’autre système qui puisse fonctionner, même à proximité des taux que nous avons atteints avec le lithium « , dit Manthiram. Je serais surpris si d’autres méthodes n’apparaissaient pas au cours de la prochaine décennie sans payer ce prix », ajoute-t-il. ‘Mais c’est là où en est le domaine actuellement.’
James Mitchell Crow est un écrivain scientifique basé à Melbourne, en Australie
.