Synthèse, nomenclature et propriétés du groupe fonctionnel amide
Dans ce billet, nous allons essayer de donner un large aperçu des amides. Nous fournirons un bref aperçu de la nomenclature des amides, deux propriétés importantes des amides qui diffèrent grandement des amines, et passerons en revue trois stratégies clés pour la synthèse des amides.
Table des matières
- Nomenclature du groupe fonctionnel amide : Amides primaires, secondaires et tertiaires
- Amides vs Amines : Moins basique, plus acide
- Synthèse des amides, partie 1. Substitution nucléophile des halogénures d’acyle (ou des anhydrides) par des amines
- Synthèse des amides, partie 2. Hydrolyse partielle des nitriles
- Synthèse des amides, partie 3 : Utilisation d’un réactif déshydratant (tel que le DCC)
- Résumé : trois méthodes efficaces pour la synthèse des amides
- Envisageons brièvement une quatrième méthode, moins importante : La force brute
- Notes
- Quiz yourself!
- (Advanced) Références et lectures complémentaires
1. Nomenclature du groupe fonctionnel amide : Amides primaires, secondaires et tertiaires
Les « amides » sont ce qu’on appelle une amine qui a un seul groupe carbonyle attaché. Le groupe fonctionnel amide est aux amines ce que les esters sont aux alcools.
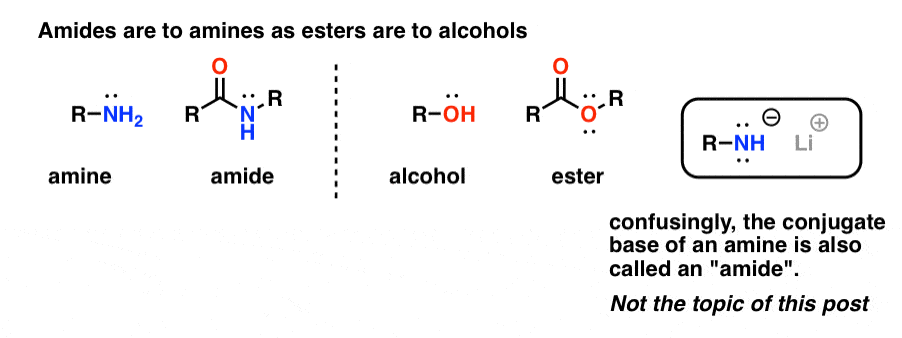
De façon déroutante, le mot « amide » est également utilisé pour désigner la base conjuguée des amines, comme l’amide de sodium (NaNH2) et le di-isopropylamide de lithium (LDA). Ces derniers sont parfois différenciés en les désignant comme des « bases amides ». D’autres utiliseront une prononciation légèrement différente pour les différencier (ayyy-myde et aaah-midd). Comme pour tout autre homonyme, la clé est le contexte.
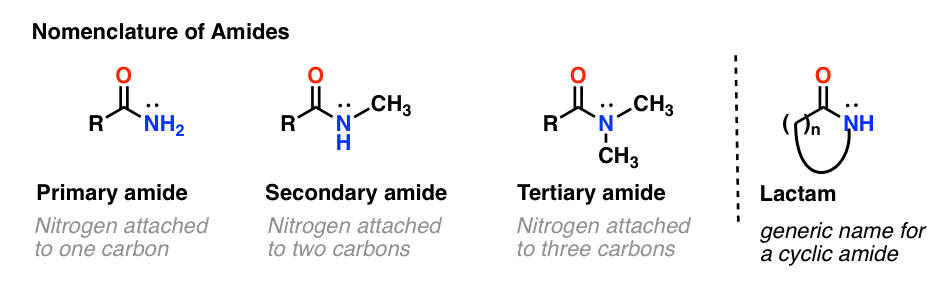
Comme pour les amines, la nomenclature utilisée pour un amide dépend du nombre de carbones attachés à l’azote.
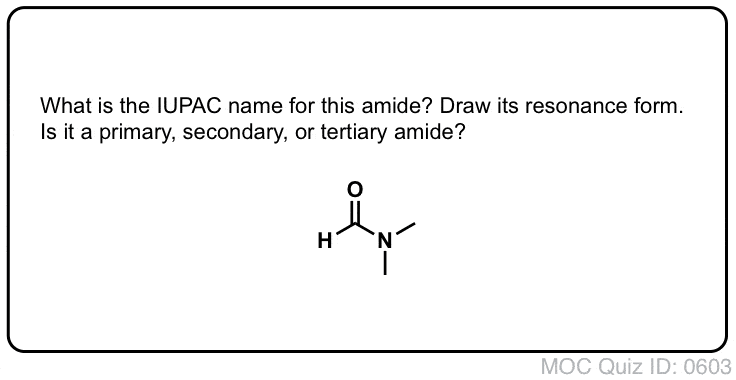
Un amide primaire (1°) a l’azote attaché à un seul carbone ; un amide secondaire (2°) a l’azote attaché à deux carbones ; un amide tertiaire (3°) a l’azote attaché à trois carbones. Un amide cyclique est appelé un lactame.
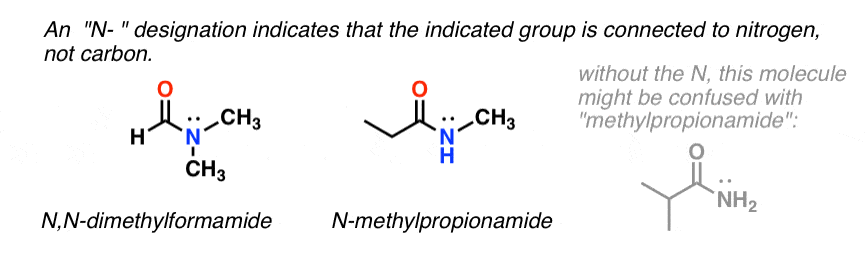
Lorsque l’azote de l’amide a des substituants autres que l’hydrogène, nous les spécifions en utilisant le préfixe N- pour éviter toute confusion. Par exemple, le N-méthylpropionamide spécifie la fixation d’un groupe méthyle sur l’azote ; sans le préfixe N-, on pourrait supposer que le groupe méthyle est fixé au carbone, ce qui serait une molécule entièrement différente.
Amides vs Amines : Moins basique, plus acide
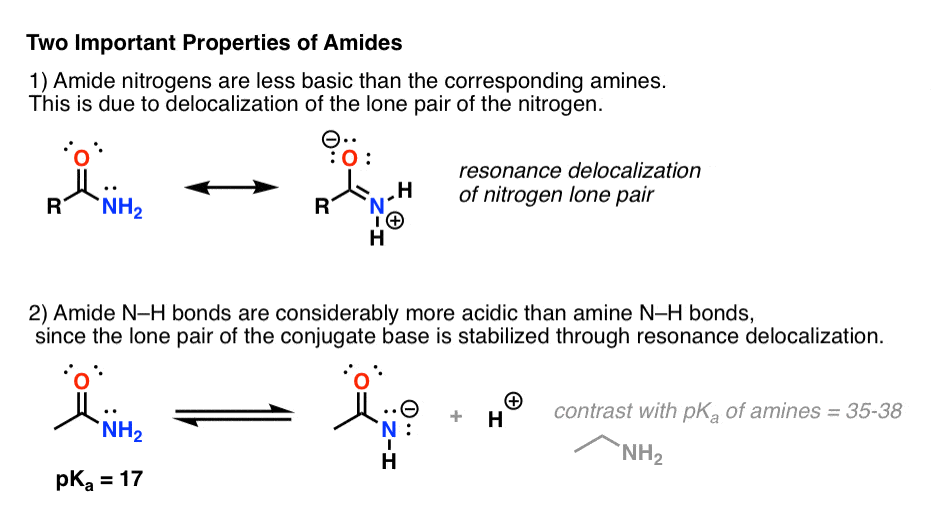
Attacher un groupe carbonyle à une amine a deux effets drastiques sur les propriétés de l’azote.
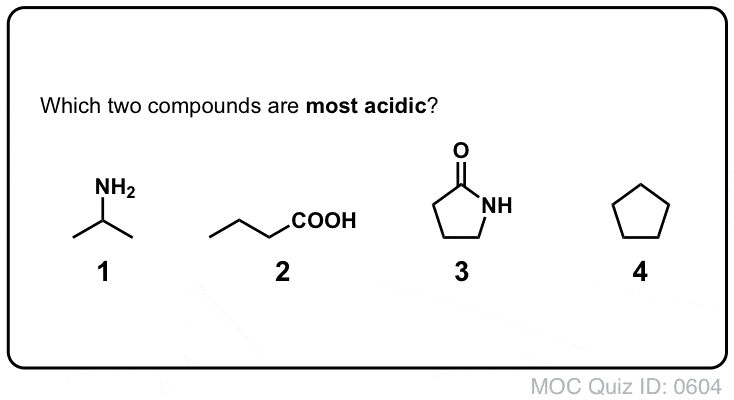
- Premièrement, les azotes des amides sont considérablement moins basiques que ceux des amines. C’est principalement le résultat de la délocalisation du doublet solitaire de l’azote dans la liaison pi du carbonyle. En fait, la position la plus basique d’un amide n’est pas l’azote mais l’oxygène ( !).
- Deuxièmement, les liaisons N-H des amides sont beaucoup plus acides que les liaisons N-H des amines. Pourquoi ? Encore une fois, la délocalisation. Le groupe carbonyle attaché permet à la paire solitaire de la base conjuguée d’être délocalisée par résonance. Le pKa de l’acétamide (17) est environ 20 ordres de grandeur plus acide que celui de l’ammoniac (38).
Une troisième propriété plus subtile des amides est qu’ils ont généralement une rotation restreinte autour de la liaison C-N. La forme de résonance où il y a une liaison C-N apporte une contribution si importante à l’hybride de résonance que l’on peut penser que la liaison C-N a un » caractère de double liaison partielle « .
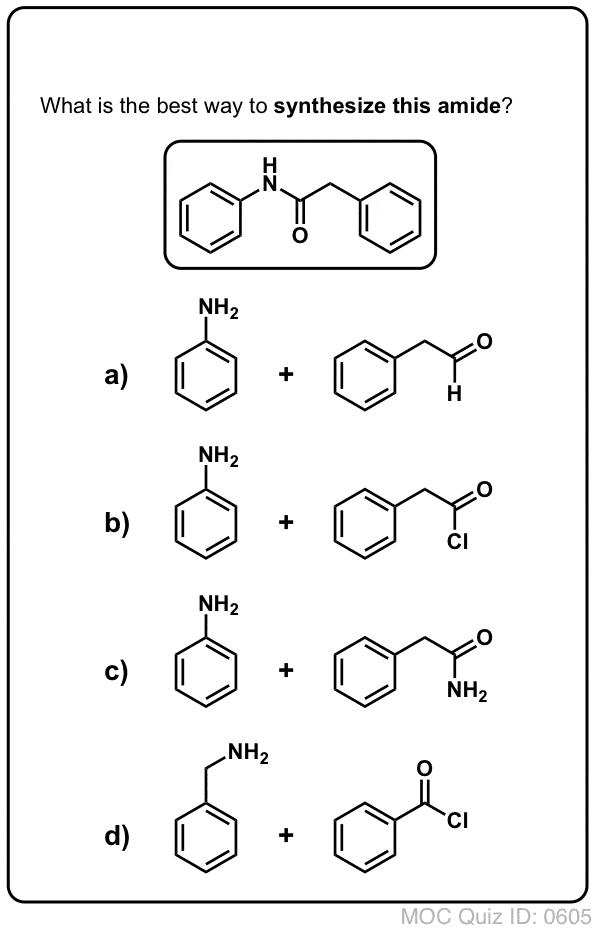
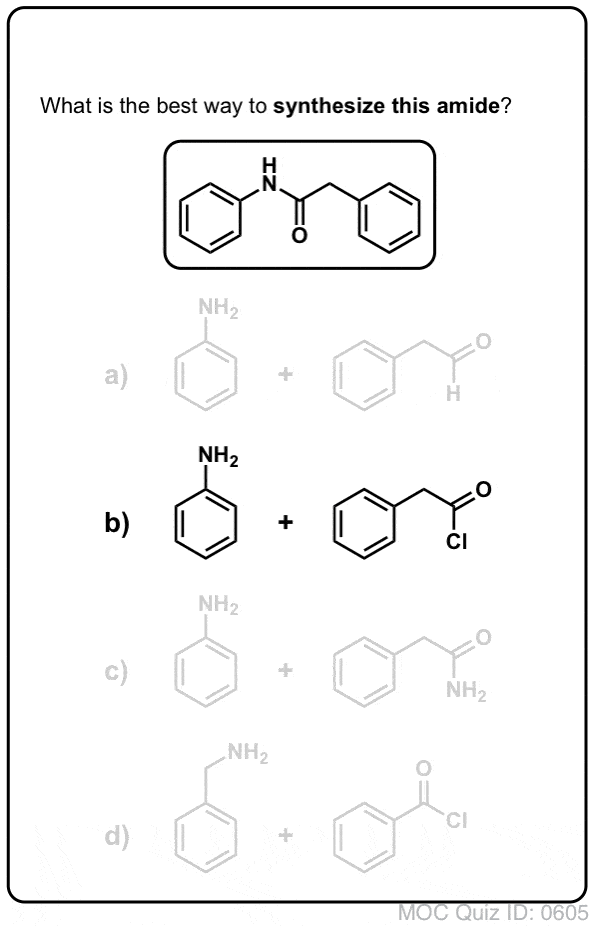
Synthèse des amides, partie 1. Substitution acylique nucléophile des halogénures (ou anhydrides) d’acyle par des amines
Les groupes acyles attachés à un bon groupe partant comme les chlorures d’acide ou les anhydrides d’acide peuvent facilement subir une substitution acylique nucléophile par des nucléophiles aminés.
Si seul l’acide carboxylique est disponible pour commencer, l’utilisation d’un réactif comme le chlorure de thionyle (SOCl2) pour convertir un acide carboxylique en chlorure d’acide est une bonne première étape pour transformer un acide carboxylique en amide. (Le PCl3, le PCl5, le chlorure d’oxalyle et une foule d’autres réactifs peuvent également fonctionner). Alternativement, le traitement d’un acide carboxylique avec un halogénure d’acyle livrera un anhydride, qui peut également être efficace.
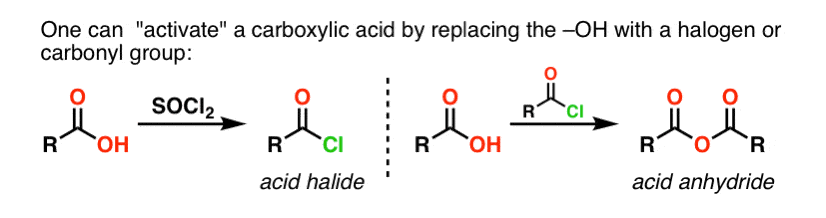
Les halogénures (par exemple Cl- ) et les carboxylates (RCO2- ) sont des bases beaucoup plus faibles, et donc de bien meilleurs groupes partants que HO-. Ainsi, en ajoutant une amine à un halogénure d’acyle ou à un anhydride d’acide, la substitution acylique nucléophile peut se produire dans des conditions beaucoup plus douces, ce qui donne notre amide désiré.
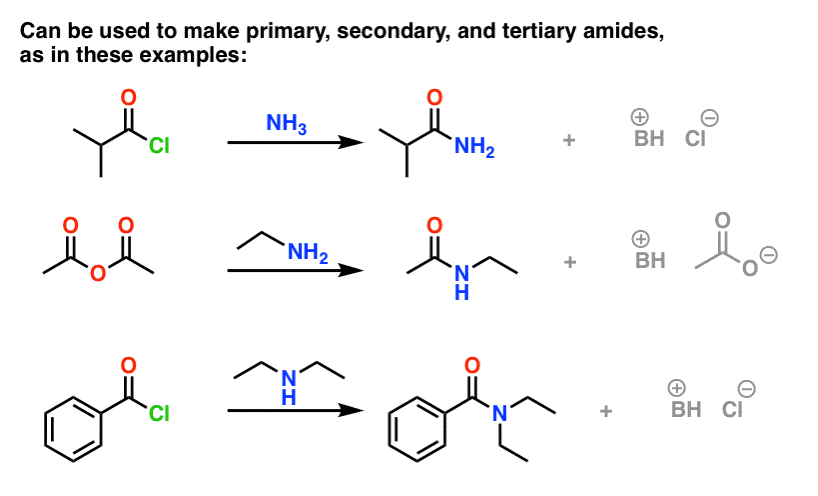
(On peut obtenir des amides par la réaction d’esters avec des amines, mais étant donné que les alcoxydes sont des groupes partants plus pauvres que les halogénures ou les carboxylates, cette méthode nécessite des conditions plus forçantes. )
Une chose à noter avec les halogénures d’acide est que le processus génère un seul équivalent de HCl comme sous-produit. En l’absence de toute base supplémentaire, le rendement maximal de la procédure serait de 50 %, car le HCl protonerait toute amine et la rendrait un sel d’ammonium non nucléophile.
Une façon de s’assurer que la réaction se déroule jusqu’à son terme est d’ajouter un deuxième équivalent d’amine. Il existe d’autres moyens pratiques de résoudre ce problème, que j’ai consigné dans une note de bas de page.
Si vous avez besoin d’un rappel sur le mécanisme de la substitution acylique nucléophile, survolez ici pour une image pop-up ou ouvrez le lien de l’image ici :
.
Synthèse des amides, partie 2 : Hydrolyse partielle des nitriles
Une façon de penser aux nitriles est qu’ils sont des acides carboxyliques masqués. S’ils sont traités avec un acide aqueux et beaucoup de chaleur – des conditions de marteau-pilon – ils peuvent être hydrolysés en acides carboxyliques.
L’un des intermédiaires de ce processus est un amide primaire.
Donc, si nous utilisons une technique de marteau-pilon un peu plus douce, il est parfois possible de sauver l’amide de notre mélange réactionnel avant qu’il ne soit hydrolysé en acide carboxylique.
L’image ci-dessous montre comment on pourrait synthétiser un amide à partir d’un précurseur d’halogénure d’alkyle, via la bonne vieille réaction SN2 :
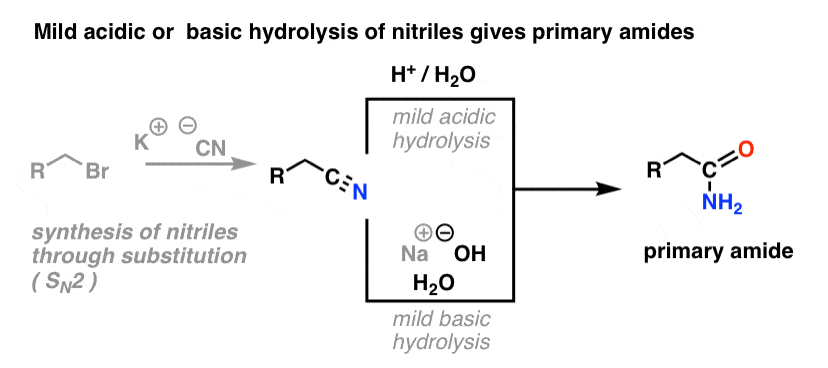
Qu’entend-on par « douce » ? Un ensemble de conditions pour l’hydrolyse du phénylacétamide (PhCH2CN) en PhCH2CONH2 donne les conditions de réaction comme « HCl, H2O, 40-50°C, 1h « .
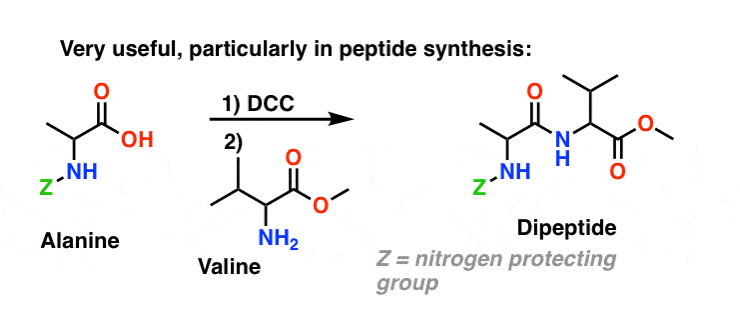
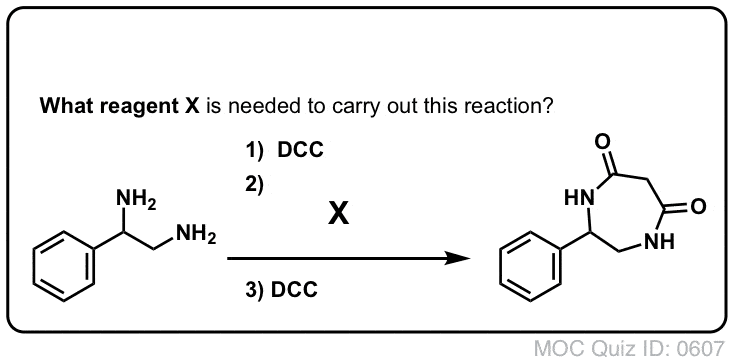
Synthèse Des Amides, Partie 3 : Utilisation d’un réactif déshydratant (tel que le DCC)
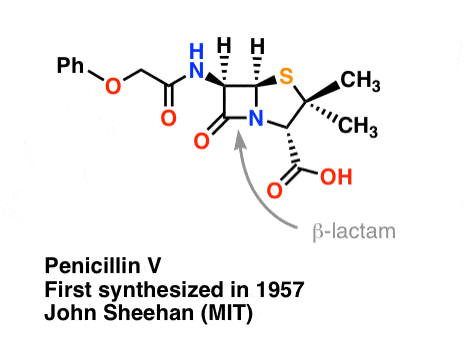
La synthèse de la pénicilline V en 1957 par le groupe de John Sheehan au MIT apparaît comme l’une des réalisations héroïques de la chimie organique de l’après-guerre. Le problème clé était la construction d’un amide cyclique (le cycle β-lactame) qui est extrêmement instable dans des conditions acides. Cela n’était pas sans importance, car le β-lactame est également la clé du mécanisme d’action de la pénicilline : il interfère avec la synthèse de la paroi cellulaire bactérienne. Les tentatives pour fabriquer cet amide cyclique en convertissant un acide carboxylique en un halogénure d’acyle avec SOCl2, PCl3, PCl5 et une foule d’autres méthodes ont toutes échoué.
En réponse, le groupe de Sheehan a astucieusement inventé un réactif déshydratant très doux : Le N, N’-dicyclohexylcarbodiimide (DCC) qui permettait la formation d’amides dans des conditions très douces à pH neutre.
Aujourd’hui, le DCC (et son cousin (note) plus pratique, l’EDC ) est largement utilisé pour la synthèse d’amides sensibles – notamment de peptides – dans des conditions très douces.
Dans les conditions de la réaction, l’oxygène du carboxylate se fixe au carbone électrophile du DCC, ce qui donne ce que nous appelons un « ester actif » – en d’autres termes, un ester qui possède réellement un groupe partant décent (contrairement à la plupart des esters, qui n’en ont pas). L’ester actif est ensuite attaqué par l’amine dans une substitution acylique nucléophile classique, ce qui conduit à la formation de l’amide.
En regardant le sous-produit, notez qu’il y a deux hydrogènes (chacun attaché à l’azote) et un oxygène (attaché au carbone central). C’est là que le H2O est parti !
Parce que ce post devient ridiculement long comme il est, j’ai sauvegardé le mécanisme pour cette image pop-up.
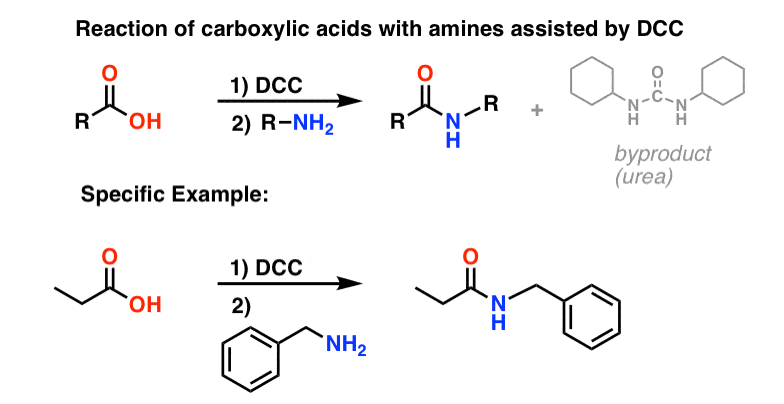
Comme cette réaction se produit dans des conditions neutres, elle est extrêmement utile pour la synthèse de peptides, qui peuvent subir une racémisation (épimérisation, en fait) dans des conditions basiques et acides.
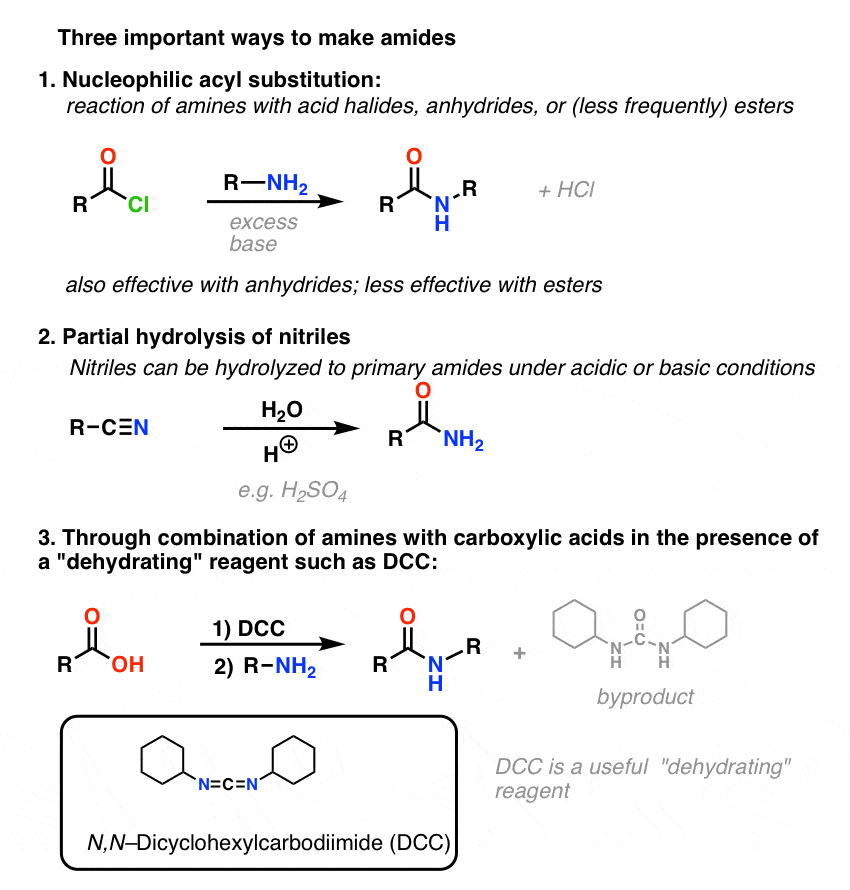
Résumé : Trois méthodes efficaces pour la synthèse des amides
Terminez en résumant ces trois façons importantes (mais en aucun cas exhaustives) de faire des amides :
Ceci conclut notre billet sur les points principaux de la nomenclature, des propriétés et de la synthèse des amides. Pour une méthode de synthèse des amides en prime, lisez la suite.
Envisageons brièvement une quatrième méthode, moins importante : La force brute
Puisqu’elle est généralement abordée dans les manuels, terminons en considérant une quatrième possibilité – la plus simple imaginable. Et si nous prenions un acide carboxylique et le combinions avec une amine, en espérant qu’un amide se forme. Que se passe-t-il ?
Les amines sont des bases, et les acides carboxyliques sont, eh bien, des acides. Ajoutez les deux ensemble et vous obtenez un sel inoffensif.
Parfois, on peut fabriquer des amides en chauffant les feux de la rampe de ce sel dans un tube scellé, chassant un équivalent d’eau. Cette méthode s’appelle la pyrolyse.
Cette méthode n’est rien si ce n’est directe, et a toute la subtilité d’un obusier.
Le problème de la pyrolyse est que le groupe HO- d’un acide carboxylique est un terrible groupe partant.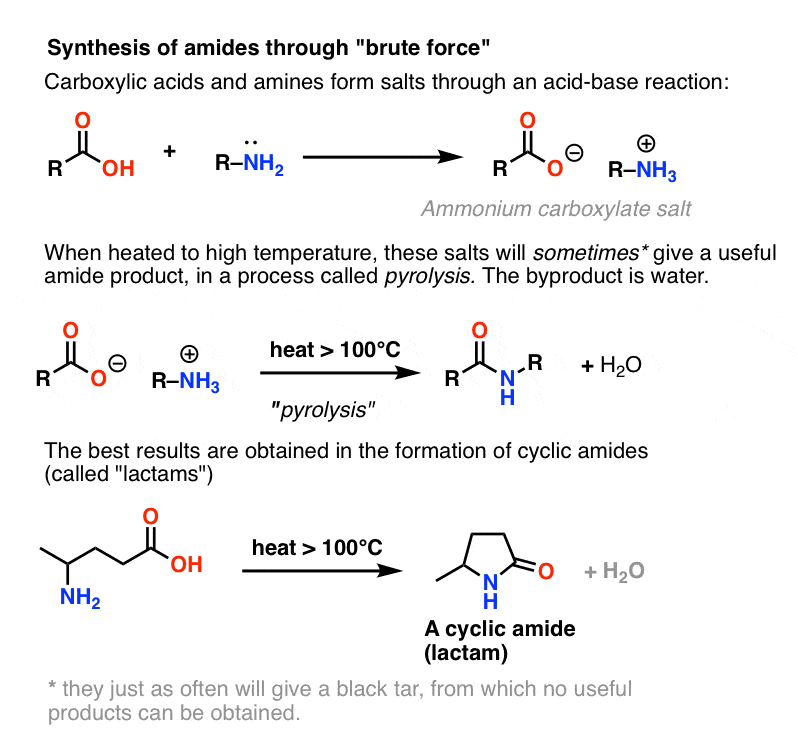
Pour former un amide à partir de cette espèce, l’oxygène du carboxylate (O- ) doit en quelque sorte partir. Ce n’est pas une chose facile à faire, car la base conjuguée de O- est l’anion double O2- . Dans toute liste de groupes partants, O2- se classerait quelque part entre, « merdique » et « f&ing awful ».
Cependant, si l’on frappe ce sel avec l’équivalent chimique du marteau de Thor : force brute, chaleur élevée, une série de transferts de protons du sel d’ammonium peut se produire. libérant finalement H2O et formant la liaison C-N.
Ce processus est appelé pyrolyse (pyro = feu, lysis = rupture).
Dans certains cas, en particulier les amides simples, et aussi dans la formation de lactames simples, le processus peut être satisfaisant.
Dans de nombreux autres cas, cependant, il aboutit à la formation d’un goudron noir au fond de votre fiole dont aucun produit utile ne peut être obtenu.
Comme tout chimiste organique peut vous le dire, il y a beaucoup de façons diverses de créer des goudrons noirs insolubles au fond de votre fiole, et ce n’est qu’une méthode. Pensez à tout ce qu’il vous reste à découvrir !

La recherche d’images Google « Hammer of Thor » était liée à la chimie, mais étonnamment NSFW.
Notes
Un article amusant et connexe : Amides : Humble mais utile (de Chemical & Engineering News).
Il y a aussi un effet inductif, par lequel l’oxygène électronégatif (électronégativité de 3,44) tire sur les électrons du carbone attaché, qui à son tour tire sur les électrons de l’azote.
Note 2. Une façon très courante de réaliser cette réaction est d’utiliser ce qu’on appelle, les conditions de Schotten-Baumann, où l’on prend les réactifs dans un solvant comme l’éther diéthylique ou le dichorométhane, et on ajoute une solution aqueuse de NaOH, ce qui donne un mélange biphasique. Les sels d’ammonium qui se forment peuvent se dissoudre dans la phase aqueuse, après quoi ils sont neutralisés par l’excès de base et retournent dans la phase organique. Les amines sont généralement beaucoup plus nucléophiles que les ions hydroxyde, donc l’hydrolyse du chlorure d’acide pour donner un acide carboxylique ne pose généralement pas de problème.
Note 3.
« Au moment de ma synthèse réussie de la pénicilline V en 1957, j’ai comparé le problème d’essayer de synthétiser la pénicilline par des méthodes classiques à celui d’essayer de réparer le ressort moteur d’une belle montre avec une enclume, un marteau et des pinces de forgeron » – John C. Sheehan
Note 4. Le problème de l’utilisation du DCC est que le sous-produit, le DCU, est une énorme douleur dans le cul pour s’en débarrasser. La plupart des sous-produits sont facilement éliminés par chromatographie sur colonne. Pas le DCU. Faisant peu de cas de la polarité du solvant, le DCU sort de la colonne lentement, au compte-gouttes, contaminant chaque fraction au passage. L’EDC est une variante du DCC qui possède une unité d’amine tertiaire ; ainsi, un simple lavage acide pendant le workup éliminera toute l’urée, ce qui permettra d’économiser beaucoup de temps et de maux de tête.
L’image suivante montre la dernière étape de la synthèse de Sheehan en utilisant le DCC.
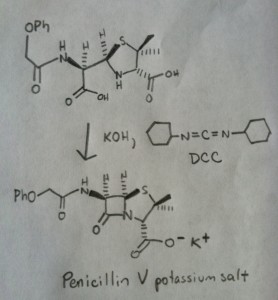
Image : Carmen Drahl/Chemical & Engineering News
Questionnez vous !
 Cliquez pour retourner
Cliquez pour retourner 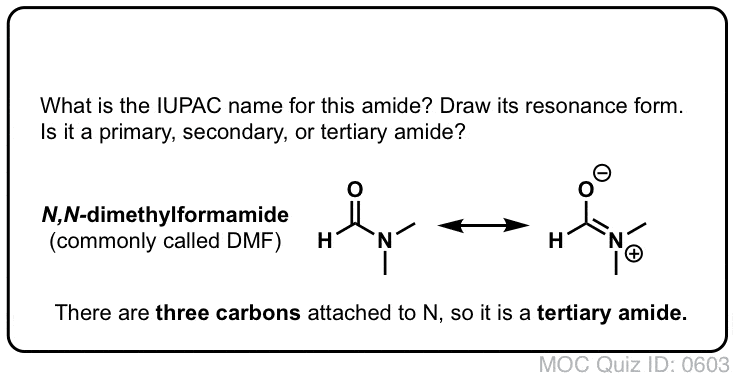
 Cliquez pour basculer
Cliquez pour basculer 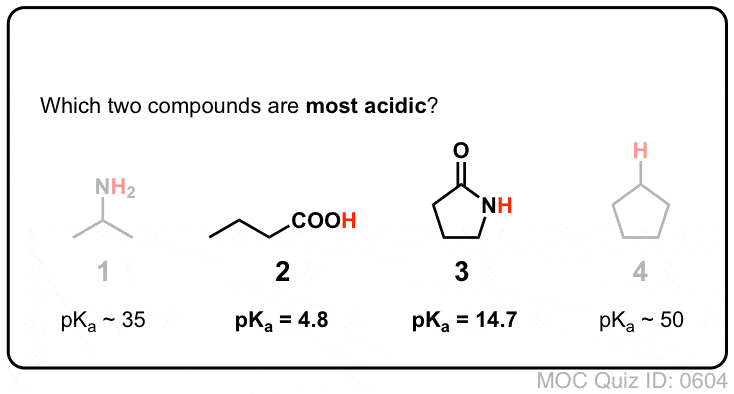
.
 Cliquez pour basculer
Cliquez pour basculer 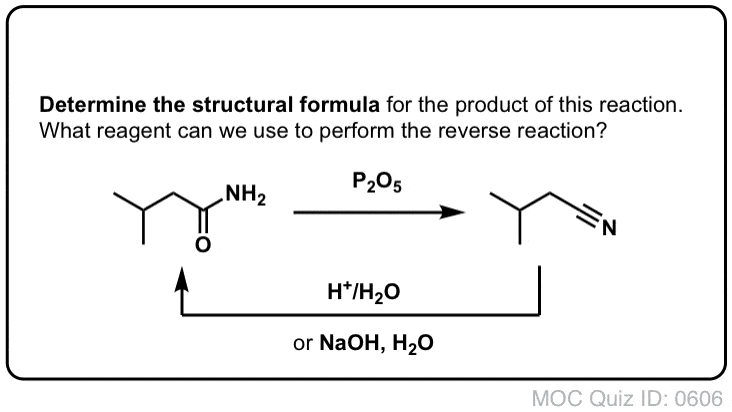
.
 Cliquez pour retourner
Cliquez pour retourner 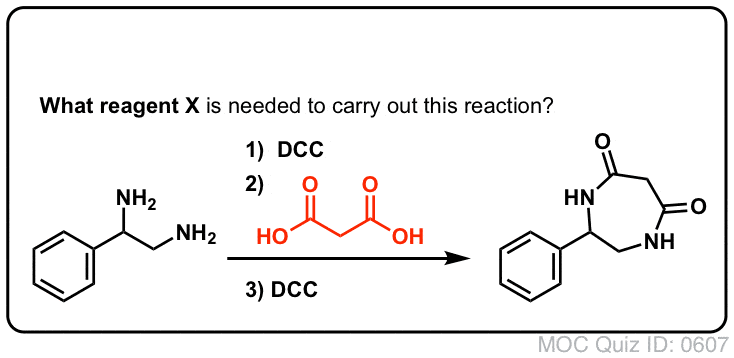
(Avancé) Références et lectures complémentaires
Hydrolyse du nitrile :
- PHENYLACETAMIDE
Wilhelm Wenner
Org Synth. 1952, 32, 92
DOI : 10.15227/orgsyn.032.0092
Les conditions utilisées ici pour l’hydratation du nitrile en amide sont plutôt douces – cela utilise une température de 40 °C pendant environ 1 h. - Hydrolyse du nitrile dirigée par un halogénure
James M. Photis
Tetrahedron Lett. 1980, 21 (37), 3539-3540
DOI : 10.1016/0040-4039(80)80228-0
C’est une procédure utile pour l’hydrolyse sélective des nitriles en amides primaires, notamment dans le cas des cyanures d’aroyle (par exemple PhCOCN). - Conversion facile et hautement sélective de nitriles en amides via une hydratation indirecte catalysée par un acide en utilisant le TFA ou AcOH-H2SO4
Jarugu Narasimha Moorthy et Nidhi Singhal
The Journal of Organic Chemistry 2005, 70 (5), 1926-1929
DOI : 10.1021/jo048240Réaction de Schotten-Bauman:
#4 et #5 sont les articles originaux de Schotten et Baumann sur une synthèse d’amide biphasée simple. - Ueber die Oxydation des Piperidins
Schotten, C.
Ber. 1884, 17 (2), 2544-2547
DOI : 10.1002/cber.188401702178 - Ueber eine einfache Methode der Darstellung von Benzoësäureäthern
Baumann, E.
Ber. 1886, 19 (2), 3218-3222
DOI : 10.1002/cber.188601902348. - Synthèse totale énantiosélective de la (-)-Kibdelone C
John R. Butler, Chao Wang, Jianwei Bian, et Joseph M. Ready
Journal of the American Chemical Society 2011, 133 (26), 9956-9959
DOI : 1021/ja204040k
L’humble réaction de Schotten-Baumann est même utilisée dans des synthèses totales exigeantes – dans ce cas, elle est utilisée pour faire le lactame en 4 à partir de 5 et 6! - Benzoyl PIPERIDINE
Marvel, C. S. ; Lazier, W. A.
Org. Synth. 1929, 9, 16
DOI : 10.15227/orgsyn.009.0016
Cette procédure de Synthèses organiques, une source de procédures de laboratoire organiques synthétiques testées indépendamment et reproductibles, est une synthèse classique d’amide de Schotten-Baumann. - Un procédé à haut débit pour le Valsartan
Ulrich Beutler, Matthias Boehm, Peter C. Fuenfschilling, Thomas Heinz, Jean-Paul Mutz, Ulrich Onken, Martin Mueller et Werner Zaugg
Organic Process Research & Development 2007, 11 (5), 892-898
DOI : 1021/op700120n
Organic Process & Research Development (« OPRD ») est une excellente revue pour la chimie de procédé ou de mise à l’échelle. Cet article montre comment la réaction de Schotten-Baumann (4 à 3) est préférée pour les réactions à grande échelle car elle est simple, robuste, facile à réaliser et ne présente pas de grands exothermes (contrairement à la réaction de Grignard, par exemple). - Le tour de la corde de nylon : Démonstration de la polymérisation par condensation
Paul W. Morgan et Stephanie L. Kwolek
Journal of Chemical Education 1959, 36 (4), 182
DOI : 1021/ed036p182
Le classique » tour de la corde de nylon » dans lequel on tire une corde de nylon d’un mélange biphasique d’hexaméthylènediamine et de chlorure de sébacoyle peut être considéré comme un type de réaction de Schotten-Baumann, dans la mesure où il forme un polyamide ! Cette réaction a été développée pour la première fois par Stephanie Kwolek, qui a été une chimiste distinguée chez DuPont pendant plus de 40 ans et qui a été responsable de la découverte du Kevlar et du développement de la chimie des aramides et d’autres matériaux à haute résistance à la traction.DCC : - Une nouvelle méthode de formation de liaisons peptidiques
John C. Sheehan et George P. Hess
Journal of the American Chemical Society 1955, 77 (4), 1067-1068
DOI : 1021/ja01609a099
Parution originale sur la synthèse de liaisons peptidiques/amides en utilisant le DCC.DeTar a publié une série d’articles étudiant le mécanisme des réactions de formation de liaisons médiées par le DCC et d’autres carbodiimides, dont voici les deux premiers : - Réactions des carbodiimides. I. Les mécanismes des réactions de l’acide acétique avec le Dicyclohexylcarbodiimide
DeLos F. DeTar et Richard Silverstein
Journal of the American Chemical Society 1966, 88 (5), 1013-1019
DOI : 10.1021/ja00957a027 - Réactions des carbodiimides. II. Les réactions du dicyclohexylcarbodiimide avec les acides carboxyliques en présence d’amines et de phénols
DeLos F. DeTar et Richard Silverstein
Journal of the American Chemical Society 1966, 88 (5), 1020-1023
DOI:1021/ja00957a028 - La chimie des carbodiimides.
G. Khorana
Chemical Reviews 1953, 53 (2), 145-166
DOI : 10.1021/cr60165a001
Une ancienne revue du professeur Har Gobind Khorana, qui reçut plus tard le prix Nobel de médecine pour ses travaux démontrant que les nucléotides de l’ADN et de l’ARN codent pour la synthèse des protéines. - ESTERIFICATION DES ACIDES CARBOXYLIQUES AVEC LE DICYCLOHEXYLCARBODIIMIDE/4-DIMETHYLAMINOPYRIDINE : FUMARATE DE TERT-BUTYL ETHYL
Neises et Wolfgang Steglich
Org. Synth. 1985, 63, 183
DOI : 10.15227/orgsyn.063.0183
Il s’agit d’une procédure d’estérification sélective utilisant le DCC – cela évite la transestérification qui se produirait dans les conditions habituelles d’estérification de Fischer. Cette procédure provient de Synthèses organiques, une source de réactions organiques synthétiques fiables et testées indépendamment. - Synthèse de peptides en phase solide. I. La synthèse d’un tétrapeptide
B. Merrifield
Journal of the American Chemical Society 1963, 85 (14), 2149-2154
DOI : 10.1021/ja00897a025
C’est l’un des articles les plus cités du JACS, et pour une bonne raison – il pose essentiellement les bases de la SPPS, et de ce qui est maintenant une industrie d’un milliard de dollars. Ces travaux ont valu un prix Nobel de chimie à l’auteur, le professeur R. Bruce Merrifield (Rockefeller U.). Les couplages peptidiques sont réalisés en utilisant nul autre que le DCC. - Notes- Une synthèse commode de carbodiimides solubles dans l’eau.
John Sheehan, Philip Cruickshank et Gregory Boshart
The Journal of Organic Chemistry 1961, 26 (7), 2525-2528
DOI:1021/jo01351a600
Le principal inconvénient du DCC est que la séparation du DCU (dicyclohexylurée) ainsi produit peut être encombrante. Ainsi, d’autres réactifs, comme l’EDC (1-Ethyl-3-(3′-diméthylaminopropyl)carbodiimide) ont été développés, pour lesquels l’urée obtenue est soluble dans l’eau et facilement éliminée par extraction. - Synthèse totale d’un antibiotique peptide lactone monocyclique, l’étamycine
John C. Sheehan et Stephen L. Ledis
Journal of the American Chemical Society 1973, 95 (3), 875-879
DOI:1021/ja00784a041
EDC a été utilisé pour la plupart des couplages peptidiques dans la synthèse de ce peptide, qui est l’un des premiers peptides cycliques à être produit par synthèse.