Le N-Bromosuccinimide (NBS) est un agent de bromation et d’oxydation qui est utilisé comme source de brome dans les réactions radicalaires (par exemple : bromations allyliques) et diverses additions électrophiles. La bromation NBS de substrats tels que les alcools et les amines, suivie de l’élimination du HBr en présence d’une base, conduit aux produits d’oxydation nette dans lesquels aucun brome n’a été incorporé.
Réactions nominales
Réaction de Wohl-Ziegler
Littérature récente

Une procédure efficace et conviviale a été mise au point pour le développement de la réaction de Wohl-Ziegler.Une procédure efficace et conviviale a été développée pour la déprotection oxydative des éthers de tétrahydropyranyle (THP) avec le N-bromosuccinimide (NBS) en utilisant la β-cyclodextrine (β-CD) dans l’eau. Une série d’éthers tétrahydropyranyliques ont été déprotégés par oxydation à température ambiante avec des rendements impressionnants.
M. Narender, M. S. Reddy, K. R. Rao, Synthesis, 2004,1741-1743.

Les N-alcoxyamides donnent commodément les esters carboxyliques correspondants en présence de NBS dans le toluène via un homocouplage oxydatif et la dénitrogénation thermique subséquente. Même les substrats portant un substituant volumineux ou à longue chaîne ont donné des produits avec de bons rendements dans cette approche pratique et économique d’une transformation directe d’une partie alcoxyamide dans le groupe fonctionnel ester carboxylique.
N. Zhang, R. Yang, D. Zhang-Negrerie, Y. Du, K. Zhao, J. Org. Chem, 2013,78, 8705-8711.

Transformation directe d’éthylarènes en amides aromatiques primaires avec du N-Bromosuccinimide et de l’I2-Aqueous NH3
S. Shimokawa, Y. Kawagoe, K. Moriyama, H. Togo, Org. Lett, 2016, 18, 784-787.

Une réaction chimiosélective efficace, sans métal ni base, d’acides boroniques avec des radicaux cyanamidyl/arylcyanamidyl fournit des aryl-, hétéroaryl- et alkylamines primaires à température ambiante en 1 h. La réaction est médiée par PIFA et NBS.
N. Chatterjee, M. Arfeen, P. V. Bharatam, A. Goswami, J. Org. Chem., 2016,81, 5120-5127.
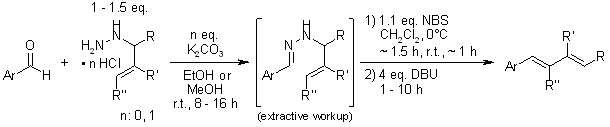
Une synthèse stéréosélective de diènes à partir d’aldéhydes et de dérivés de N-allylhydrazine offre des niveaux élevés de (E)-stéréosélectivité pour une variété de substrats. L’ajout d’un diénophile au mélange réactionnel permet une séquence de synthèse-cycloaddition de diènes en un seul ballon.
D. A. Mundal, K. E. Lutz, R. J. Thomson, Org. Lett., 2009,11, 465-468.

Une transformation efficace en un pot de composés β-hydroxycarbonylés en composés 1,3-dicarbonylés α-bromés est réalisée avec MoO2Cl2 en présence de N-bromosuccinimide. Toutes les réactions ont été réalisées dans des conditions douces et donnent de bons rendements. Aucune bromation ne se produit en position benzylique et allylique.
K. Jeyakumar, D. K. Chand, Synthesis, 2009, 306-310.

K. Jeyakumar, D. K. Chand, Synthesis, 2009, 306-310.

Des oxyhalogénations sélectives d’alcynes ont été réalisées dans l’eau dans des conditions très douces en présence de réactifs halogénants peu coûteux, comme le N-bromosuccinimide et le N-chlorosuccinimde, et du FI-750-M comme amphiphile. Aucune halogénation au niveau des cycles aromatiques n’a été détectée. Le milieu réactionnel et le catalyseur peuvent être recyclés.
L. Finck, J. Brals, B. Pavuluri, F. Gallou, S. Handa, J. Org. Chem., 2018, 83, 7366-7372.

Une halogénation réductrice catalysée par l’oxyde de triphénylphosphine d’une cétone α,β-insaturée avec du trichlorosilane comme réactif réducteur et un N-halosuccinimide comme source d’halogène électrophile permet une synthèse sélective d’α-halocétones asymétriques.
Z. Lao, H. Zhang, P. H. Toy, Org. Lett., 2019, 21, 8149-8152.

Des réactions d’hydroalumination α-sélective fiables, simples sur le plan opérationnel et catalytiques se déroulent en présence d’hydrure de diisobutylaluminium et de (Ni(dppp)Cl2) et, contrairement aux transformations non catalysées, génèrent peu ou pas de sous-produits d’alcynylaluminium. Les halogénures et boronates α-vinyliques dérivés peuvent être synthétisés par traitement direct avec les électrophiles appropriés.
F. Gao, A. H. Hoveyda, J. Am. Chem. Soc., 2010, 132, 10961-10963.

Le piégeage d’une espèce diazo de façon intermoléculaire par deux espèces ioniques indépendantes en tandem au centre du carbène installe un électrophile et un nucléophile sur le même carbone. Ce concept sans métal permet des synthèses régiosélectives de divers halogénures de vinyle, de sulfones de vinyle et de dérivés d’alcynes.
D. P. Ojha, K. R. Prabhu, Org. Lett., 2015,17, 18-21.

Des composés insaturés tels que les alcènes, les alcynes, les allènes et les méthylènecyclopropanes (MCP) peuvent être dibromés en quelques minutes par le NBS et le bromure de lithium dans le THF à température ambiante, avec des rendements bons à excellents dans des conditions douces.
L.-X. Shao, M. Shi, Synlett, 2006, 1269-1271.

L.-X. Shao, M. Shi, Synlett, 2006, 1269-1271.

L.-X. Shao, M. Shi, Synlett, 2006, 1269-1271.

L’utilisation du N-bromosuccinimide permet une stratégie one-pot sans métal pour la synthèse d’α-amino cétones pharmaceutiquement importantes à partir d’alcools secondaires benzyliques et d’amines facilement disponibles. Cette réaction procède par trois étapes consécutives impliquant l’oxydation des alcools, l’α-bromation des cétones et la substitution nucléophile des α-bromo cétones pour donner des α-amino cétones.
S. Guha, V. Rajeshkumar, S. S. Kotha, G. Sekar, Org. Lett., 2015,17, 406-409.

Une combinaison de N-bromoimide et de DBU permet des réactions d’amination allylique d’alcènes, dans lesquelles les nucléophiles azotés internes et externes peuvent être installés directement. La double activation du NBS ou du NBP par le DBU permet d’obtenir simultanément plus de brome électrophile et plus d’atomes d’azote nucléophiles. Ce protocole fournit un accès complémentaire à l’amination allylique dans des conditions douces.
Y. Wei, F. Liang, X. Zhang, Org. Lett., 2013,15, 5186-5189.

Une méthode pratique et efficace pour l’aminobromation des alkylidènecyclopropanes est rapportée. Ceci est illustré par la préparation stéréosélective de N–p-toluènesulfonamides en utilisant le p-toluènesulfonamide et le N-bromosuccinimide (NBS) comme sources d’azote et de brome, respectivement.
X. Huang, W.-J. Fu, Synthesis, 2006, 1016-1017.

Dans un protocole à flux continu pour la bromation de composés benzyliques avec seulement un petit excès de N-bromosuccinimide, les réactions radicalaires ont été activées avec une lampe fluorescente compacte (CFL) domestique facilement disponible en utilisant une conception de réacteur à flux simple basée sur des tubes transparents en polymère d’éthylène fluoré. Toutes les réactions ont été réalisées en utilisant l’acétonitrile comme solvant, évitant ainsi les solvants chlorés dangereux tels que le CCl4.
D. Cantillo, O. de Frutos, J. A. Rincon, C. Mateos, C. O. Kappe, J. Org. Chem., 2014,79, 223-229.

La base de Lewis Trip-SMe (Trip = triptycényle) catalyse une halogénation électrophile de composés aromatiques non activés en utilisant des N-halosuccinimides (NXS) à température ambiante en présence de AgSBF6 comme source d’un anion non coordinant. Le système π de la fonctionnalité triptycényle exerce un rôle crucial pour le renforcement de l’électrophilie.
Y. Nishii, M. Ikeda, Y. Hayashi, S. Kawauchi, M. Miura, J. Am. Chem. Soc., 2020, 142, 1621-1629.

Une bromation hautement régiosélective de composés aromatiques activés a été réalisée en utilisant le N-bromosuccinimide dans le bromure de tétrabutylammonium. La monobromation prépondérantepara-sélective des aromatiques activés, l’accélération du taux pour les substrats moins réactifs lors de l’addition de l’argile montmorillonite K-10 acide, avec ou sans l’assistance de micro-ondes, sont les caractéristiques notables de ce protocole.
N. C. Ganguly, P. De. S. Dutta, Synthesis, 2005, 1103-1108.

L’utilisation d’un hexafluoroisopropanol comme solvant permet une halogénation douce et régiosélective d’une large gamme d’arènes et d’hétérocycles avec des N-halosuccinimides avec de bons rendements. En outre, la polyvalence de la méthode est démontrée par le développement de réactions de dihalogénation séquentielle à un pot et de couplage croisé halogénation-Suzuki.
R.-J. Tang, T. Milcent, B. Crousse, J. Org. Chem., 2018, 83, 930-938.

Une halogénation hautement para-sélective d’arènes portant des groupes de coordination donneurs d’électrons en présence d’un sel de dimidazolium rpovide des p-haloarènes avec de bons rendements. Un mécanisme plausible pour la réaction catalytique est proposé.
J. Chen, X. Xiong, Z. Chen, J. Huang, Synlett, 2015, 26, 2831-2834.

Des composés aromatiques hautement désactivés ont été monobromés en douceur par traitement avec du N-bromosuccinimide (NBS) dans de l’acide sulfurique concentré. Les conditions de réaction douces et la préparation simple fournissent une voie pratique et commercialement viable pour la synthèse des composés bromés des aromatiques désactivés dans de bons rendements.
K. Rajesh, M. Somasundaram, R. Saiganesh, K. K. Balasubramanian, J. Org. Chem., 2007,72, 5867-5869.

Les N-Halosuccinimides sont efficacement activés dans l’acide trifluorométhanesulfonique et le BF3-H2O, permettant les halogénations des aromatiques désactivés. BF3-H2O est plus économique, facile à préparer, non oxydant, et offre une acidité suffisamment élevée.
G. K. S. Prakash, T. Mathew, D. Hoole, P. M. Esteves, Q. Wang, G. Rasul, G. A. Olah, J. Am. Chem. Soc., 2004,126, 15770-15776.

Les acides boroniques aryliques et hétéroaryliques réagissent avec le N-iodosuccinimide et le N-bromosuccinimide pour donner les iodo- et bromo-arènes correspondants avec des rendements bons à excellents. La réaction est généralement très régiosélective et ne donne que le produit ipso-substitué.
C. Thiebes, G. K. Surya Prakash, N. A. Petasis, G. A. Olah, Synlett, 1998, 141-142.

Une réaction d’ortho-bromination et d’iodination à haut rendement, générale et pratique de différentes classes de composés aromatiques se produit par une méthodologie d’activation de la liaison C-H catalysée par Rh(III).
N. Schröder, J. Wencel-Delord, F. Glorius, J. Am. Chem. Soc., 2012, 134, 8298-8301.

En utilisant le cyano comme groupe directeur, une réaction d’ortho-halogénation (I, Br, Cl) catalysée par le palladium a donné des rendements bons à excellents. La méthode est compatible avec les arylnitriles avec des groupes donneurs ou receveurs d’électrons. La présente méthode a été appliquée avec succès à la synthèse des précurseurs du paucifloral F et de l’isopaucifloral F.
B. Du, X. Jiang, P. Sun, J. Org. Chem., 2013,78, 2786-2791.

Un protocole efficace pour une synthèse hautement stéréosélective en un pot de (E)-β-aryl vinyl iodures et de (E)-β-aryl vinyl bromures à partir de styrènes est basé sur un couplage silylatif catalysé par le ruthénium suivi d’une réaction d’halodésilylation médiée par le N-halosuccinimide.
P. Pawluć, G. Hreczycho, J. Szudkowska, M. Kubicki, B. Marciniec, Org. Lett., 2009,11, 3390-3393.

En utilisant la triéthylamine comme catalyseur dans les réactions de Hunsdiecker avec des N-halosuccinimides comme source de Br+ ou I+, les acides cinnamiques et les acides propioliques sont convertis en α-halostyrènes et 1-halo-1-alkynes correspondants dans de bons rendements isolés en 1-5 min.
J. Prakash, S. Roy, J. Org. Chem., 2002, 67, 7861-7864.

J. Prakash, S. Roy, J. Org. Chem., 2002, 67, 7861-7864.

Les bromures de (E)-β-Arylvinyle ont été facilement préparésen un temps de réaction court (1-2 min) par irradiation par micro-ondes des acides3-arylpropénoïques correspondants en présence de N-bromosuccinimide et d’une quantité acatalytique d’acétate de lithium.
C. Kuang, Q. Yang, H. Senboku, M. Tokuda, Synthèse, 2005,1319-1325.

Une synthèse efficace d’aldéhydes/cétones α-iodo/bromo-α,β-insaturés directement à partir d’alcools propargyliques est catalysée en collaboration par Ph3PAuNTf2 et MoO2(acac)2, et Ph3PO comme additif permet de supprimer la formation indésirable d’énone/énal. Les caractéristiques notables de cette méthode comprennent de faibles charges de catalyseur, des conditions de réaction douces, et surtout une bonne diastéréosélectivité.
L. Ye, L. Zhang, Org. Lett., 2009,11, 3646-3649.

Une iodation régio- et stéréosélective, ainsi que quelques exemples pour la bromation, d’acrylamides facilement disponibles se produit dans des conditions douces via un mécanisme d’activation C-H/halogénation catalysé par Rh(III). La réaction représente un exemple rare d’une halogénation directe de dérivés d’acide acrylique pauvres en électrons pour accéder à une variété de dérivés d’acide Z-haloacrylique différemment substitués.
N. Kuhl, N. Schröder, F. Glorius, Org. Lett., 2013,15, 3860-3863.

Dans une réaction en cascade d’addition allyloxylique promue par NBS et de réarrangement de Claisen-déshydrobromination, plus de 20 alcynylsulfonamides substitués ont été mis en réaction avec des alcools allyliques pour générer des (2Z)-2,4-diénamides avec de bons rendements. Les calculs théoriques ont suggéré qu’un réarrangement sigmatropique soit l’étape limitant le taux.
R. Ding, Y. Li, C. Tao, B. Cheng, H. Zhai, Org. Lett., 2015,17, 3994-3997.

Une procédure rapide et pratique en une étape permet la conversion de composés carbonylés α,β-insaturés en leurs bromo-énones correspondantes à température ambiante dans des conditions très douces et avec des rendements élevés en utilisant NBS-Et3N – 3 HBr en présence de carbonate de potassium dans le dichlorométhane.
D. Jyothi, S. HariPrasad, Synlett, 2009, 2309-2311.

Une cyanoimidation douce, en un pot, d’aldéhydes utilisant le cyanamide comme source d’azote et le NBS comme oxydant a été réalisée avec des rendements élevés sans l’ajout d’un catalyseur. Par la suite, les produits N-cyanobenzimidate substitués peuvent également subir une réaction de cyclisation pour donner des dérivés de 1,2,4-triazole avec des rendements élevés.
P. Yin, W.-B. Ma, Y. Chen, W.-C. Huang, Y. Deng, L. He, Org. Lett., 2009,11, 5482-5485.

Sm(OTf)3 est un catalyseur efficace et polyvalent pour une alkylation de Friedel-Crafts (F-C) hautement régio- et stéréosélective, promue par un halogène, d’arènes riches en électrons avec des alcènes et des composés carbonylés α,β-insaturés en présence de NBS ou I2 comme sources d’halogène.
S. Haira, B. Maji, S. Bar, Org. Lett., 2007,9, 2783-2786.

Une nouvelle réaction de difonctionnalisation hautement régio- et stéréosélective d’alcynes terminaux simples, catalysée par l’argent, donne des dérivés d’acétate de (Z)-β-haloenol avec de bons rendements. Les produits obtenus sont des intermédiaires polyvalents en synthèse organique.
Z. Chen, J. Li, H. Jiang, S. Zhu, Y. Li, C. Qi, Org. Lett., 2010,12, 3262-3265.

Un nouveau procédé d’aminobromation des oléfines donne des dérivés bromoaminés vicinaux à haut rendement en utilisant des catalyseurs Cu, Mn ou V avecp-toluènesulfonamide comme source d’azote et N-bromosuccinimide(NBS) comme source de brome. Une excellente régio- et stéréosélectivité est montrée pour différents substrats oléfiniques ainsi que pour les catalyseurs de métaux de transition.
V. V. Thakur, S. K. Talluri, A. Sudalai, Org. Lett., 2003,5, 861-864.

Une aminobromation des alcènes catalysée par le fer, pratique et efficace, a été développée en utilisant du FeCl2 peu coûteux comme catalyseur, des amides/sulfonamides et du NBS comme sources d’azote et de brome, respectivement, dans des conditions douces.
Z. Wang, Y. Zhang, H. Fu, Y. Jiang, Y. Zhao, Synlett, 2008, 2667-2668.

Dans une bromoamidation efficace, sans catalyseur et sans métal d’oléfines non activées, le 4-(trifluorométhyl)benzènesulfonamide et le N-bromosuccinimide ont été utilisés comme sources d’azote et d’halogène, respectivement. La méthodologie est applicable aux oléfines cycliques et aliphatiques.
W. Z. Yu, F. Chen, Y. A. Cheng, Y.-Y. Yeung, J. Org. Chem., 2015,80, 2815-2821.

Une réaction efficace de couplage croisé radicalaire sans catalyseur entre des aldéhydes aromatiques et des sulfoximines a eu lieu en présence de N-bromosuccinimide comme initiateur radicalaire sous irradiation par micro-ondes pour donner les sulfoximines acylées correspondantes en bons rendements.
K. K. Rajbongshi, S. Ambala, T. Govender, H. G. Kruger, P. I. Arvidsson, T. Naicker, Synthesis, 2020, 52, 1279-1286.

Une nouvelle réaction électrophile en un pot d’une oléfine, d’un cyanimide, d’une amine et de N-bromosuccinimide permet la synthèse de plusieurs dérivés de guanidine avec de très bons rendements – dont un précurseur de rTRTVI.
L. Zhou, J. Chen, J. Zhou, Y.-Y. Yeung, Org. Lett. 2011,13, 5804-5807.

Une arylation et une vinylation stéréosélectives d’alcènes sans catalyseurs à base de métaux de transition ont lieu par le biais d’un réarrangement intéressant de semipinacol promu par NBS dans des conditions douces et d’une fragmentation Grob ultérieure inhabituelle médiée par NaOH.
D.-Y. Yuan, Y.-Q. Tu, C.-A. Fan, J. Org. Chem., 2008,73, 7797-7799.

Une nouvelle synthèse monopot initiée par Br cationique utilisant une oléfine, un nitrile, une amine et un N-bromosuccinimide donne des imidazolines avec de bons rendements. Les substrats oléfiniques et les partenaires nitriles peuvent être variés de manière flexible pour obtenir une gamme de dérivés d’imidazoline.
L. Zhou, J. Zhou, C. K. Tan, J. Chen, Y.-Y. Yeung, Org. Lett. 2011,13, 2448-2451.

Une synthèse directe médiée par le N-bromosuccinimide de 2,5-diaryloxazoles à partir de N-H cétoaziridines procède par la formation in situ de N-bromokétoaziridines suivie de la génération de ylides d’azométhine.
H. S. Samimi, F. Dadvar, Synthesis, 2015, 47, 1899-1904.

Les 3-oxazoline-4-carboxylates en tant qu’intermédiaires de synthèse facilement disponibles peuvent être oxydés pour donner des oxazole-4-carboxylates. En outre, la dérivatisation des 3-oxazoline-4-carboxylates avec des réactifs de Grignard permet une préparation facile de dérivés de 4-céto-oxazole.
K. Murai, Y. Takahara, T. Matsushita, H. Komatsu, H. Fujioka, Org. Lett., 2010,12, 3456-3459.

Les 2-amino-4-alkyl- et 2-amino-4-arylthiazole-5-carboxylates et leurs analogues sélénazolés ont été synthétisés par α-halogénation de β-céto esters avec le N-bromosuccinimide, suivie d’une cyclisation avec la thiourée ou la sélénourée, respectivement, en présence de β-cyclodextrine dans l’eau à 50°C.
M. Narender, M. S. Reddy, V. P. Kumar, B. Srinivas, R. Sridhar, Y. V. D. Nageswar, K. R. Rao, Synthesis, 2007, 3469-3472.
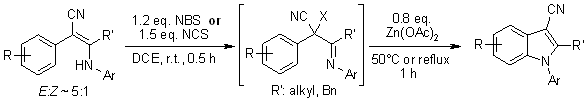
Divers 2-aryl-3-arylamino-2-alkénenitriles donnent des N-arylindole-3-carbonitriles de manière one-pot par halogénation médiée par NBS ou NCS suivie d’une cyclisation intramoléculaire catalysée par Zn(OAc)2. Le processus implique la formation d’intermédiaires d’ions arylnitrenium, qui subissent une substitution aromatique électrophile pour donner les N-arylindoles cyclisés.
Q. Yan, J. Luo, D. Zhang-Negrerie, H. Li, X. Qi, K. Zhao, J. Org. Chem., 2011,76, 8690-8697.

les sulfoxydes de butyle peuvent être utilisés comme sources de sulfinyle dans une sulfinylation intramoléculaire de sulfonamides suivie d’un processus de Wittig-équivalent tout-hétéroatome pour donner des arylisothiazoles à haut rendement.
F. Xu, Y. Chen, E. Fan, Z. Sun, Org. Lett., 2016, 18, 2777-2779.

Une cyclisation halogénative sans catalyseur de N-aryl diazoamides avec des N-halosuccinimides (NXS) fournit des 3-halooxindoles en bons rendements par un mécanisme sans carbène dans des conditions douces et sans catalyseur. On propose que cette transformation procède par la formation d’ions diazonium suivie d’une alkylation intramoléculaire de Friedel-Crafts.
C. Ma, D. Xing, W. Hu, Org. Lett., 2016, 18, 3134-3137.

Une nouvelle méthodologie pour la synthèse de 2-oxazolines diversement substituées et d’une dihydrooxazine en utilisant des aldéhydes, des aminoalcools et du N-bromosuccinimide comme agent oxydant est décrite. Cette synthèse en un pot est caractérisée par des conditions de réaction douces, un large champ d’application, des rendements élevés et sa simplicité préparatoire.
K. Schwekendiek, F. Glorius, Synthesis, 2006, 2996-3002.

Une cyclisation catalysée par l’or d’intermédiaires de β-amino-ynone et un processus d’halodésauration permettent une synthèse rapide et efficace d’halopyridone en une étape.
K. H. Nguyen, S. Tomasi, M. Le Roch, L. Toupet, J. Renault, P. Uriac, N. Gouault, J. Org. Chem., 2013,78, 7809-7815.

Une réaction polyvalente et très efficace en un pot catalysée par Zn(OTf)2 d’alcènes, de NBS, de nitriles et de TMSN3 donne divers tétrazoles 1,5-disubstitués contenant une fonctionnalité α-bromo supplémentaire du substituant N1-alkyle.
S. Hajra, D. Sinha, M. Bhowmick, J. Org. Chem., 2007,72, 1852-1855.

Une synthèse en un pot d’arylsulfones à partir d’alcools primaires est décrite. Les alcools ont été traités avec du N-bromosuccinimide et de la triphénylphosphine, suivis par l’addition d’arènesulfinate de sodium avec une quantité catalytique d’iodure de tétrabutylammonium pour donner les arylsulfones avec des rendements bons à élevés.
T. Murakami, K. Furusawa, Synthesis,2002, 479-482.

Les sulfoxydes portant un groupe tert-butyle peuvent être activés en utilisant le N-bromosuccinimide (NBS) dans des conditions acides. Un traitement ultérieur avec divers nucléophiles d’azote, de carbone ou d’oxygène donne une large gamme d’amides d’acide sulfinique, de nouveaux sulfoxydes et d’esters d’acide sulfinique.
J. Wei, Z. Sun, Org. Lett., 2015,17, 5396-5399.

Le cyanure sert de médiateur à une génération in situ d’un ion sulfinate nucléophile à partir de sulfones vinyliques. Une S-alkylation in situ subséquente fournit des sulfones à haut rendement. En présence de N-bromosuccinimide, les amines primaires et secondaires subissent la formation de sulfonamide.
T. Roy, J.-W. Lee, Synlett, 2020, 31, 455-458.

Les thiosulfonates synthétisés par dimérisation aérobie catalysée par le cuivre servent de substrat pour des stratégies simples et à haut rendement pour la production d’une variété de sulfones et de sulfamides. Les thiosulfinates sont des alternatives stables et non toxiques aux sels sulfinates métalliques dérivés du SO2 toxique.
P. K. Shyam, H.-Y. Jang, J. Org. Chem., 2017, 82, 1761-1767.

La synthèse de N-cyanosulfilimines peut facilement être réalisée par réaction des sulfures correspondants avec une amine cyanogène en présence d’une base et de NBS ou I2 comme agents halogénants. L’oxydation suivie de la décyanation permet d’obtenir des sulfoximines utiles sur le plan synthétique.
O. García Mancheño, O. Bistri, C. Bolm, Org. Lett., 2007,9, 3809-3811.

Dans une transformation en cascade en un pot de cétones en α-imidocétones, le N-bromosuccinimide (NBS) fournit à la fois du brome électrophile et des sources d’azote nucléophiles, et le diazabicycloundec-7-ène (DBU) fonctionne comme une base et un promoteur nucléophile pour l’activation du NBS. L’α-Bromination est supposée être l’étape clé du processus.
Y. Wei, S. Lin, F. Liang, Org. Lett. 2012,14, 4202-4205.