La motilité est la capacité d’un organisme à se déplacer par lui-même au moyen de flagelles en forme d’hélice propres aux bactéries ou par des fibrilles spéciales qui produisent une forme glissante de motilité. Les bactéries mobiles se déplacent à l’aide de flagelles, appendices locomoteurs filiformes qui s’étendent vers l’extérieur de la membrane plasmique et de la paroi cellulaire, qu’il s’agisse d’un seul ou de plusieurs flagelles. La motilité est reconnue depuis longtemps comme un outil taxonomique important et une caractéristique biologique des micro-organismes. La présence de flagelles se produit principalement chez les bacilles mais il existe quelques cocci flagellés, la motilité est donc un moyen d’identification très important dans la famille des Enterobacteriaceae. Depuis les premiers jours dans le domaine de la microbiologie, la capacité des bactéries à se déplacer a été utilisée comme un moyen de différenciation et de classification des organismes.
Objectif
- Déterminer la motilité de la bactérie.
- Différencier les bactéries motiles et non motiles.
Principe
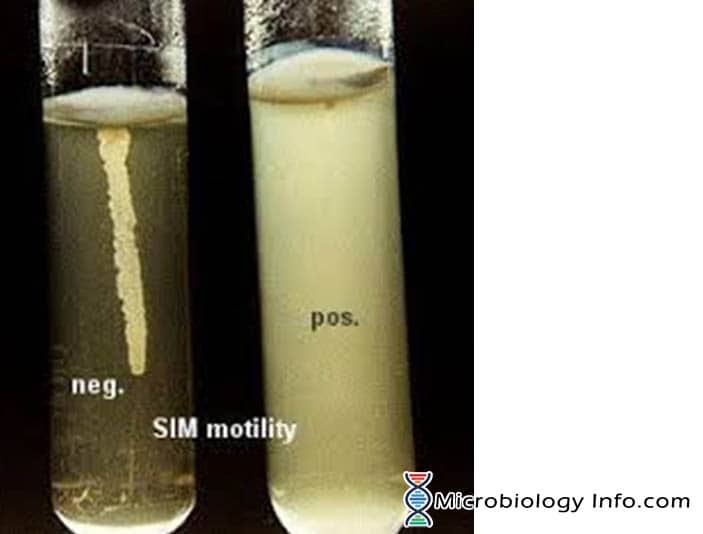
La motilité de la bactérie est principalement démontrée dans un milieu gélosé semi-solide. Dans un milieu gélosé semi-solide, les bactéries motiles » pullulent » et donnent une croissance diffuse qui s’étale facilement à l’œil nu.Le milieu principalement utilisé à cet effet est le milieu SIM (Sulphide Indole Motility medium) qui est un milieu différentiel combiné qui teste trois paramètres différents, la réduction du soufre, la production d’indole et la motilité. Ce milieu a une consistance très molle qui permet aux bactéries mobiles de migrer facilement à travers lui, ce qui provoque un trouble. L’inoculum est poignardé au centre d’une gélose semi-solide profonde. La motilité bactérienne est mise en évidence par une zone diffuse de croissance s’étendant à partir de la ligne d’inoculation. Certains organismes se développent sur l’ensemble du milieu, tandis que d’autres présentent de petites zones ou nodules qui se développent à partir de la ligne d’inoculation. Les bactéries non mobiles ne se développent que dans le tube de gélose molle et uniquement dans la zone où elles sont inoculées.
Milieu:
MilieuSIM
Digestif pancréatique de caséine 20,0g, Digest peptique de tissu animal 6,1g, Gélose 3,5g, Fe(NH4)2(SO4)2-6H2O 0.2g, Na2S2O3-5H2O 0.2g, pH 7.3 ± 0.2 à 25°C
Méthode
- Touchez avec une aiguille droite une colonie d’une jeune (18 à 24 heures) culture se développant sur un milieu agar.
- Tabourez une fois à une profondeur de seulement 1/3 à ½ pouce au milieu du tube. Assurez-vous de garder l’aiguille dans la même ligne qu’elle a pénétrée lorsqu’elle est retirée du milieu.
- Incubez à 35°-37°C et examinez quotidiennement jusqu’à 7 jours.
- Observez une zone diffuse de croissance s’évasant de la ligne d’inoculation.
Résultats attendus
- Positif : Des croissances diffuses et brumeuses qui se répandent dans le milieu le rendant légèrement opaque.
- Négatif : Croissance confinée à la ligne de stabulation, avec des marges bien définies et laissant le milieu environnant clairement transparent.
Utilisations
- Il est utilisé pour la différenciation des micro-organismes sur la base de la motilité en laboratoire.
- Il est effectué pour attribuer une classification taxonomique aux organismes.
- Les tests de motilité sont importants dans la caractérisation des agents pathogènes.
- Les tests sont souvent employés dans les protocoles d’identification de la famille des Enterobacteriaceae
- Le test de motilité est également utilisé pour la différenciation des espèces de cocci gram positifs, Enterococci. Enterococcus faecium et E. faecalis sont non mobiles, tandis que E. gallinarum et E. casseliflavus/E. flavescens sont généralement mobiles.
Limitations
- Certains organismes ne présenteront pas une croissance suffisante dans ce milieu pour effectuer une détermination précise, et des tests de suivi supplémentaires sont nécessaires.
- Il est recommandé d’effectuer des tests biochimiques, immunologiques, moléculaires ou de spectrométrie de masse sur des colonies provenant d’une culture pure pour une identification complète.
- Des réactions faussement négatives peuvent se produire si les flagelles bactériens sont endommagés en raison du chauffage, de l’agitation ou d’un autre traumatisme. Un tel choc environnemental rendra l’organisme non mobile.
- Les organismes qui sont faiblement mobiles peuvent donner lieu à des réactions faussement négatives.
- Lorsque l’on inocule des milieux semi-solides, il est important que l’aiguille d’inoculation soit retirée le long de la ligne exacte utilisée pour inoculer le milieu. Un mouvement d’éventail peut entraîner une croissance le long de la ligne de l’aiguille qui peut entraîner une interprétation faussement positive.
- Tille, P. M., & Forbes, B. A. (2014). Microbiologie diagnostique de Bailey & Scott (treizième édition.). St. Louis, Missouri : Elsevier.
- Cappuccino J.G. et Sherman N. 2008. Microbiologie : Un manuel de laboratoire, 8e éd. Pearson Benjamin Cummings, San Francisco, CA, USA.
- vlab.amrita.edu/?sub=3&brch=73&sim=697&cnt=1
- www.asmscience.org/content/education/protocol/protocol.3658.
- https://catalog.hardydiagnostics.com/cp_prod/Content/hugo/MotilityTestMedia.htm