August 20, 2018
High Flow Nasal Cannula (HFNC) – Teil 1: Wie es funktioniert
 Die Verwendung der beheizten und befeuchteten High-Flow-Nasenkanüle (HFNC) wird bei der Behandlung von Patienten mit akutem Atemversagen über alle Altersgruppen hinweg immer beliebter. Ich habe sie zum ersten Mal als pädiatrischer Intensivmediziner verwendet, hatte aber nur wenig Wissen darüber, wie sie tatsächlich funktioniert. Nachdem ich es einige Jahre lang erfolgreich bei Kindern, hauptsächlich mit schwerer Bronchiolitis, eingesetzt hatte, bemerkte ich, dass wir begannen, es auch auf der Intensivstation für Erwachsene zu verwenden. Es scheint, dass in den letzten Jahren viele Studien erschienen sind, die die Wirkmechanismen sowie den Einsatz bei einer Vielzahl von Erkrankungen untersuchen. In diesem Teil werden wir zusammenfassen, wie sie funktioniert, und in Teil 2 werden wir die Hauptindikationen für ihre Verwendung bei erwachsenen und pädiatrischen Patienten besprechen.
Die Verwendung der beheizten und befeuchteten High-Flow-Nasenkanüle (HFNC) wird bei der Behandlung von Patienten mit akutem Atemversagen über alle Altersgruppen hinweg immer beliebter. Ich habe sie zum ersten Mal als pädiatrischer Intensivmediziner verwendet, hatte aber nur wenig Wissen darüber, wie sie tatsächlich funktioniert. Nachdem ich es einige Jahre lang erfolgreich bei Kindern, hauptsächlich mit schwerer Bronchiolitis, eingesetzt hatte, bemerkte ich, dass wir begannen, es auch auf der Intensivstation für Erwachsene zu verwenden. Es scheint, dass in den letzten Jahren viele Studien erschienen sind, die die Wirkmechanismen sowie den Einsatz bei einer Vielzahl von Erkrankungen untersuchen. In diesem Teil werden wir zusammenfassen, wie sie funktioniert, und in Teil 2 werden wir die Hauptindikationen für ihre Verwendung bei erwachsenen und pädiatrischen Patienten besprechen.
Die beheizte und befeuchtete High Flow Nasenkanüle oder, wie sie von den meisten genannt wird, die Hi Flow Nasenkanüle (HFNC), ist nicht einfach eine Standard-Nasenkanüle, die auf sehr hohe Durchflussraten hochgefahren wird. Sie nimmt tatsächlich Gas auf und kann es auf 37 o C mit einer 100%igen relativen Luftfeuchtigkeit erhitzen und 0,21 – 1,00% fi02 bei Flussraten von bis zu 60 Litern/min liefern. Die Flussrate und das fi02 können unabhängig voneinander titriert werden, basierend auf den Anforderungen Ihres Patienten an Fluss und fi02.

Es gibt 2 Hauptfirmen, die diese Geräte herstellen: Vapotherm mit einem Gerät, das Durchflussraten von bis zu 50 Liter/Min. liefern kann und Fisher Paykall, der sowohl das Optiflow als auch das AIRVO 2 Gerät anbietet, die beide Durchflussraten von bis zu 60 Liter/Min. liefern können.
 Jede Firma bietet kleinere Kanülengrößen für Frühgeborene sowie Kinder verschiedenen Alters bis hin zu Kanülen für Erwachsene an. Jede Kanüle sollte gut in die Nasen des Patienten passen und verhindert das Mitreißen von Raumluft um die Kanüle, was bei Standard-Nasenkanülen vorkommen kann. Jeder Hersteller gibt auch eine maximale Durchflussrate für jede Kanülengröße an, die der Größe und dem Alter des Patienten entspricht.
Jede Firma bietet kleinere Kanülengrößen für Frühgeborene sowie Kinder verschiedenen Alters bis hin zu Kanülen für Erwachsene an. Jede Kanüle sollte gut in die Nasen des Patienten passen und verhindert das Mitreißen von Raumluft um die Kanüle, was bei Standard-Nasenkanülen vorkommen kann. Jeder Hersteller gibt auch eine maximale Durchflussrate für jede Kanülengröße an, die der Größe und dem Alter des Patienten entspricht.
Wie es funktioniert:
Erhitzter &befeuchteter:
Erhitzter und befeuchteter Sauerstoff hat eine Reihe von Vorteilen im Vergleich zur Standard-Sauerstofftherapie. Eine Standard-Sauerstofftherapie, die über eine Nasenkanüle oder ein anderes Gerät, wie z. B. eine Rückatemhilfe, verabreicht wird, ist kalt (nicht erwärmt) und trocken (nicht befeuchtet). Dies kann zu einer Entzündung der Atemwege führen, was den Atemwegswiderstand erhöhen und die mukoziliäre Funktion beeinträchtigen kann, was möglicherweise zu einer verminderten Sekretabgabe führt (1). Außerdem wird bei Personen eine erhebliche Menge an Kalorien verbraucht, um das Gas während der normalen Atmung sowohl zu erwärmen als auch zu befeuchten (2).
HFNC kann Gas erwärmen (auf 37oC) und befeuchten, was die Entzündung der Atemwege verringern, die mukoziliäre Funktion aufrechterhalten, die Schleimclearance verbessern und den Kalorienverbrauch bei akuter respiratorischer Insuffizienz verringern kann (1-2).
Inspiratorische Anforderungen:
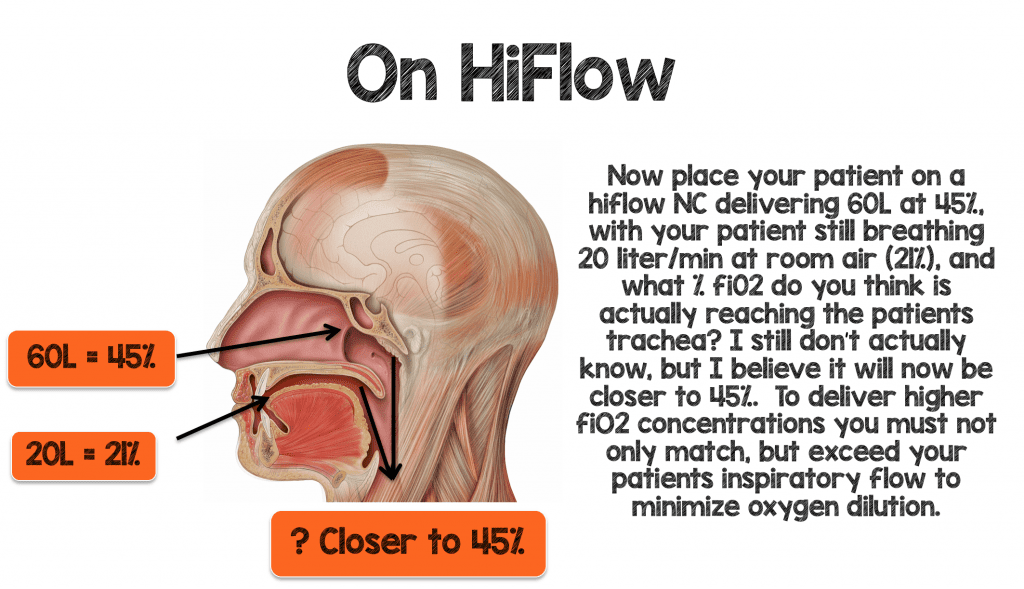
Ein offensichtlicher, aber erwähnenswerter Vorteil ist, dass ein hoher Flow einen sehr hohen Gasfluss liefern kann. Dies ist wichtig, da Patienten mit akutem Atemversagen extrem tachypnoisch sein können und daher ihre inspiratorischen Spitzenflüsse, die normalerweise 30L/min – 60L/min betragen können, bis zu 120 L/min erreichen können (3). Wenn Sie also Ihren tachypnoischen Patienten mit einer PIF-Rate von 120 L/min und einem Minutenvolumen >20 L/min auf eine NRB-Maske mit 15 L/min legen, helfen Sie ihm möglicherweise nicht so sehr, wie Sie denken. Ich werde auf diesen Punkt etwas später in dieser Übersicht eingehen, wenn wir das Konzept der Sauerstoffverdünnung besprechen.
Funktionelle Restkapazität:
Sie haben vielleicht nach dem Aufzählungspunkt gesucht, der besagt, dass Hi Flow PEEP bietet, und Sie können ihn nicht finden? Es gab einige Diskussionen darüber, wie viel PEEP ein High Flow Gerät wirklich liefern kann. Es wurde gezeigt, dass HFNC bei geschlossener Mundatmung bis zu 1 mm Hg PEEP für jede 10 l/min gelieferten Flow liefert. (4-5)
Ich bin mir nicht sicher, ob dies auf alle Patienten zutrifft, und zwar deshalb, weil es viele Faktoren gibt, die beeinflussen können, wie viel PEEP einem Patienten tatsächlich zugeführt werden kann. Faktoren wie die Größe des Patienten (fettleibig, Erwachsener, Kind), die abgegebene Literflussrate (L/Min) und die Atmung mit offenem oder geschlossenem Mund (Druck kann entweichen, wenn der Mund des Patienten offen ist) können alle die Menge des abgegebenen PEEP beeinflussen (4)
Die Debatte kann weitergehen, aber es scheint, dass HFNC das funktionelle Residualvolumen (FRC) eines Patienten oder das Lungenvolumen am Ende der Exspiration erhöhen kann, was PEEP normalerweise verbessert. Eine Studie von Riera J. et al. zeigte, dass die Anwendung von HFNC die endexspiratorische Lungenimpedanz (EELI) erhöht, was eine Verbesserung des FRC bedeutet (6). Sie verwendeten die elektrische Impedanztomographie (EIT), eine nicht-invasive Echtzeit-Bildgebungsmethode, die ein Ventilationsquerschnittsbild der Lunge liefert, um eine erhöhte endexspiratorische Lungenimpedanz (EELI) zu demonstrieren.
Es scheint auch, dass die Verwendung von HFNC die Vorlast durch Erhöhung des intrathorakalen Drucks verringern kann, was wiederum ein weiteres Merkmal ist, das üblicherweise dem PEEP zugeschrieben wird. Roca et al. zeigten in einer sequenziellen Intervallstudie an 10 Patienten (NYHA III Herzinsuffizienz, aber nicht in einer akuten CHF-Exazerbation), dass die Anwendung von Hi Flow einen inspiratorischen Kollaps der inferioren Vena cava (IVC) gegenüber dem Ausgangswert der Patienten verursachte, gemessen per Echokardiogramm (7).
Hi Flow scheint eine alveoläre Rekrutierung und einen erhöhten FRC sowie einen Anstieg des intrathorakalen Drucks zu bewirken, der wahrscheinlich auf den zusätzlichen PEEP zurückzuführen ist. Es ist jedoch nicht sicher, ob nicht vielleicht ein anderer Mechanismus für diese Befunde verantwortlich ist.
Leichter:
Patienten bevorzugen oft die Verwendung von HFNC gegenüber der nicht-invasiven Überdruckbeatmung (CPAP oder BPAP), da die eng anliegende Maske für einige Patienten unangenehm sein kann. Sie ziehen sie vielleicht sogar der Standard-NC vor, weil die erwärmten, befeuchteten Gase ihre Schleimhäute nicht austrocknen wie bei der Standard-Sauerstofftherapie (5). Dies kann zu einer höheren Compliance mit der HFNC und vielleicht zu einer Verbesserung der Oxygenierung und der Atemarbeit Ihres Patienten führen.
O2-Verdünnung:
Ich habe während meines Praktikums auf der Intensivstation gelernt, dass jeder 1 Liter über die Nasenkanüle ~4% fiO2 über Raumluft (21%) liefert. Also sollte 1 Liter/min über die NC ~ 25% fiO2 liefern, und 2 Liter/min sollten 29% fiO2 liefern (siehe Tabelle 1 unten). Ich habe jahrelang geglaubt, dass diese „1:4-Regel“ wahr ist, aber schauen wir mal, ob sie für einen Patienten mit akuter Atemnot Sinn macht

Stellen Sie sich einen 70 kg schweren Mann vor, der mit 30-40 bpm und normalen Tidalvolumina (~500 mL) atmet und eine Hypoxämie entwickelt. Die Minutenventilation dieses Patienten würde zwischen 15-20 Litern/Minute liegen. Sie entscheiden sich, diesen Patienten auf 6 Liter/Min. NC zu setzen, was theoretisch einen fiO2 ~ 45% liefern sollte (6L x 4% = 24 + Raumluft (21%) = 45%), wenn die „1:4-Regel“ gilt. Wenn dieser Patient 15-20 l durch den Mund und durch die Nasenlöcher (um die Nasenkanüle herum) mit 21 % atmet, glauben Sie dann, dass dieser Patient tatsächlich 45 % fiO2 an die Trachea geliefert bekommt?
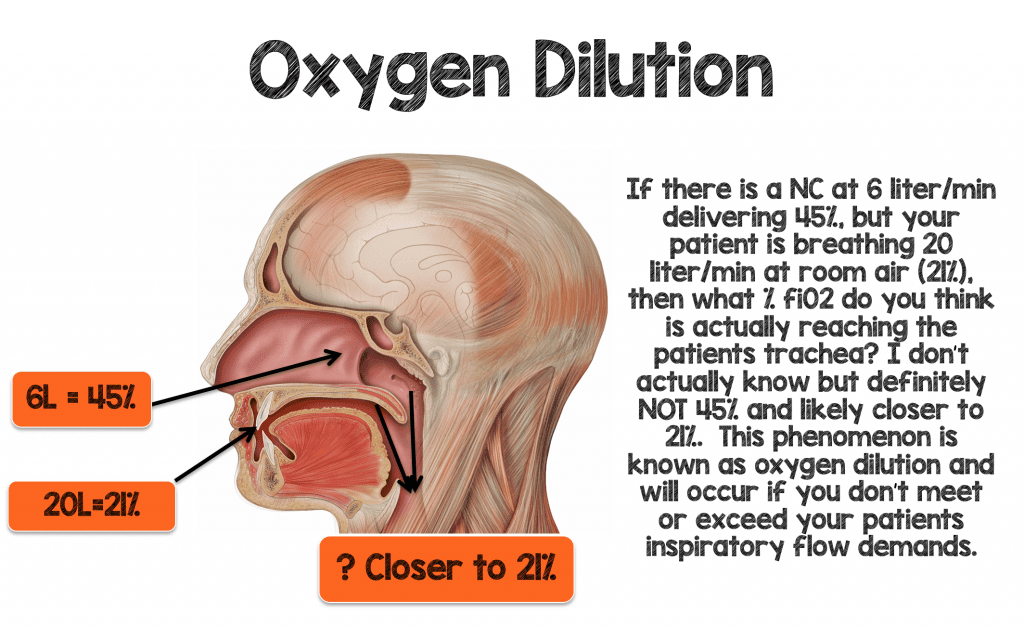
Um höhere Mengen an fiO2 effektiv an Ihren Patienten zu liefern, müssen Sie nicht nur mit den minütlichen Beatmungs- und Inspirationsanforderungen Ihres Patienten übereinstimmen, sondern diese übertreffen, um die Sauerstoffverdünnung zu minimieren.
Auswaschung des Totraums:
Normalerweise atmen wir ein Drittel unseres zuvor ausgeatmeten Tidalvolumens wieder ein und atmen statt 21% (Raumluft) und vernachlässigbare Mengen Kohlendioxid; wir atmen eher 15-16% Sauerstoff und 5-6% Kohlendioxid wieder ein. Dies liegt daran, dass der zuvor ausgeatmete Atem (sauerstoffarm und mit etwas Kohlendioxid) nicht vollständig ausgeatmet wird und in den oberen Atemwegen verbleibt. Wenn Ihr Patient den nächsten Atemzug mit atmosphärischem Gas macht, gelangt nicht das gesamte Gas in die Alveolen. Vielmehr ist es eine Mischung aus dem neuen atmosphärischen Gas (21 % 02, vernachlässigbares CO2) und dem zuvor ausgeatmeten Gas (<21 % Sauerstoff und etwas CO2). Bei Patienten mit akutem Atemversagen wird der prozentuale Anteil des Gases, das wir zurückatmen, größer, und infolgedessen können wir größere Mengen an Kohlendioxid zurückatmen, da wir unsere Atemzüge aus einem gemischten Reservoir aus unseren oberen Atemwegen ziehen. Eine andere Art, dies zu sagen, ist, dass unser toter Raum bei akutem Atemversagen zunimmt.
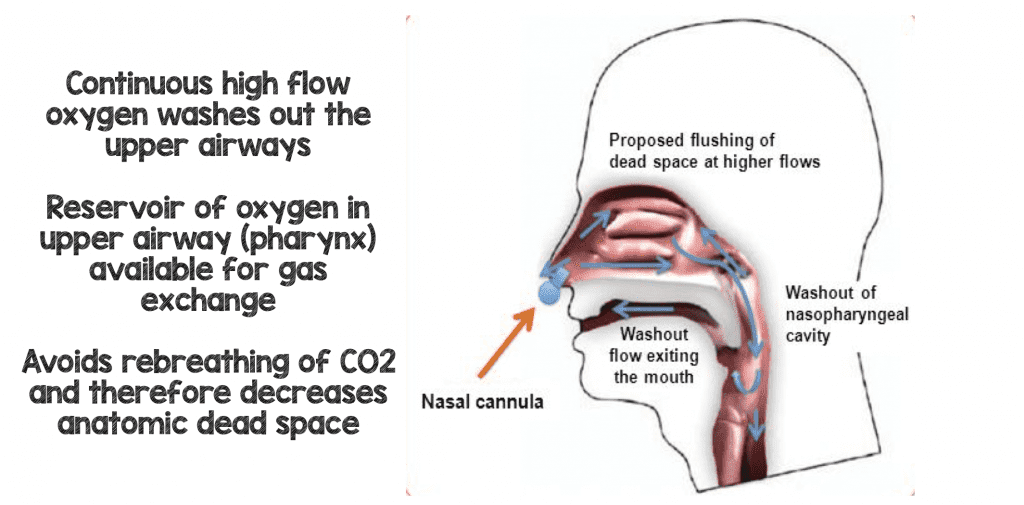
Einer der Hauptvorteile der HFNC (manche sagen, es ist sogar der Hauptvorteil) ist, dass Sie einen kontinuierlichen Fluss von frischem Gas mit hohen Flussraten erhalten, der den toten Raum im Rachen des Patienten (das alte Gas mit niedrigem Sauerstoffgehalt und hohem CO2-Gehalt) ersetzt oder ausspült. Bei jedem Atemzug, den der Patient nun wieder einatmet, wird das Kohlendioxid ausgewaschen und durch sauerstoffreiches Gas ersetzt, was die Atmungseffizienz verbessert (8).

Gastbeitrag verfasst von

Thomas Lettich, D.O.
Internal Medicine/Pediatrics Resident Physician
Geisinger Medical Center
Danville, Pennsylvania
- Chidekel, A et al. The Effects of Gas Humidification with High-Flow Nasal Cannula on Cultured Human Airway Epithelial Cells. Pulmonary Medicine 2012. PMID: 22988501
- Dysart, K et al. Research in High Flow Therapy: Mechanisms of Action. Respiratory Medicine 2009. PMID: 19467849
- Katz, JA et al. Inspiratorische Arbeit mit und ohne kontinuierlichen positiven Atemwegsdruck bei Patienten mit akutem Atemversagen. Anesthesiology 1985. PMID: 3904528
- Parke R et al. Drücke, die durch nasalen High-Flow-Sauerstoff während aller Phasen des Atemzyklus bereitgestellt werden. Respiratory Care 2013. PMID: 23513246
- Frat JP et al. High-Flow Nasal Oxygen Therapy and Noninvasive Ventilation in the Management of Acute Hypoxemic Respiratory Failure. Annals of Translational Medicine 2017). PMID: 28828372
- Riera J et al. Effect of High-Flow Nasal Cannula and Body Position on End-Expiratory Lung Volume: A Cohort Study Using Electrical Impedance Tomography. Respiratory Medicine 2013. PMID: 23050520
- Roca O et al. Patients with New York Heart Association Class III Heart Failure may Benefit with High Flow Nasal Cannula Supportive Therapy: High Flow Nasal Cannula in Heart Failure. Journal Crit Care 2013. PMID: 23602035
- Möller W et al. Nasal High Flow Clears Anatomical Dead Space in Upper Airway Models. Journal of Applied Physiology 2015). PMID: 25882385
Support the Show by Paying & Claiming 0.5hrs of CME/CEH by Clicking on the Logo below

Post Peer Reviewed By: Salim R. Rezaie, MD (Twitter: @srrezaie)
- Bio
- Letzte Beiträge
Frank Lodeserto MD
Neueste Beiträge von Frank Lodeserto MD (alle anzeigen)
- The RELAx Trial: Was ist der optimale PEEP bei Patienten ohne ARDS? – 1. Februar 2021
- COVID-19 Update: Der COVID-19-Impfstoff von Pfizer – 15. Dezember 2020
- Hämophagozytische Lymphohistiozytose (HLH): Eine Zebra-Diagnose, die wir alle kennen sollten – 30. Juli 2020