Competenze da sviluppare
- Descrivere come gli elettroni sono raggruppati negli atomi.
Anche se abbiamo discusso la disposizione generale delle particelle subatomiche negli atomi, abbiamo detto poco su come gli elettroni occupano lo spazio intorno al nucleo. Si muovono intorno al nucleo in modo casuale, o esistono in una disposizione ordinata?
La moderna teoria del comportamento degli elettroni è chiamata meccanica quantistica. Fa le seguenti affermazioni sugli elettroni negli atomi:
- Gli elettroni negli atomi possono avere solo certe energie specifiche. Diciamo che le energie degli elettroni sono quantizzate.
- Gli elettroni sono organizzati secondo le loro energie in gruppi chiamati gusci. In generale, più alta è l’energia di un guscio, più è lontano (in media) dal nucleo. I gusci non hanno distanze specifiche e fisse dal nucleo, ma un elettrone in un guscio ad alta energia passerà più tempo lontano dal nucleo rispetto ad un elettrone in un guscio a bassa energia.
- I gusci sono ulteriormente divisi in sottogruppi di elettroni chiamati sottogruppi. Il primo guscio ha un solo sottoguscio, il secondo guscio ha due sottogusci, il terzo guscio ha tre sottogusci, e così via. I sottogusci di ogni guscio sono etichettati, in ordine, con le lettere s, p, d e f. Così, il primo guscio ha solo un sottoguscio s, il secondo guscio ha un sottoguscio s e uno p, il terzo guscio ha sottogusci s, p e d, e così via.
- Diversi sottogusci contengono un diverso numero massimo di elettroni. Ogni sottoguscio s può contenere fino a 2 elettroni; p supshell fino a 6 elettroni; d subshell fino a 10; e f subshell fino a 14.
È la disposizione degli elettroni nei gusci che ha il maggior effetto sulle proprietà chimiche, quindi qui ci concentreremo principalmente sui gusci.
Usiamo i numeri per indicare in quale guscio si trova un elettrone. Il primo guscio, il più vicino al nucleo e con gli elettroni a più bassa energia, è il guscio 1. Questo primo guscio ha un solo sottoguscio (etichettato come 1s) e può contenere un massimo di 2 elettroni. Questo è il motivo per cui ci sono due elementi nella prima riga della tavola periodica (H & He).
Perché il primo guscio può contenere solo un massimo di 2 elettroni, il terzo elettrone deve andare nel secondo guscio. Quindi il litio (Li), che ha tre elettroni totali, avrà due elettroni nel primo guscio e un elettrone nel secondo guscio. Notate che il litio è il primo elemento della seconda fila della tavola periodica.
Il secondo guscio ha due sottogusci (etichettati 2s e 2p). Il sottoguscio 2s contiene un massimo di 2 elettroni, e il sottoguscio 2p contiene un massimo di 6 elettroni. Ciò significa che il secondo guscio può contenere un massimo di otto elettroni (2+6=8). Nota che ci sono otto elementi nella seconda fila della tavola periodica.
Solo gli elettroni del guscio più esterno, chiamato guscio VALENCE, tendono a reagire (essere guadagnati, persi o condivisi). Si potrebbe immaginare che, se due atomi si scontrassero, sarebbero gli elettroni esterni ad interagire per primi. La seguente è una lista di elettroni totali, elettroni per guscio, ed elettroni di valenza per i primi 10 elementi.
- L’idrogeno ha 1 elettrone nel primo guscio (quindi un elettrone di valenza).
- L’elio ha 2 elettroni — entrambi nel primo guscio (quindi due elettroni di valenza).
- Il litio ha 3 elettroni — 2 nel primo guscio e 1 nel secondo guscio (quindi un elettrone di valenza).
- Il berillio ha 4 elettroni — 2 nel primo guscio e 2 nel secondo (quindi due elettroni di valenza).
- Il boro ha 5 elettroni — 2 nel primo guscio e 3 nel secondo guscio (quindi tre elettroni di valenza).
- Il carbonio ha 6 elettroni — 2 nel primo guscio e 4 nel secondo guscio (quindi quattro elettroni di valenza).
- L’azoto ha 7 elettroni — 2 nel primo guscio, e 5 nel secondo guscio (quindi cinque elettroni di valenza).
- L’ossigeno ha 8 elettroni — 2 nel primo guscio, e 6 nel secondo (quindi sei elettroni di valenza).
- Il fluoro ha 9 elettroni — 2 nel primo guscio, e 7 nel secondo guscio (quindi sette elettroni di valenza).
- Il neon ha 10 elettroni — 2 nel primo guscio, e 8 nel secondo (quindi otto elettroni di valenza).
La figura 2.6.1 elenca il numero atomico degli elementi del gruppo principale. Il numero atomico definisce il numero di protoni nel nucleo di ogni atomo. Per gli atomi neutri, il numero di protoni positivi sarà uguale al numero totale di elettroni negativi (carica netta zero). Per esempio, il bromo (Br) ha 35 protoni e 35 elettroni totali. Le tavole periodiche elencano sempre il numero atomico.

Figura 2.6.1 – Numero atomico per ogni elemento del gruppo principale
Il numero di elettroni di valenza per ogni elemento del gruppo principale può essere determinato dalla colonna, o gruppo, che occupa sulla tavola periodica. La tabella 2.6.2 qui sotto riassume il numero di elettroni di valenza per ogni colonna di elementi del gruppo principale. Per esempio, gli elementi della prima colonna (a volte etichettati IA), hanno tutti un elettrone di valenza. La seconda colonna (IIA) ha due elettroni di valenza. Saltiamo il breve blocco di dieci elementi nel mezzo perché è qui che un sottoguscio si riempie fuori ordine. Gli elementi nelle colonne IIIA, IVA, VA, VIA, e VIIA, e VIIIA* hanno rispettivamente tre, quattro, cinque, sei, sette e otto* elettroni di valenza.
*Nota che l’elio (He) ha solo due elettroni di valenza. Alcune tavole periodiche mettono l’elio nella colonna IIA, altre lo mettono in VIIIA, e alcune in entrambe le posizioni.
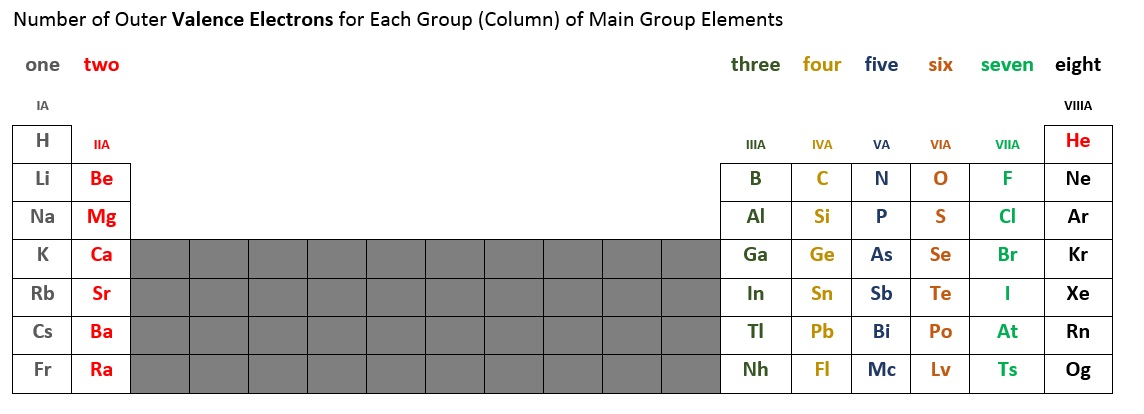
Figura 2.6.2 – Numero di elettroni di valenza per gli elementi del gruppo principale
Esempio \(\PageIndex{1}): Elettroni degli atomi di fosforo
Quanti elettroni totali e di valenza ci sono in un atomo di fosforo neutro?
SOLUZIONE
Un atomo di fosforo neutro ha 15 elettroni totali. Due elettroni possono andare nel primo guscio, otto nel secondo guscio, e ne ha altri cinque nel terzo guscio. Il terzo guscio è il guscio di valenza esterno, quindi ha 5 elettroni di valenza.
Il numero di elettroni in ogni guscio diventa più complicato man mano che si aggiungono altri elettroni perché ci sono più sottogusci utilizzati e perché i gusci iniziano a riempirsi fuori ordine. Per gli elementi con numero atomico maggiore di 20 (oltre il calcio), ci concentreremo solo su quanti elettroni totali e quanti di valenza, non sul numero in ogni guscio. Abbiamo detto che gli elettroni del guscio esterno sono chiamati di valenza. I gusci interni (non di valenza) e gli elettroni sono spesso chiamati nucleo.
Esempio \(\PageIndex{2}): Conteggio degli elettroni totali e di valenza negli atomi di xeno
Quanti elettroni totali, di valenza e di nucleo ci sono in un atomo neutro di xeno?
SOLUZIONE
Lo xeno ha 54 elettroni totali, 8 di valenza e 46 di nucleo.
Esercizi di ripasso dei concetti
- Come sono organizzati gli elettroni negli atomi?
- Qual è il numero massimo di elettroni che possono entrare nei primi due gusci di un atomo?
- Qual è la differenza tra elettroni del nucleo ed elettroni di valenza?
Risposte
- Gli elettroni sono organizzati in gusci e sottogusci attorno ai nuclei.
- Il primo guscio può contenere al massimo due elettroni e il secondo guscio può contenere al massimo otto elettroni.
- Gli elettroni di valenza si trovano nel guscio più numerato (esterno); tutti gli altri elettroni sono elettroni del nucleo.
Key Takeaway
- Gli elettroni sono organizzati in gusci e sottogusci attorno al nucleo di un atomo.
Contribuenti
-
Anonimo