Basicità delle ammine eterocicliche
Quando un atomo di azoto è incorporato direttamente in un anello aromatico, la sua basicità dipende dal contesto di legame. In un anello di piridina, per esempio, la coppia solitaria dell’azoto occupa un orbitale sp2-ibrido, e non fa parte del sestetto aromatico – è essenzialmente un azoto immina. La sua coppia di elettroni è disponibile per formare un legame con un protone, e quindi l’atomo di azoto della piridina è in qualche modo basico.

In un anello pirrolico, al contrario, la coppia solitaria di azoto fa parte del sestetto aromatico. Questo significa che questi elettroni sono molto stabili proprio dove sono (nel sistema aromatico), e sono molto meno disponibili per legarsi a un protone (e se prendono un protone, il sistema aromatico viene distrutto). Per queste ragioni, i nitrogeni del pirrolo non sono fortemente basici.

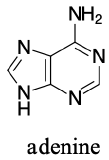
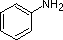
Gli esempi di anilina, piridina e pirrolo sono buoni modelli per prevedere la reattività degli atomi di azoto in sistemi ad anello più complessi (di cui si trova una grande varietà in natura). La catena laterale del triptofano, per esempio, contiene un azoto ‘pirrolo-like’ non basico, mentre l’adenina (una base del DNA/RNA) contiene tutti e tre i tipi.

Gli elettroni di coppia solitaria sull’azoto di un nitrile sono contenuti in un orbitale ibrido sp. Il carattere 50% s di un orbitale ibrido sp significa che gli elettroni sono vicini al nucleo e quindi non significativamente basici.
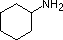
Un ripasso dei concetti base di acido-base dovrebbe essere utile alla seguente discussione. Come l’ammoniaca, la maggior parte delle ammine sono basi di Brønsted e Lewis, ma la loro forza di base può essere modificata enormemente dai sostituenti. È comune confrontare quantitativamente le basi usando le pKa dei loro acidi coniugati piuttosto che le loro pKb. Poiché pKa + pKb = 14, più alto è il pKa più forte è la base, in contrasto con la solita relazione inversa del pKa con l’acidità. La maggior parte delle ammine alchiliche semplici hanno pKa nell’intervallo da 9,5 a 11,0, e le loro soluzioni in acqua sono basiche (hanno un pH da 11 a 12, a seconda della concentrazione). I primi quattro composti nella tabella seguente, compresa l’ammoniaca, rientrano in questa categoria.
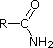
Gli ultimi cinque composti (celle colorate) sono basi significativamente più deboli come conseguenza di tre fattori. Il primo di questi è l’ibridazione dell’azoto. Nella piridina l’azoto è ibridato sp2, e nei nitrili (ultima voce) un azoto ibrido sp fa parte del triplo legame. In ognuno di questi composti (ombreggiati in rosso) la coppia di elettroni non legante è localizzata sull’atomo di azoto, ma l’aumento del carattere s lo porta più vicino al nucleo di azoto, riducendo la sua tendenza a legarsi a un protone.
|
Composto |
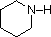 |
 |
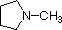 |
NH3 |  |
 |
 |
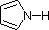 |
 |
CH3C≡N |
|---|---|---|---|---|---|---|---|---|---|---|
| pKa | 11.0 | 10.7 | 10.7 | 9.3 | 5.2 | 4.6 | 1.0 | 0.0 | -1.0 | -10. |
Basicità delle ammine comuni (pKa degli ioni ammonio coniugati)
Infine, la basicità molto bassa del pirrolo (ombreggiato in blu) riflette l’eccezionale delocalizzazione della coppia di elettroni dell’azoto associata alla sua incorporazione in un anello aromatico. Anche l’indolo (pKa = -2) e l’imidazolo (pKa = 7,0), vedi sopra, hanno anelli aromatici eterociclici simili. L’imidazolo è oltre un milione di volte più basico del pirrolo perché l’azoto sp2 che fa parte di un doppio legame è strutturalmente simile alla piridina, e ha una basicità comparabile.
Anche se la delocalizzazione della risonanza generalmente riduce la basicità delle ammine, un esempio drammatico dell’effetto inverso si trova nel composto guanidina (pKa = 13,6). Qui, come mostrato di seguito, la stabilizzazione di risonanza della base è piccola, a causa della separazione di carica, mentre l’acido coniugato è fortemente stabilizzato dalla delocalizzazione di carica. Di conseguenza, le soluzioni acquose di guanidina sono basiche quasi quanto le soluzioni di idrossido di sodio.
