Agosto 20, 2018
Cannula nasale ad alto flusso (HFNC) – Parte 1: Come funziona
 L’uso della cannula nasale ad alto flusso riscaldata e umidificata (HFNC) è diventato sempre più popolare nel trattamento dei pazienti con insufficienza respiratoria acuta in tutti i gruppi di età. Ho iniziato a usarla come collega di terapia intensiva pediatrica, ma avevo poca conoscenza di come funzionasse effettivamente. Qualche anno dopo averla usata con successo nei bambini, soprattutto con gravi bronchioliti, ho notato che abbiamo iniziato a usarla anche nell’unità di terapia intensiva degli adulti. Sembra che negli ultimi anni siano usciti molti studi che rivedono i meccanismi d’azione e il suo uso in una varietà di condizioni. In questa parte riassumeremo come funziona e per la parte 2 discuteremo le principali indicazioni per il suo utilizzo in pazienti adulti e pediatrici.
L’uso della cannula nasale ad alto flusso riscaldata e umidificata (HFNC) è diventato sempre più popolare nel trattamento dei pazienti con insufficienza respiratoria acuta in tutti i gruppi di età. Ho iniziato a usarla come collega di terapia intensiva pediatrica, ma avevo poca conoscenza di come funzionasse effettivamente. Qualche anno dopo averla usata con successo nei bambini, soprattutto con gravi bronchioliti, ho notato che abbiamo iniziato a usarla anche nell’unità di terapia intensiva degli adulti. Sembra che negli ultimi anni siano usciti molti studi che rivedono i meccanismi d’azione e il suo uso in una varietà di condizioni. In questa parte riassumeremo come funziona e per la parte 2 discuteremo le principali indicazioni per il suo utilizzo in pazienti adulti e pediatrici.
Cannula nasale ad alto flusso caldo e umidificato o, come molti la chiamano, Hi Flow Nasal Cannula (HFNC), non è solo una cannula nasale standard portata a velocità di flusso molto elevate. Prende effettivamente il gas e può riscaldarlo a 37 o C con un’umidità relativa del 100% e può fornire lo 0,21 – 1,00% di fi02 a portate fino a 60 litri/min. Il tasso di flusso e fi02 può essere titolato indipendentemente in base al flusso del paziente e ai requisiti fi02.

Ci sono 2 aziende principali che producono questi dispositivi: Vapotherm che ha un dispositivo che può fornire portate fino a 50 litri/min e Fisher Paykall che offre sia l’Optiflow che i dispositivi AIRVO 2 che possono entrambi fornire portate fino a 60 litri/min.
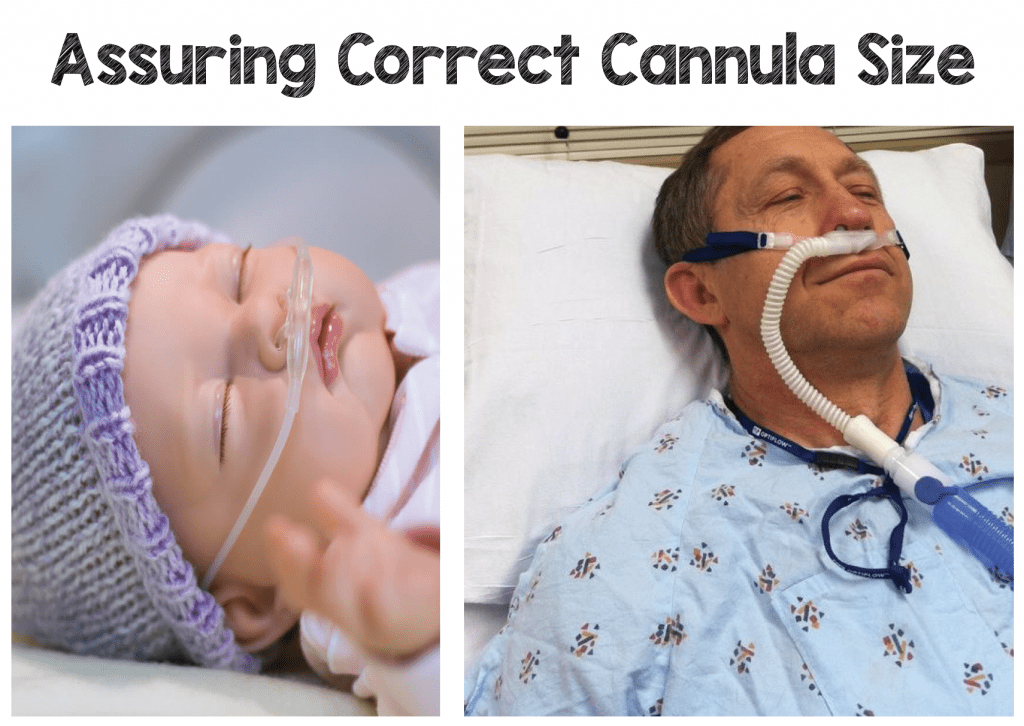
 Ogni azienda offre cannule di piccole dimensioni per neonati prematuri e bambini di varie età fino alle cannule per adulti. Ogni cannula dovrebbe adattarsi comodamente alle narici del paziente e impedisce il trascinamento dell’aria ambiente intorno alla cannula, che può verificarsi con le cannule nasali standard. Ogni produttore avrà anche una portata massima per ogni dimensione di cannula corrispondente alla dimensione e all’età del paziente.
Ogni azienda offre cannule di piccole dimensioni per neonati prematuri e bambini di varie età fino alle cannule per adulti. Ogni cannula dovrebbe adattarsi comodamente alle narici del paziente e impedisce il trascinamento dell’aria ambiente intorno alla cannula, che può verificarsi con le cannule nasali standard. Ogni produttore avrà anche una portata massima per ogni dimensione di cannula corrispondente alla dimensione e all’età del paziente.
Come funziona:
Riscaldato & Umidificato:
L’ossigeno riscaldato e umidificato ha una serie di vantaggi rispetto all’ossigenoterapia standard. L’ossigenoterapia standard erogata attraverso una cannula nasale o un altro dispositivo come un non-rebreather, è fredda (non riscaldata) e secca (non umidificata). Questo può portare a un’infiammazione delle vie aeree, che può aumentare la resistenza delle vie aeree e compromettere la funzione mucociliare, portando eventualmente a una diminuzione della clearance delle secrezioni (1). Inoltre, una quantità significativa di calorie può anche essere spesa negli individui per riscaldare e umidificare il gas durante la respirazione normale (2).
L’HFNC può riscaldare (a 37oC) e umidificare il gas, il che può diminuire l’infiammazione delle vie aeree, mantenere la funzione mucociliare, migliorare la clearance della mucosa e ridurre il dispendio calorico nell’insufficienza respiratoria acuta (1-2).
Un vantaggio ovvio, ma degno di nota, è che l’alto flusso può dare un flusso di gas molto elevato. Questo è importante perché i pazienti nell’insufficienza respiratoria acuta possono essere estremamente tachipnoici, e quindi i loro flussi inspiratori di picco, che normalmente possono essere 30L/min – 60L/min, possono arrivare fino a 120 L/min (3). Quindi, se mettete il vostro paziente tachipnoico con un tasso PIF di 120L/min e un volume minuto >20L/min su una maschera NRB da 15L/min, potreste non aiutarlo tanto quanto pensate. Affronterò questo punto un po’ più avanti in questa recensione quando discuteremo il concetto di diluizione dell’ossigeno.
Capacità funzionale residua:
Potreste aver cercato il punto che dice che Hi Flow fornisce PEEP e non l’avete trovato? C’è stato qualche dibattito su quanta PEEP un dispositivo ad alto flusso possa veramente fornire. È stato dimostrato che l’HFNC fornisce fino a 1 mm di Hg di PEEP per ogni 10L/min di flusso erogato con la respirazione a bocca chiusa. (4-5)
Non sono sicuro di credere che questo sia vero per tutti i pazienti, e questo perché ci sono molti fattori che possono influenzare quanta PEEP può essere effettivamente erogata a un paziente. Fattori come le dimensioni del paziente (obeso, adulto, bambino), la portata in litri erogata (L/Min) e la respirazione a bocca aperta rispetto a quella a bocca chiusa (la pressione può fuoriuscire quando la bocca del paziente è aperta) possono influenzare la quantità di PEEP erogata (4)
Il dibattito può continuare, ma sembra che l’HFNC possa aumentare il volume residuo funzionale (FRC) del paziente o il volume polmonare alla fine dell’espirazione, qualcosa che la PEEP solitamente migliora. Uno studio di Riera J. et al ha dimostrato che l’uso di HFNC ha aumentato l’impedenza polmonare di fine espirazione (EELI), il che implica un miglioramento del FRC (6). Hanno usato la tomografia a impedenza elettrica (EIT), un metodo di imaging non invasivo e in tempo reale che fornisce un’immagine di ventilazione trasversale del polmone per dimostrare un aumento dell’Impendenza polmonare di fine espirazione (EELI).
Sembra anche che l’uso di HFNC possa diminuire il precarico aumentando la pressione intratoracica, di nuovo un’altra caratteristica comunemente attribuita alla PEEP. Roca et al hanno dimostrato in uno studio sequenziale a intervalli su 10 pazienti (insufficienza cardiaca NYHA III ma non in una esacerbazione acuta dell’CHF) che l’uso dell’Hi Flow ha causato il collasso inspiratorio della vena cava inferiore (IVC) rispetto alla linea di base dei pazienti misurata tramite ecocardiogramma (7).
Hi flow sembra causare il reclutamento alveolare e l’aumento della FRC, nonché l’aumento della pressione intratoracica probabilmente come risultato della PEEP aggiunta, tuttavia non è certo se forse un altro meccanismo può essere responsabile di questi risultati.
Leggero:
I pazienti spesso preferiscono l’uso della HFNC a quello della ventilazione non invasiva a pressione positiva (CPAP o BPAP) perché la maschera aderente può essere scomoda per alcuni pazienti. Possono anche preferirla alla NC standard perché i gas riscaldati e umidificati non seccano la loro mucosa come l’ossigenoterapia standard (5). Questo può portare a una maggiore conformità con l’HFNC e forse a un miglioramento dell’ossigenazione del paziente e del lavoro di respirazione.
Diluizione dell’O2:
Mi è stato insegnato durante la mia rotazione in terapia intensiva come tirocinante che ogni 1 litro di cannula nasale fornirà ~4% fiO2 oltre l’aria ambiente (21%). Quindi 1 litro/min attraverso la NC dovrebbe fornire ~ 25% fi02, e 2 litri/min dovrebbero fornire 29% fiO2 (vedi tabella 1 sotto). Ho creduto per anni che questa “regola 1:4” fosse vera, ma vediamo se ha senso per un paziente in distress respiratorio acuto

Immaginate un uomo di 70 kg che respira 30-40 bpm con volumi correnti normali (~500 mL’s) e sviluppa una certa ipossiemia. La ventilazione minuta di questo paziente sarebbe tra i 15-20 litri/minuto. Si decide di mettere questo paziente su 6 litri/min NC che dovrebbe teoricamente fornire una fiO2 ~ 45% (6L x 4% = 24 + aria ambiente (21%) = 45%) se la “regola 1:4” è vera. Se questo paziente respira 15-20L attraverso la bocca e attraverso le narici (intorno alla cannula nasale) al 21%, allora credete che questo paziente otterrà effettivamente il 45% di fiO2 nella trachea?
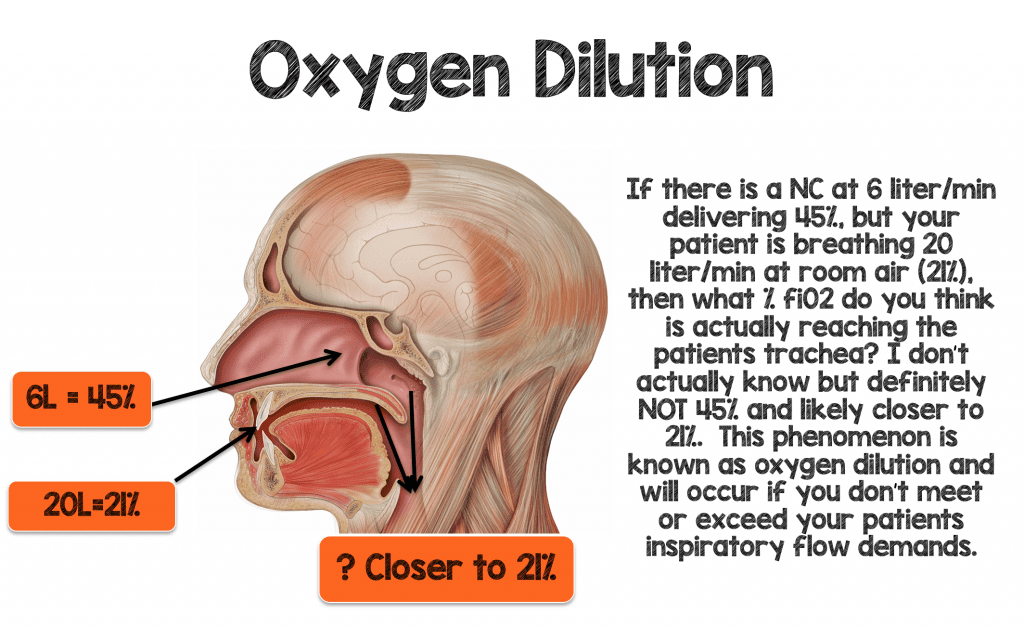
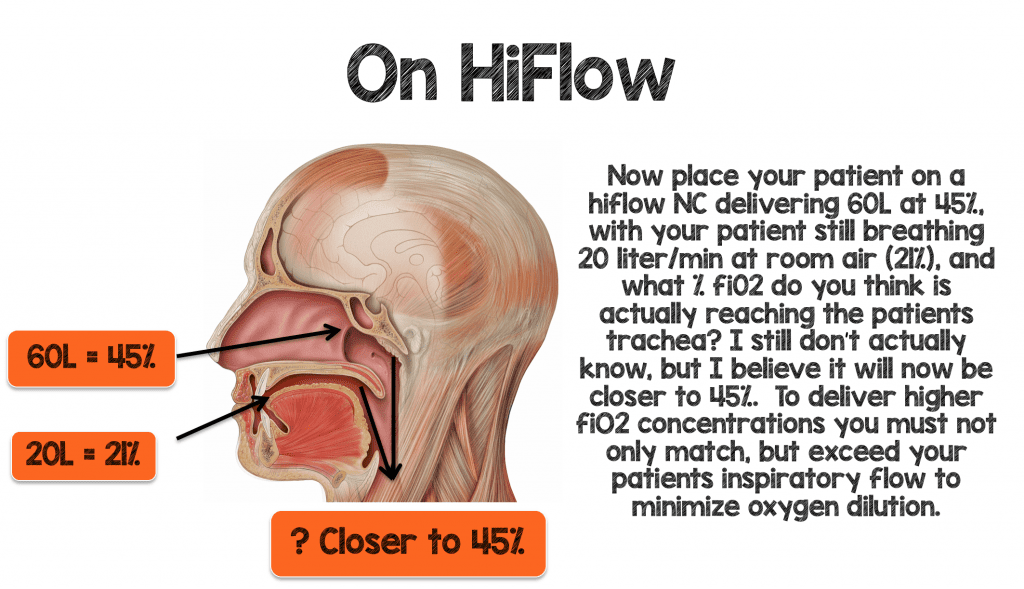
Per fornire quantità più elevate di fiO2 in modo efficace al vostro paziente dovete non solo eguagliare, ma superare le richieste ventilatorie e inspiratorie minute del paziente per minimizzare la diluizione dell’ossigeno.
Respirare lo spazio morto:
Normalmente respiriamo un terzo del nostro volume corrente precedentemente espirato e invece di respirare il 21% (aria ambiente) e quantità trascurabili di anidride carbonica; possiamo ri-respirare più del 15-16% di ossigeno e il 5-6% di anidride carbonica. Questo perché il respiro precedentemente espirato (a basso contenuto di ossigeno e con un po’ di anidride carbonica) non è completamente espirato e rimane nelle vie aeree superiori. Quando il paziente prende il prossimo respiro dal gas atmosferico, non tutto quel gas entra negli alveoli. Infatti è una miscela del nuovo gas atmosferico (21% 02, CO2 trascurabile) e il loro gas precedentemente espirato (<21% di ossigeno e un po’ di CO2). Nei pazienti con un’insufficienza respiratoria acuta, la percentuale di gas che ri-respiriamo diventa più grande, e di conseguenza, possiamo ri-respirare quantità maggiori di anidride carbonica, poiché attingiamo i nostri respiri da un serbatoio misto dalle nostre vie aeree superiori. Un altro modo per dire questo è che il nostro spazio morto aumenta con l’insufficienza respiratoria acuta.
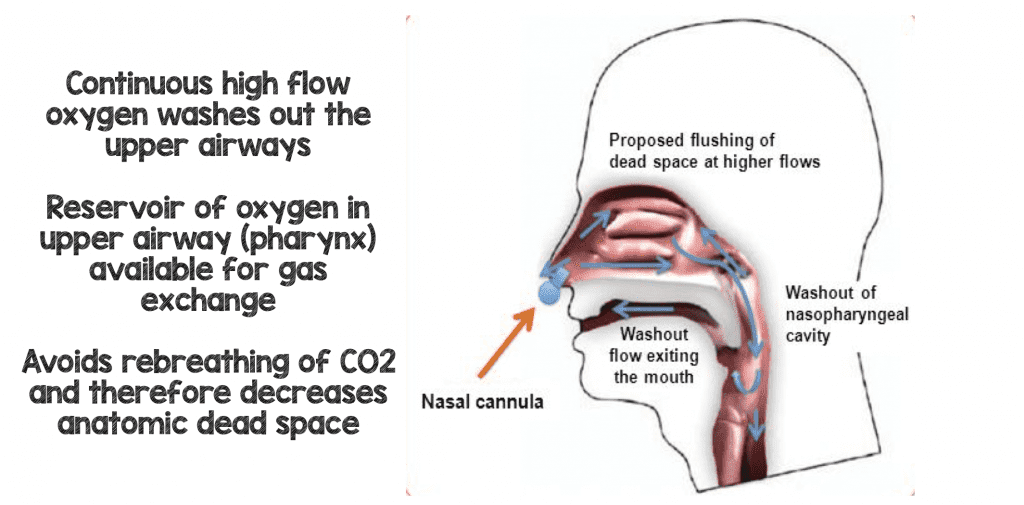
Uno dei maggiori vantaggi dell’HFNC (alcuni sostengono che sia in realtà il principale vantaggio) è che dà un flusso continuo di gas fresco ad alta velocità di flusso che sostituisce o lava lo spazio morto faringeo del paziente (il vecchio gas a basso contenuto di ossigeno e alto contenuto di CO2). Ogni respiro che il paziente ora ri-respira sarà lavato via dall’anidride carbonica e sostituito con gas ricco di ossigeno migliorando l’efficienza respiratoria (8).

Guest Post Scritto da

Thomas Lettich, D.O.
Internal Medicine/Pediatrics Resident Physician
Geisinger Medical Center
Danville, Pennsylvania
- Chidekel, A et al. The Effects of Gas Humidification with High-Flow Nasal Cannula on Cultured Human Airway Epithelial Cells. Medicina polmonare 2012. PMID: 22988501
- Dysart, K et al. Ricerca nella terapia ad alto flusso: Meccanismi di azione. Medicina Respiratoria 2009. PMID: 19467849
- Katz, JA et al. Lavoro inspiratorio con e senza pressione positiva continua delle vie aeree in pazienti con insufficienza respiratoria acuta. Anestesiologia 1985. PMID: 3904528
- Parke R et al. Pressioni fornite da ossigeno nasale ad alto flusso durante tutte le fasi del ciclo respiratorio. Cura respiratoria 2013. PMID: 23513246
- Frat JP et al. Ossigenoterapia nasale ad alto flusso e ventilazione non invasiva nella gestione dell’insufficienza respiratoria acuta ipossiemica. Annali di medicina traslazionale 2017). PMID: 28828372
- Riera J et al. Effetto della cannula nasale ad alto flusso e la posizione del corpo sul volume polmonare end-espiratorio: Uno studio di coorte utilizzando la tomografia ad impedenza elettrica. Medicina Respiratoria 2013. PMID: 23050520
- Roca O et al. I pazienti con New York Heart Association Classe III insufficienza cardiaca può beneficiare di alto flusso cannula nasale terapia di supporto: cannula nasale ad alto flusso in insufficienza cardiaca. Giornale Crit Care 2013. PMID: 23602035
- Möller W et al. Nasal High Flow Clears Anatomical Dead Space in modelli di vie aeree superiori. Giornale di fisiologia applicata 2015). PMID: 25882385
Sostenete lo spettacolo pagando & richiedendo 0.5hrs di CME/CEH cliccando sul logo qui sotto

Post Peer Reviewed By: Salim R. Rezaie, MD (Twitter: @srrezaie)
- Bio
- Latest Posts
Frank Lodeserto MD
Latest posts by Frank Lodeserto MD (see all)
- The RELAx Trial: Qual è la PEEP ottimale nei pazienti senza ARDS? – 1 febbraio 2021
- COVID-19 Update: Il vaccino COVID-19 Pfizer – 15 dicembre 2020
- Linfoistiocitosi emofagocitica (HLH): A Zebra Diagnosis We Should All Know – July 30, 2020