Il nitrato di magnesio rappresentato dalla formula chimica Mg(NO3)2 o MgN2O6 che porta il nome IUPAC dinitrato di magnesio è una polvere bianca cristallina igroscopica che è solubile in acqua e alcol. È un sale di magnesio e contiene legami chimici che sono di natura ionica.

Nitrato di magnesio
Identificazione del nitrato di magnesio |
|
| Numero CAS | 10377-60-3 |
| PubChem CID | 25212 |
| ChemSpider ID | 23415 |
| Numero CE | 233-826-7 |
Composizione e sintesi
Il nitrato di magnesio può essere preparato combinando solfato di magnesio con nitrato di calcio.
MgSO4 + Ca(NO3)2 = Mg(NO3)2 + CaSO4
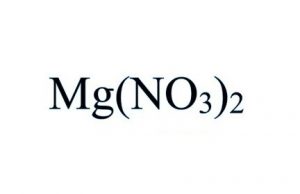
Formula del nitrato di magnesio
Proprietà e caratteristiche del Nitrato di Magnesio
Proprietà generali Proprietà |
||
| Massa molare/peso molecolare | 148.313 g/mol | |
Proprietà fisiche |
||
| Colore/aspetto | Cristalli bianchi | |
| Punto di fusione/punto di congelamento | 89°C, 192.2°F | |
| Punto di ebollizione | 330°C, 626°F | |
| Densità | 1.46 g cm-3 | |
| Stato della materia a temperatura ambiente (fase normale) | Solido | |
Proprietà chimiche Proprietà |
||
| Solubilità in acqua | 42 g/100 ml (a 20oC) | |
| pH | 5-7 (acido) | |
Proprietà atomiche |
||
| Cristallo struttura | Cubico | |
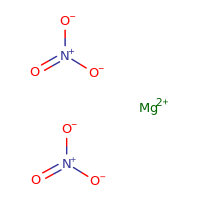
Struttura del nitrato di magnesio
Reazioni prominenti del Mg(NO3)2
Una reazione chimica tra nitrato di magnesio e carbonato di sodio produce carbonato di magnesio e nitrato di sodio.
Mg(NO3)2 + Na2CO3 = MgCO3 + 2NaNO3
Il nitrato di magnesio si decompone in acqua formando idrossido di magnesio, ammoniaca e ossigeno.
Mg(NO3)2 + 4H2O = Mg(OH)2 + 2NH3 + 4O2
Al riscaldamento il Mg(NO3)2 si decompone in ossido di magnesio, biossido di azoto e ossigeno
2Mg(NO3)2 = 2MgO + 4NO2 + O2
Ragisce con l’idrossido di sodio per dare idrossido di magnesio e nitrato di sodio.
Mg(NO3)2 + 2NaOH = Mg(OH)2 + 2NaNO3
Usi del nitrato di magnesio
- Come fonte sicura di ioni nitrati.
- Aiuta nella prillatura e nel rivestimento per la produzione di nitrato di ammonio ed è un ingrediente di cosmetici e shampoo.
È pericoloso
Essendo un forte ossidante, può causare un pericolo di incendio. Può anche causare un pericolo di esplosione se messo in contatto con sostanze organiche. Il contatto con gli occhi, la pelle e l’inalazione devono essere evitati in quanto provoca irritazione, tosse e mancanza di respiro. L’ingestione in grandi quantità provoca dolore addominale, vertigini, diarrea sanguinolenta, vomito, convulsioni, debolezza e collasso.
- Nitrato di magnesio – Pubchem.ncbi.nlm.nih.gov
- Nitrato di magnesio – Chemspider.com
- Nitrato di magnesio – Americanelements.com
- Nitrato di magnesio – Sciencemadness.org
- Nitrato di magnesio Hexahydrate – Sigmaaldrich.com
- Nitrato di magnesio – Chemicalbook.com
- Questione: Nitrato di magnesio e carbonato di sodio Mg(NO_3)_2 + Na_2 – Chegg.com
- Come si determina l’equazione equilibrata del nitrato di magnesio più acqua? – Quora.com
- La decomposizione termica del nitrato di magnesio – Chemiday.com
- Questione: Idrossido di sodio reagisce con nitrato di magnesio per formare idrossido di magnesio – Chegg.com