Tipi di ammineModifica
Le ammine possono essere primarie, secondarie o terziarie, a seconda del numero di gruppi contenenti carbonio che sono attaccati a loro. Se c’è un solo gruppo contenente carbonio (come nella molecola CH3NH2), l’ammina è considerata primaria. Due gruppi contenenti carbonio rendono un’ammina secondaria, e tre gruppi la rendono terziaria. Utilizzando la coppia di elettroni solitari dell’azoto, a volte è energeticamente favorito l’uso dell’azoto come nucleofilo e quindi legare un quarto gruppo contenente carbonio all’ammina. In questo caso, potrebbe essere chiamato uno ione ammonio quaternario.
Amina primaria:
 |
Amina secondaria:
 |
Amina terziaria:
 |
Un composto organico con più gruppi amminici è chiamato diamina, triamina, tetraamina e così via, in base al numero di gruppi amminici (chiamati anche gruppi amminici) attaccati alla molecola. La formula chimica per la diammina metilenica (chiamata anche diaminometano), per esempio, sarebbe la seguente: H2N-CH2-NH2
Ammine aromaticheModifica
Le ammine aromatiche hanno l’atomo di azoto collegato direttamente ad una struttura ad anello aromatico. A causa delle sue proprietà di sottrazione di elettroni, l’anello aromatico diminuisce notevolmente la basicità dell’ammina – e questo effetto può essere rafforzato o compensato a seconda dei sostituenti presenti sull’anello e sull’azoto. La presenza della coppia di elettroni solitari dell’azoto ha l’effetto opposto sull’anello aromatico stesso; poiché l’atomo di azoto può “prestare” densità di elettroni all’anello, l’anello stesso diventa molto più reattivo ad altri tipi di chimica.
Convenzioni di denominazioneModifica
Per le ammine primarie, dove l’ammina non è il gruppo caratteristico principale, si usa il prefisso “amino-“. Per esempio: Acido 4-aminobenzoico dove l’acido carbossilico è la caratteristica principale. Altrimenti, si usa il suffisso “-ammina” con il nome dell’ibrido padre o il nome del sostituente del gruppo R. Esempio: etanamina o etilammina. In alternativa, il suffisso “-azane” può essere aggiunto al nome del sostituente del gruppo R: Esempio: propilazane.
Per le ammine secondarie, terziarie e quarte, la convenzione di denominazione è un po’ diversa, ma i suffissi sono gli stessi. Per le ammine simmetriche, si usa il prefisso “di” o “tri” a seconda che ci siano 2 o 3 sostituenti. Per esempio, la dipropilammina è un’ammina secondaria, e la trifenilammina è un’ammina terziaria. Per le ammine asimmetriche, la catena madre riceve il suffisso “-amine”. Questo nome viene poi prefissato con “N-” (che indica il legame azotato) e il nome del gruppo di sostituzione, per ogni sostituente, usando l’ordine alfabetico per le ammidi terziarie. Per esempio, N-ethyl-N-methyl-propylamine, non N-methyl-N-ethyl-propylamine.
Per riassumere:
- come prefisso: “amino-“
- come suffisso: “-amine”
- il prefisso “N-” indica la sostituzione sull’atomo di azoto (nel caso delle ammine secondarie, terziarie e quaternarie)
Nomi sistematici per alcune ammine comuni:
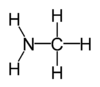
metilammina
- Ammine primarie: etanammina o etilammina.
- Ammine secondarie: dimetilammina
- Ammine terziarie: trimetilammina
Proprietà fisicheModifica
Come si può facilmente intuire, l’inclusione di un eteroatomo come l’azoto in molecole altrimenti esclusivamente di carbonio e idrogeno ha un certo effetto sulle proprietà delle ammine rispetto agli alcani.
Proprietà generaliModifica
Il legame idrogeno influenza significativamente le proprietà delle ammine primarie e secondarie così come i derivati protonati di tutte le ammine. Così il punto di ebollizione delle ammine è più alto di quello delle corrispondenti fosfine (composti contenenti fosforo), ma generalmente più basso dei corrispondenti alcoli. Gli alcoli, o alcanoli, assomigliano alle ammine ma presentano un gruppo -OH al posto di NR2. Poiché l’ossigeno è più elettronegativo dell’azoto, RO-H è tipicamente più acido del composto R2N-H correlato.
Metil, dimetil, trimetil, ed etil ammine sono gas in condizioni standard. Le ammine alchiliche più comuni sono liquide, e le ammine ad alto peso molecolare sono, abbastanza naturalmente, solide a temperature standard. Inoltre, le ammine gassose possiedono un caratteristico odore di ammoniaca, mentre le ammine liquide hanno un caratteristico odore di “pesce”.
La maggior parte delle ammine alifatiche mostrano una certa solubilità in acqua, che riflette la loro capacità di formare legami idrogeno. La solubilità diminuisce in modo relativamente proporzionale con l’aumento del numero di atomi di carbonio nella molecola – specialmente quando il numero di atomi di carbonio è maggiore di sei. Le ammine alifatiche mostrano anche una significativa solubilità nei solventi organici, specialmente nei solventi organici polari. Le ammine primarie reagiscono facilmente con i composti chetonici (come l’acetone), tuttavia, e la maggior parte delle ammine sono incompatibili con il cloroformio e anche con il tetracloruro di carbonio come soluzioni solventi.
Le ammine aromatiche hanno i loro elettroni di coppia solitaria coniugati (“condivisi”) nell’anello benzenico, quindi la loro tendenza a impegnarsi nel legame a idrogeno è in qualche modo diminuita. I punti di ebollizione di queste molecole sono quindi di solito un po’ più alti di altre ammine più piccole, a causa delle loro dimensioni tipicamente più grandi. Spesso hanno anche una solubilità relativamente ridotta in acqua, anche se mantengono la loro solubilità in altri solventi organici.
Le ammine aromaticamente coniugate sono spesso abbastanza tossiche e hanno il potenziale per essere facilmente assorbite attraverso la pelle, quindi dovrebbero sempre essere trattate come “pericolose”.
ChiralityEdit
Le ammine terziarie del tipo NHRR’ e NRR’R” non sono chirali: sebbene l’atomo di azoto porti quattro distinti sostituenti contando la coppia solitaria, la coppia solitaria di elettroni può “girare” attraverso l’atomo di azoto e invertire le altre molecole. La barriera energetica per una tale inversione di Walden dello stereocentro con una coppia solitaria di elettroni è relativamente bassa, ad esempio ~7 kcal/mol per una trialchilammina, quindi è difficile ottenere prodotti attendibilmente chirali usando ammine terziarie. A causa di questa bassa barriera, ammine come NHRR’ non possono essere risolte otticamente e NRR’R” può essere risolto solo quando i gruppi R, R’, e R” sono vincolati in strutture cicliche. Le strutture delle ammine quaternarie, per esempio H3C-N+-RR’R”, sono chirali e sono facilmente risolte otticamente.
Proprietà come basiModifica
Come l’ammoniaca, le ammine agiscono come basi e sono ragionevolmente forti (vedi la tabella fornita per alcuni esempi di valori Ka di acidi coniugati). La basicità delle ammine varia a seconda della molecola, e dipende in gran parte da:
- La disponibilità della coppia solitaria di elettroni dell’azoto
- Le proprietà elettroniche dei gruppi sostitutivi attaccati (es, i gruppi alchilici aumentano la basicità, i gruppi arilici la diminuiscono, ecc.)
- Il grado di solvatazione dell’ammina protonata, che dipende principalmente dal solvente usato nella reazione
L’atomo di azoto di una tipica ammina presenta una coppia di elettroni solitari che può legare uno ione idrogeno (H+) per formare uno ione ammonio — R3NH+. La solubilità in acqua delle ammine semplici è in gran parte dovuta alla capacità di legame a idrogeno che può verificarsi tra i protoni sulle molecole d’acqua e queste coppie solitarie di elettroni.
- Effetto induttivo dei gruppi alchilici
| Ioni del composto | Kb |
|---|---|
| ammonia NH3 | 1.8-10-5 M |
| metilammina CH3NH2 | 4.4-10-4 M |
| propilammina CH3CH2CH2NH2 | 4.7-10-4 M |
| 2-propilammina (CH3)2CHNH2 | 5.3-10-4 M |
| dietilammina (CH3)2NH2 | 9.6-10-4 M |
L’effetto +I dei gruppi alchilici aumenta l’energia della coppia solitaria di elettroni, aumentando così la basicità.
- Effetto mesomerico dei sistemi aromatici
| Ioni del composto | Kb |
|---|---|
| ammonia NH3 | 1.8-10-5 M |
| anilina C6H5NH2 | 3.8-10-10 M |
| 4-metilfenilammina 4-CH3C6H4NH2 | 1.2-10-9 M |
+M effetto dell’anello aromatico delocalizza l’elettrone di coppia nell’anello, con conseguente diminuzione della basicità.
Il grado di protonazione delle ammine protonate:
| Ioni del composto | Numero massimo di H- |
|---|---|
| NH4+ | 4 Molto solubile in H2O |
| RNH3+ | 3 |
| R2NH2+ | 2 |
| R3NH+ | 1 Meno solubile in H2O |