Enolizzazione o tautomeria cheto-enolo è un processo di conversione di un chetone o un’aldeide in un enolo corrispondente (in condizioni acide) o in un enolato (in condizioni basiche). Questo processo può avvenire anche negli esteri. Tuttavia, in questo post mi concentrerò su aldeidi e chetoni, in modo da non sovraccaricarlo di dettagli e sfumature.
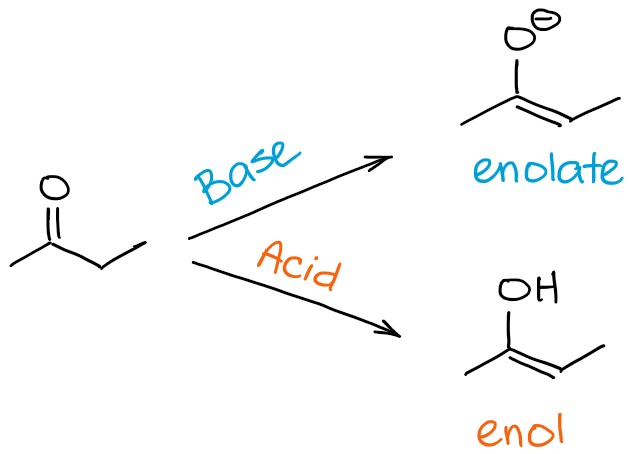
Allora, qual è la differenza tra un’enolizzazione e un processo di tautomerizzazione cheto-enolo? Una risposta breve è nessuna in realtà 😊
Quando ci riferiamo all’enolizzazione, ci riferiamo specificamente al processo che ti porta da un chetone o un’aldeide a un enolo o un enolato. Quando ci riferiamo a un tautomero cheto-enolo, intendiamo l’equilibrio in generale. Così, dicendo che la mia molecola subisce la tautomerizzazione cheto-enolo, posso implicare la direzione del processo, ma generalmente non la indico di per sé. La direzione della tautomerizzazione cheto-enolo, tuttavia, può spesso essere dedotta dal contesto della reazione.
In poche parole, se si dice che la molecola “A” subisce un’enolizzazione, significa che “A” diventa un enolo o un enolato. Se si dice che una molecola “B” subisce la tautomerizzazione cheto-enolo, può significare enolizzazione se B è un carbonile, o può significare un processo inverso se B è già un enolo o un enolato.
Enolizzazione catalizzata da basi
Sebbene l’enolizzazione possa avvenire sia in condizioni basiche che acide, l’enolizzazione catalizzata da basi è un modo più comune di fare questa reazione. Così, penso che sia una buona idea andare oltre l’enolizzazione in condizioni basiche prima.
In condizioni di base, un chetone o un’aldeide agisce come un acido di Brønsted donando un protone da un carbonio α a una base nella soluzione. Questo processo dà un anione enolato risonante stabilizzato:

Siccome in questo equilibrio il nostro carbonile agisce come un acido, deve essere sufficientemente acido per cedere il protone. In alternativa, la base deve essere sufficientemente forte per guidare questo equilibrio verso il prodotto.
Quanto sono acidi gli idrogeni sugli α-carboni?
L’anione enolato è una specie stabilizzata con risonanza, quindi il grado di stabilizzazione della risonanza gioca un ruolo molto significativo nell’acidità dei composti carbonilici. Sappiamo che quanti più contribuenti di risonanza possiamo disegnare per la base coniugata, tanto più è stabile. E più stabile è la base coniugata, più acido è l’acido originale. Così, gli idrogeni tra due legami C=O saranno significativamente più acidi di quelli accanto a un solo C=O.
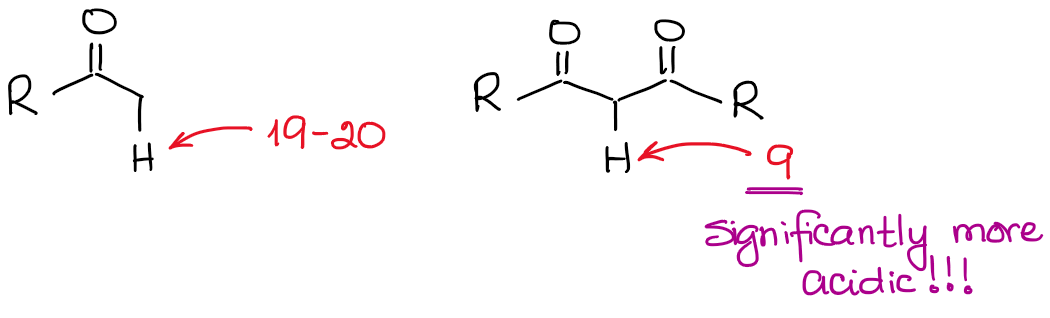
Se confrontiamo le basi coniugate nei due casi, vedremo che il dicarbonile ha una migliore stabilizzazione di risonanza della carica negativa attraverso un sistema coniugato più esteso.
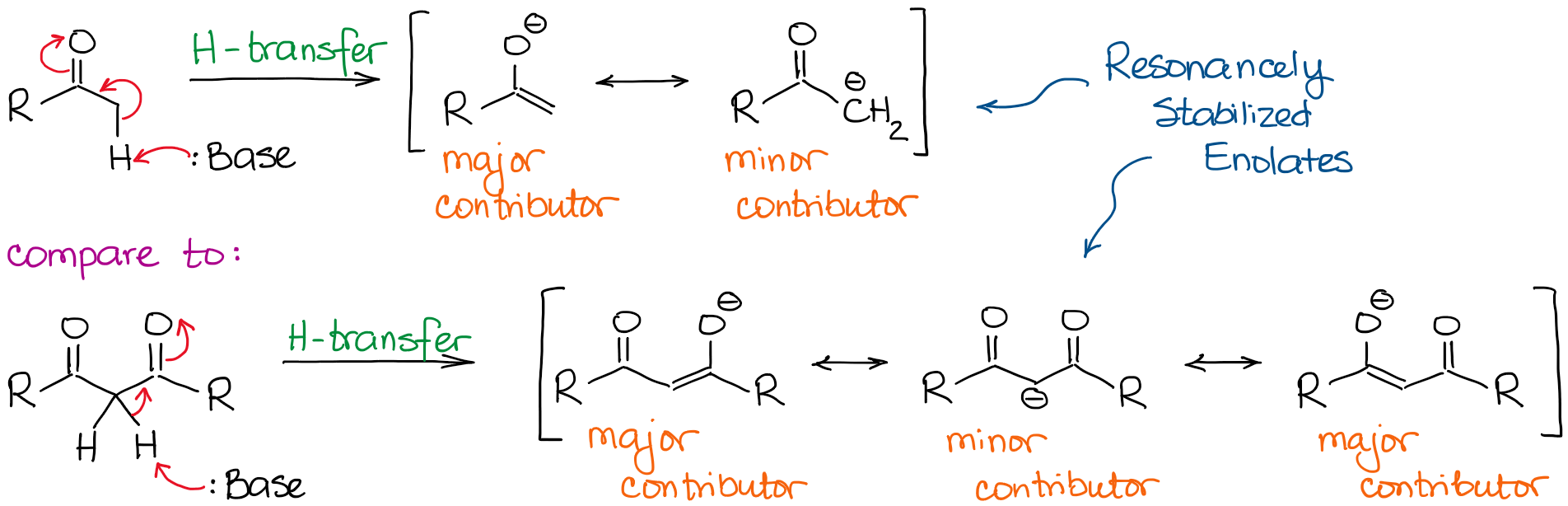
Un ulteriore importante contributore di risonanza nell’anione dicarbonile rende la molecola circa 10000000000 volte più acida! Quindi, la natura di un chetone o di un’aldeide è abbastanza chiara qui: più legami C=O vicino a un idrogeno, più diventa acido.
Effetto di una base sull’equilibrio di enolizzazione
Le basi hanno forze molto diverse. Quindi, la scelta di una base è importante se vuoi guidare il tuo equilibrio al completamento. Guardiamo alcune basi che vediamo tipicamente nelle reazioni di chimica organica:
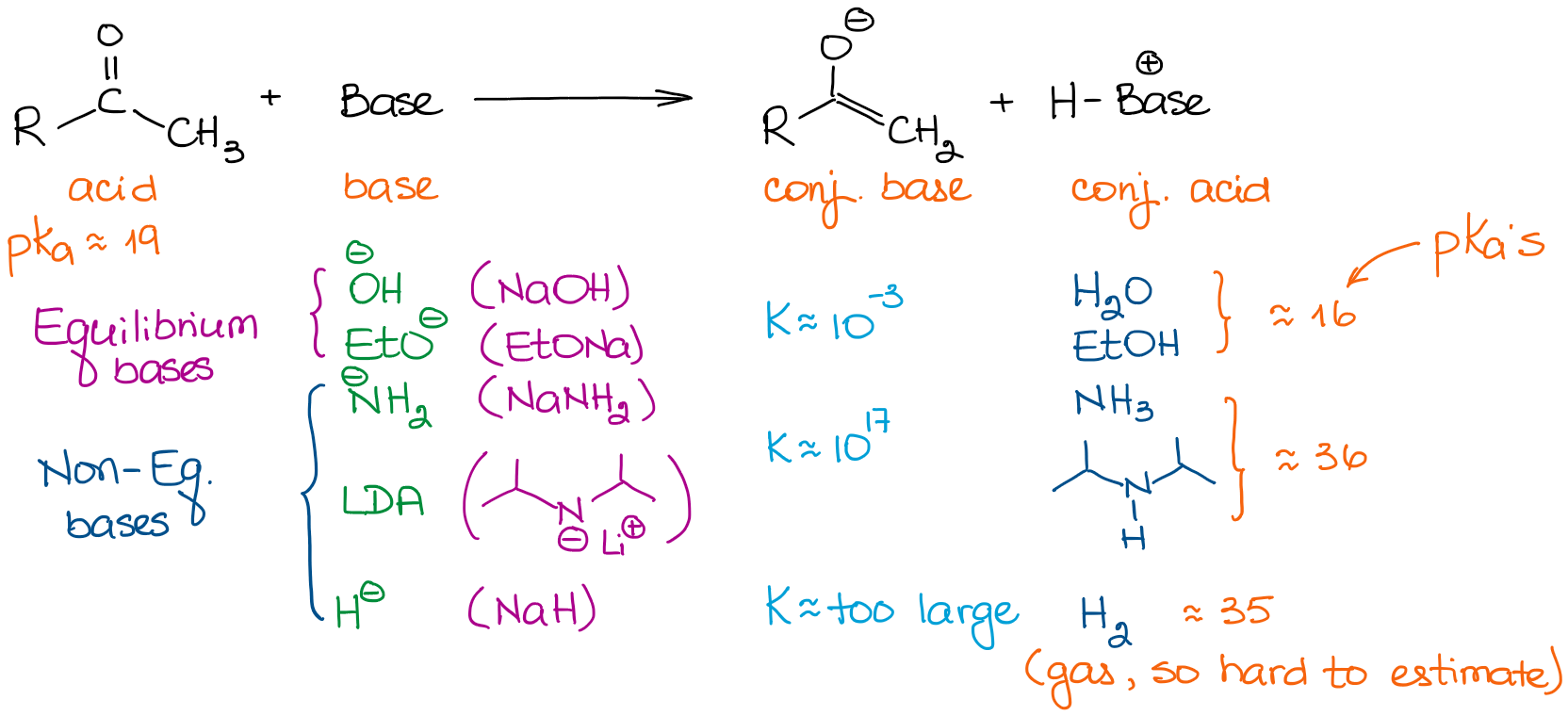
Quando si tratta di aldeidi e chetoni semplici, possiamo classificare tutte le basi in due categorie: basi di equilibrio e basi di non equilibrio. Le basi di equilibrio sono relativamente deboli. Ciò significa che possono guidare l’equilibrio solo in misura molto modesta. Così la concentrazione effettiva di un enolato nella soluzione sarà molto piccola. La reazione sarà anche in un equilibrio costante tra il materiale di partenza e un enolato. Queste basi favoriscono la formazione di enolati più stabili termodinamicamente. Questi enolati sono chiamati enolati termodinamici.
Le basi non in equilibrio, tuttavia, sono molto forti. Questo porta ad una reazione di trasferimento di protoni (acido-base) con costanti di equilibrio molto grandi. Quando abbiamo una costante di equilibrio superiore a 103, l’equilibrio è quasi completamente spostato verso i prodotti. Quindi, un’enolizzazione con una base come la LDA dà praticamente il 100% di enolizzazione. Così, la concentrazione dell’aldeide iniziale o di un chetone è fondamentalmente zero.
Carbonili con un legame C=O vs β-Dicarbonili
Come ho detto sopra, i β-dicarbonili sono significativamente più acidi delle normali aldeidi e chetoni. Guardiamo una costante di equilibrio nei due casi seguenti:
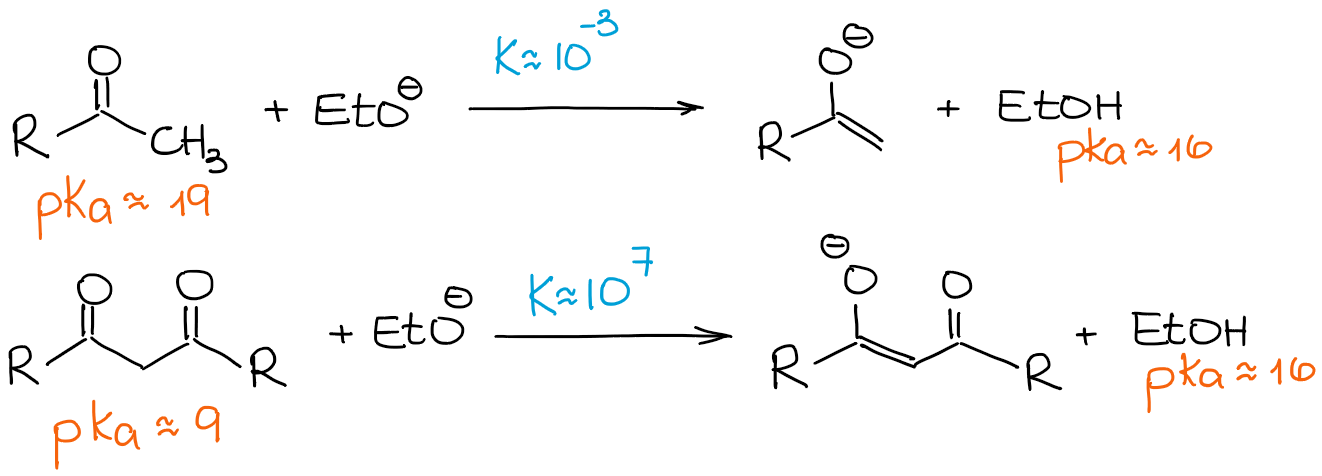
Siccome un β-dicarbonile è molto più acido di un’aldeide normale o di un chetone, anche una base debole spinge l’equilibrio verso i prodotti che danno il 100% di enolizzazione. Quindi, guarderemo qualsiasi reazione di enolizzazione dei β-dicarbonili come un processo 100% enolato e 0% materiale di partenza, indipendentemente da una base.
Perché la scelta di una base è importante?
Alcune reazioni possono essere molto sensibili a cosa c’è nella soluzione e quali sono le concentrazioni dei reagenti. Per esempio, le aldeidi sono elettrofile mentre gli enolati sono nucleofili. Quindi, se sto usando una base debole di non-equilibrio che lascia molto materiale di partenza nella soluzione, potrei iniziare a vedere una reazione indesiderata tra un enolato e un’aldeide iniziale. In generale, vedremo le basi deboli di equilibrio utilizzate solo quando non ci si aspetta una grande competizione tra i possibili prodotti. Se sono possibili più reazioni e nessun singolo prodotto principale domina l’equilibrio, useremo sempre basi forti non di equilibrio.
Basi voluminose o piccole
La dimensione di una base può essere un fattore determinante nel processo di enolizzazione quando più posizioni enolizzabili in una molecola sono in competizione. Guardiamo l’enolizzazione del 2-metilbutanone da parte di due basi forti:
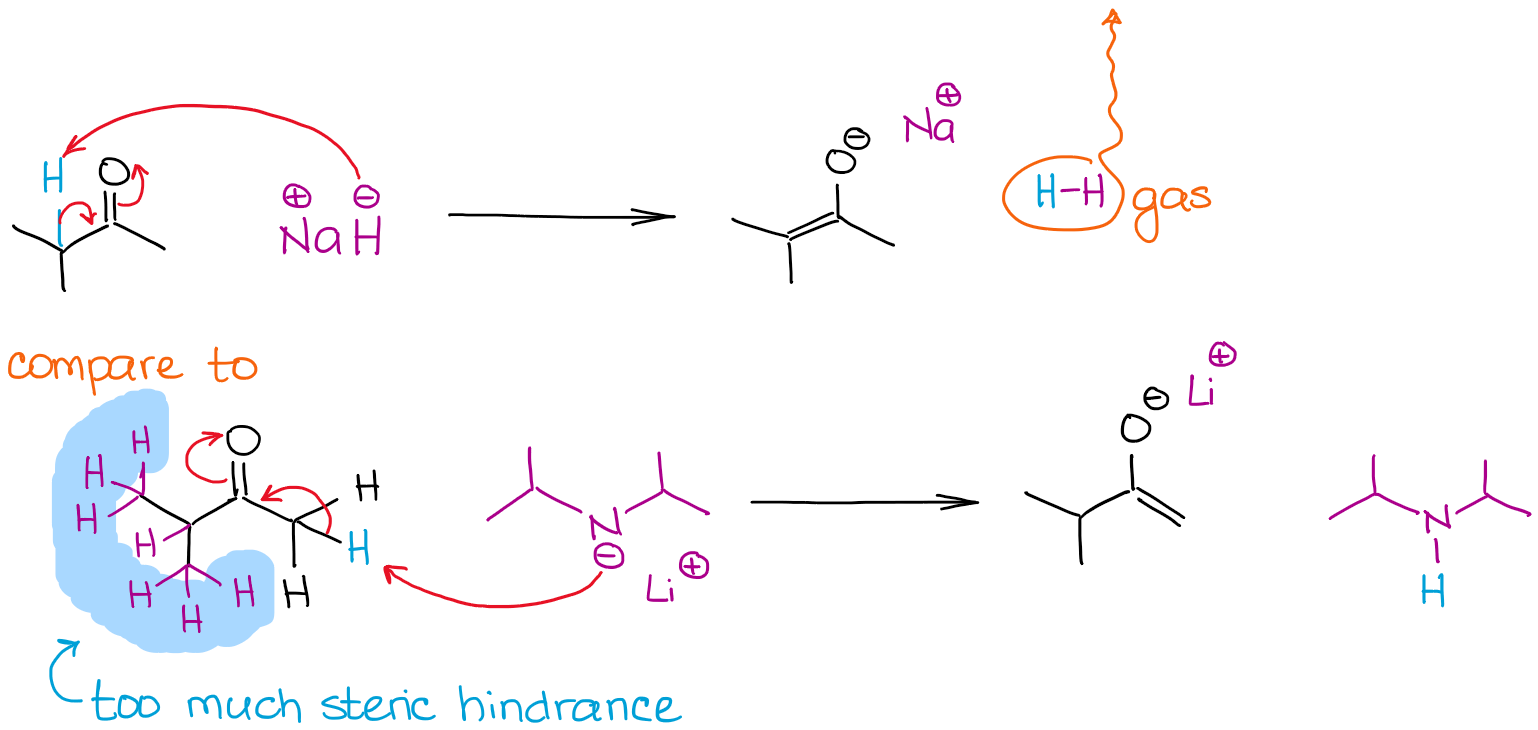
Entrambe le reazioni danno il 100% di enolizzazione grazie all’uso di basi molto forti non in equilibrio. Tuttavia, la reazione con l’idruro di sodio (NaH) dà un enolato termodinamicamente più stabile. A differenza della LDA, l’anione idruro è molto piccolo, quindi può facilmente raggiungere un protone più stericamente ostacolato e dare un enolato termodinamico. L’ADL è molto ingombrante e quindi è molto sensibile a qualsiasi ostacolo sterico. Questo significa che andrà a cercare gli idrogeni enolizzabili meno ostacolati stericamente e più accessibili.
Chiamiamo l’enolato meno stabile termodinamicamente come nella reazione con LDA un enolato cinetico. Questo è anche il punto in cui l’ordine di aggiunta dei reagenti diventa rilevante. Per ottenere un enolato cinetico, si dovrebbe sempre aggiungere un carbonile alla base, e non il contrario! Alcuni istruttori sono pignoli al riguardo, quindi tienilo a mente.
Enolati termodinamici vs cinetici
Ora ho menzionato gli enolati termodinamici e cinetici un paio di volte, quindi penso che potrebbe essere una buona idea esaminarli un po’ più in dettaglio.
Cosa conta esattamente per la stabilità termodinamica di un enolato?
I grandi enolati che contribuiscono alla risonanza hanno una carica negativa sull’atomo di ossigeno e un doppio legame C=C.
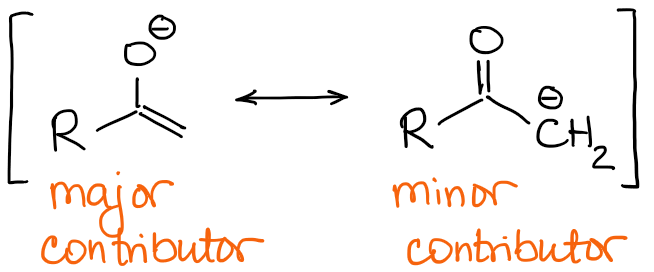
Quindi, la natura del doppio legame sarà la principale differenza tra gli enolati. Se guardiamo l’esempio del 2-metilbutanone di cui sopra, possiamo vedere che i due possibili enolati hanno un doppio legame qualitativamente diverso:

Cercate sempre il numero di sostituenti sul vostro doppio legame. Più sostituenti hai su un doppio legame, più è stabile. Quindi, l’enolato termodinamico avrà sempre il doppio legame più occupato.
Un enolato cinetico è quello che si forma più velocemente. Pensate alla reazione con la LDA. La LDA è una base di non-equilibrio molto forte. Appena strappa il protone, non ha intenzione di restituirlo. È anche una base molto ingombrante e non può afferrare un idrogeno dal centro della molecola. Quindi, cercherà quello che è stericamente più accessibile. Così, una base come la LDA strappa un protone velocemente, da un sito meno ostacolato stericamente, e non lo restituisce o permette l’equilibrio producendo un enolato meno stabile.
Perché è importante aggiungere un carbonile a una base per fare un enolato cinetico?
Se vuoi un enolato cinetico, la tua base deve essere sempre in eccesso. Gli enolati sono essi stessi base! Quindi, se hai un carbonile in eccesso, l’enolato può rapidamente stabilire un equilibrio con esso.
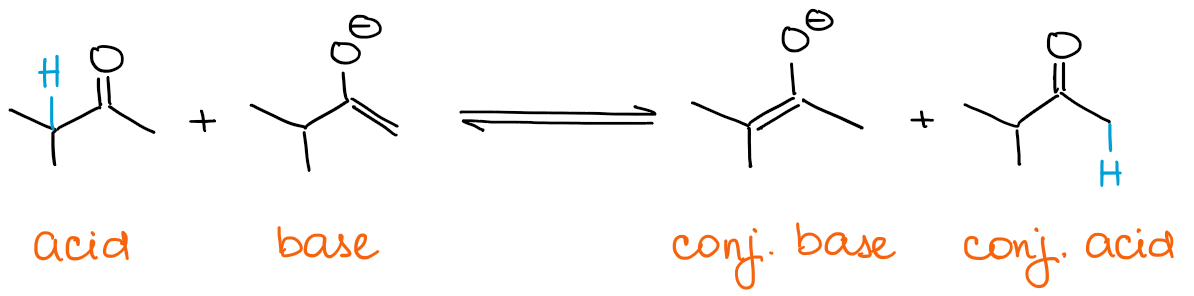
Ogni equilibrio favorirà sempre le specie termodinamicamente più stabili. Questo significa che otterrai sempre un enolato termodinamico se hai un eccesso di un carbonile e non di una base.
Quindi, ricorda che:
Basi deboli e piccole forti = enolato termodinamico
Basi forti voluminose = enolato cinetico
Usando questa semplice regola empirica ti aiuterà a determinare quale enolato avrai o dovrai fare nella tua reazione.
Enolizzazione catalizzata da acido
All’inizio di questo post, ho menzionato che l’enolizzazione è possibile anche in condizioni acide. Poiché le aldeidi e i chetoni non sono particolarmente basici, è necessario utilizzare un acido molto forte per catalizzare questo processo. In genere, si usano acidi solforici o tosilici come catalizzatori.
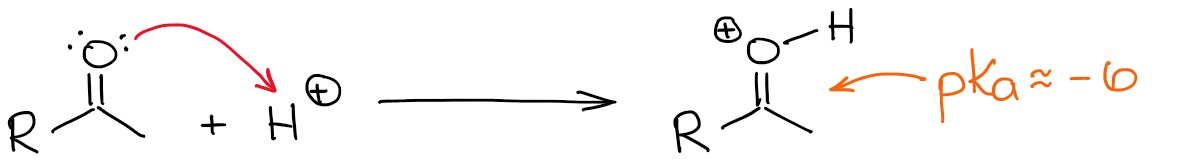
L’idrogeno più acido in un carbonile protonato è, ovviamente, quello sull’ossigeno. Tuttavia, rendere un legame C=O più polarizzato aggiungendovi un protone, rende anche la posizione α più acida. Quindi ora è un po’ più facile deprotonare la posizione α e fare un enolo.
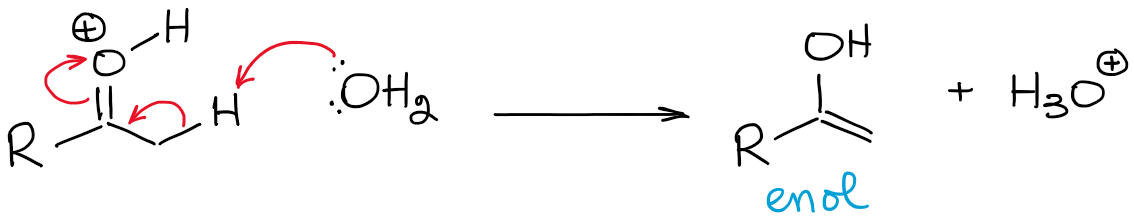
Questo equilibrio è enormemente sfavorevole e favorisce il carbonile in generale. Quindi, non si avrà mai un’alta concentrazione di enolo in condizioni acide, a meno che non ci sia un qualche effetto di stabilizzazione che renda l’enolo favorevole (raro).
Mentre tutti i possibili prodotti enolici possono essere prodotti, questa reazione favorirà sempre la formazione di un enolo termodinamico.
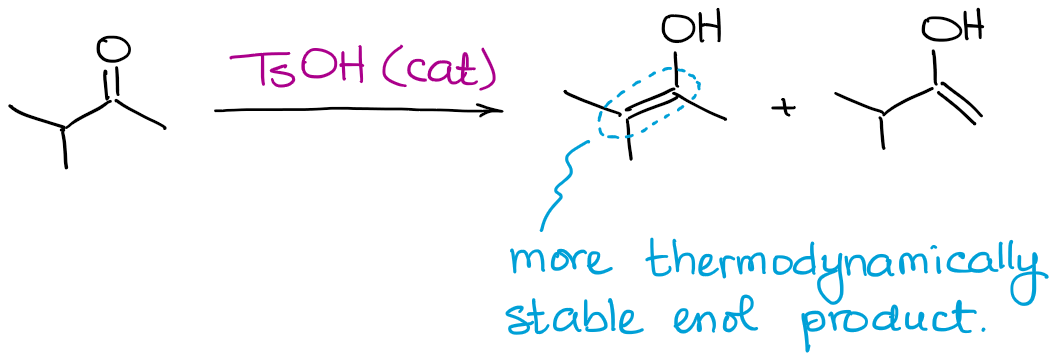
Proprio come nel caso degli enolati, un enolo termodinamico è quello che ha più sostituenti sul doppio legame.
Quali fattori influenzano l’enolizzazione catalizzata dall’acido?
Tutto ciò che può rendere un enolo più stabile aiuterà l’equilibrio. I fattori più comuni sono il legame a idrogeno e la coniugazione estesa.
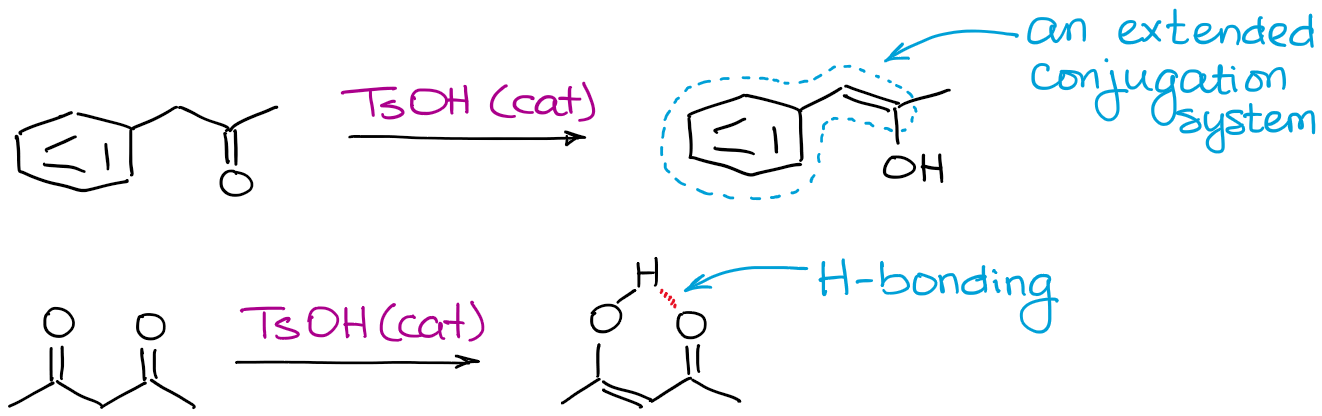
Perché preoccuparsi dell’enolizzazione acidase ci sono così tanti problemi?
Il tuo composto potrebbe essere sensibile alle basi. Inoltre, potrebbe essere più facile combinare più passaggi quando si verificano nelle stesse condizioni. Spesso combiniamo l’enolizzazione catalizzata dall’acido con altri passaggi in una reazione che si verificano anche in condizioni acide.
Devi tenere a mente, però, che i gruppi che sottraggono elettroni nelle vicinanze di un carbonile lo renderanno ancora meno basico di quanto non sia già. Quindi, se avete, per esempio, un alogeno in posizione α, sarà molto difficile forzare la formazione di un enolo.

Controlla sempre la presenza di EWG in posizione α-prima di ipotizzare la formazione di un enolo! Qualsiasi EWG che non offre la stabilizzazione di risonanza al doppio legame sfavorirà significativamente il processo di enolizzazione.
Cosa aspettarsi all’esame?
I professori raramente fanno domande che mirano specificamente alla formazione di enoli o enolati direttamente. Le domande sull’enolizzazione saranno sempre mascherate da qualcos’altro. Le domande di enolizzazione sono tipicamente formulate come:
- Trova l’idrogeno più acido nella seguente molecola… o
- Disegna il prodotto… (la reazione avrà un enolo o un enolato come intermedio)
Naturalmente, potrebbero fare una domanda diretta. Tuttavia, nella mia esperienza, la tautomerizzazione cheto-enolo e le enolizzazioni sono di solito il concetto sottostante che guida una certa domanda.