Proteina del mese
Novembre 2006
Più informazioni sulla proteina di questo mese |
|
ALTRE PROTEINE DI INTERESSE |
|
Molecola del mese: Fibrina |
|
ExPASy Protein Spotlight |
La coagulazione del sangue, o coagulazione, è una risposta rapida al danno tissutale, dove l’esposizione del fattore di tessuto contenente cellule nel flusso sanguigno attraverso il danno alle pareti dei vasi inizia un rapido sistema a cascata. Questa cascata enzimatica utilizza una serie di enzimi che lavorano in rapida successione per amplificare una piccola risposta in una grande nel sito del danno (vedi Figura 1). Una volta attivato, il fattore di tessuto (TF) si lega e attiva il fattore VII (FVII), iniziando la cascata. TF/FVII è attivato attraverso l’auto-cleavage a TF/FVIIa, che insieme al cofattore FVIIIa converte FIX in FIXa; FXa può quindi convertire FX in FXa, che insieme al cofattore FVa converte FII (protrombina) in FIIa (trombina); infine FIIaconverte il fibrinogeno in fibrina, portando al deposito di fibrina e all’attivazione delle piastrine per formare coaguli di sangue. L’attivazione di FXIII in FXIIIa può stabilizzare questi coaguli di sangue attraverso la reticolazione.
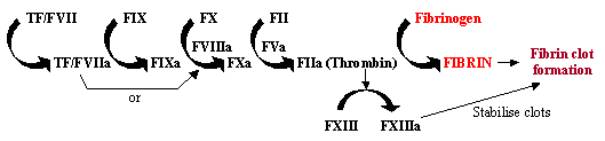
Figura 1. Cascata della coagulazione del sangue
Fibrinogeno, il completamento della cascata della coagulazione
Il fibrinogeno fu isolato per la prima volta dal plasma di cavallo da Hammarsten nel 1876, anche se un precursore inattivo della fibrina fu proposto come esistente già nel 1859 da Deni deCommercy. Il fibrinogeno può subire una trasformazione aremarkable da monomeri solubili (fibrogeno) ad un polymergel insolubile (fibrina polimerizzata).
Fibrinogeno è una plasmaglicoproteina sintetizzata nel fegato che è essenziale per l’emostasi (fermare la perdita di sangue dai tessuti danneggiati), la guarigione delle ferite, fibrinolisi, infiammazione, angiogenesi, interazioni cellulari e matrice, andneoplasia. Questi processi coinvolgono la conversione del fibrinogeno in fibrina, e spesso l’interazione della fibrina (ogen) a varie proteine e cellule. Peopleusually carry about 2.5g fibrinogen/L of blood, however, concentrations offibrogen can increase by as much as 200-400% during times of physiologicalstress (primarily due to the actions of macrophage-derived interleukin-6).
Il fibrinogeno è una grande e complessa glicoproteina composta da tre coppie di polipeptidi: due Aa, due Bb e due g. Questi polipeptidi sono legati insieme da 29 legami disolfuro, alcuni dei quali sono raffigurati nella figura 2 qui sotto. I polipeptidi sono orientati in modo che tutte e sei le estremità N-terminali si incontrino per formare il dominio E centrale. Due regioni di eliche alfa a spirale si estendono su entrambi i lati del dominio E, ciascuno composto da un Aa, un Bb e un g polipeptide. Ogni regione di bobina alfa termina in un dominio D globulare che consiste nelle estremità C-terminali di Bb e g, così come parte di Aa. L’estremità C-terminale di Aa sporge quindi da ogni dominio D come un lungo filo; queste protuberanze di Aa possono interagire tra loro e con il dominio E durante la reticolazione del coagulo di fibrina. Entrambi i domini E e D contengono importanti siti di legame per la conversione del fibrinogeno in fibrina, per l’assemblaggio e la reticolazione della fibrina e per l’aggregazione piastrinica. Gli ioni di calcio legati sono importanti per mantenere la struttura del fibrinogeno.
Le estremità N-terminali dei polipeptidi Aa e Bb sono scisse dalla trombina per trasformare il fibrinogeno solubile in fibrina che forma il gel. Una volta scissi dal fibrinogeno, le estremità N-terminali sono note come fibrinopeptide A (da Aapolipeptide) e fibrinopeptide B (da Bbpolipeptide).
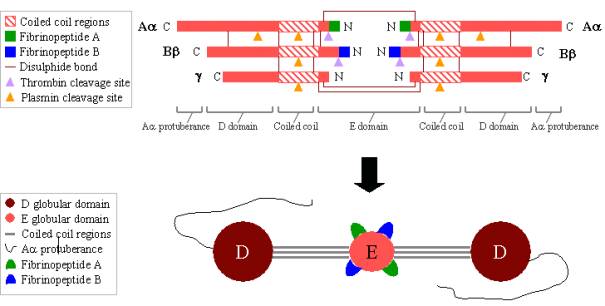
Figura 2. Fibrinogeno:
TOP – organizzazione polipeptidica del fibrinogeno.
BOTTOM – organizzazione del dominio del fibrinogeno.
Formazione del coagulo di sangue
Per formare un coagulo di sangue, il fibrinogeno deve prima essere scisso dalla trombina per rimuovere i fibrinopeptidi. La rimozione dei fibrinopeptidi A e B dalle estremità N-terminali di Aa e Bb espone le “manopole” sul dominio E, che possono interagire con i “fori” sempre presenti sui domini D. Le molecole di fibrina possono collegarsi tra loro attraverso l’interazione del dominio E di una molecola di fibrina con i domini D di altre quattro molecole di fibrina, polimerizzando così per formare oligomeri sfalsati che si accumulano in protofibrille. Man mano che gli oligomeri di fibrina si aggregano, queste protofibrille continuano ad allungarsi per formare lunghe fibre che possono avvolgersi l’una sull’altra per formare fasci spessi e multifilari, e che possono ramificarsi in una rete tridimensionale di fibre aggrovigliate, il coagulo di fibrina. Il coagulo di fibrina viene poi stabilizzato dal Fattore XIIIa, una transglutaminasi, dove la forma zimogena del Fattore XIII viene convertita in Fattore XIIIa attivo attraverso l’azione della trombina (vedi Figura 1). Il Fattore XIII lega trasversalmente i residui di glutammina su una molecola di fibrina ai residui di lisina su un’altra molecola di fibrina formando forti legami isopeptidici. Questo cross-linking avviene tra le estremità C-terminali (protuberanze Aa) dei polipeptidi Aa, così come (più lentamente) in altri siti, come tra le estremità C-terminali delle catene g. Questi legami incrociati aiutano a rafforzare il coagulo di fibrina, rendendolo più resistente ai danni fisici e chimici.
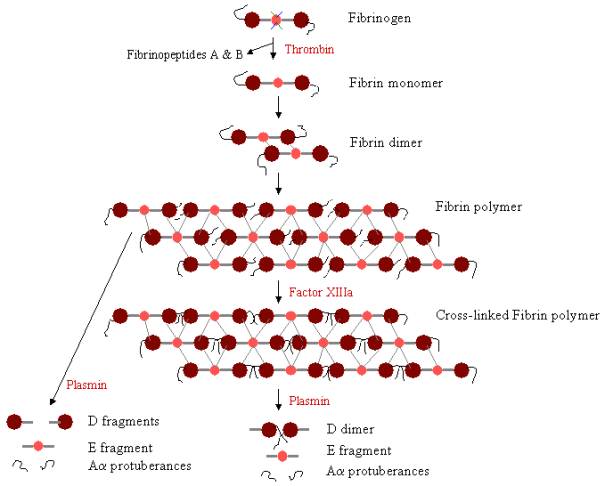
Figura 3. Polimerizzazione e lisi della fibrina: Percorso di polimerizzazione e rottura della fibrina. Le manopole del dominio E si legano ai fori di fino a quattro domini D (linee grigie), formando un lungo reticolo fibroso. Il coagulo viene poi stabilizzato attraverso la reticolazione. Il coagulo può essere degradato, producendo diversi prodotti di degradazione se è stato reticolato.