US Pharm. 2013;38(2):HS2-HS8.
ABSTRACT: insufficienza cardiaca acuta scompensata (ADHF), un’esacerbazione della funzione cardiaca cronica, polmonare e/o renale, rappresenta la maggior parte dei 39 miliardi di dollari spesi per insufficienza cardiaca cronica. La farmacoterapia di ADHF non è cambiata di recente, ma gli studi hanno indicato che la maggior parte della terapia è efficacemente, anche se non economicamente, equivalente. Basata sull’evidenza, la farmacoterapia stazionaria è guidata dalla comprensione dei sottoinsiemi emodinamici di Forrester e della loro fisiopatologia. Il successo clinico dipende non solo da un adeguato trattamento ospedaliero, ma anche dall’utilizzo di un team di dimissione. I farmacisti possono colmare il divario tra le visite in ospedale e l’assistenza ambulatoriale raccomandando e fornendo continuità di cura.
Nel 2010, il costo del trattamento dell’insufficienza cardiaca (HF) negli Stati Uniti è stato stimato in 39,2 miliardi di dollari.1,2Quasi 1 milione di pazienti vengono ricoverati ogni anno per esacerbazioni, e l’HF è attualmente il motivo più comune per il ricovero ospedaliero negli adulti di età superiore ai 65 anni.2 Lo scompenso cardiaco acuto (ADHF) può derivare da una HF cronica mal controllata e/o da una disfunzione cardiaca, polmonare o renale. Il costo ospedaliero delle cure per questi pazienti è estremamente alto, rappresentando circa il 60% delle spese totali per la HF.3
In aggiunta all’impatto finanziario della HF, la longevità e la qualità della vita sono gravemente compromesse nei pazienti con esacerbazioni acute. Il ricovero in ospedale è associato a un aumento del rischio di mortalità nei pazienti con HF; la mortalità si verifica nel 15,5% dei pazienti e un terzo dei pazienti non viene mai dimesso dall’ospedale.2 L’ADHF è una malattia invalidante che grava non solo sui pazienti, ma anche sul sistema sanitario.
La farmacoterapia dell’ADHF è un campo di battaglia per gli ospedali che cercano di controllare i costi in un’era di pagamenti ridotti e spese maggiori. Nell’ottobre 2012, il Centers for Medicare and Medicaid (CMS) ha iniziato a tagliare i rimborsi agli ospedali con alti tassi di pazienti ricoverati in tre stati di malattia ad alto costo: infarto miocardico (MI), polmonite e HF. Se i pazienti con queste condizioni vengono ricoverati entro 30 giorni, il CMS ridurrà il rimborso totale di base dell’1% all’anno, fino a una riduzione massima del 3% entro il 2014.4 Presto, la perdita finanziaria motiverà i quasi 2.000 ospedali che subiscono le sanzioni più alte a istituire nuove politiche e cure di follow-up per i pazienti dimessi con una diagnosi di HF.
Fortunatamente, un’analisi del 2011 del CMS ha mostrato che il tasso di ricoveri HF era effettivamente diminuito in un periodo di 10 anni.1 Nel 2008, c’erano 229.000 ricoveri in meno del previsto, date le tendenze osservate negli ultimi decenni.1,5 I ricercatori hanno attribuito questo declino a “riduzioni dell’incidenza della malattia coronarica, migliore controllo della pressione sanguigna, maggiore uso di terapie basate sull’evidenza e possibilmente cambiamenti nelle soglie di ammissione”. Il tasso di mortalità a 1 anno per tutte le cause, tuttavia, è rimasto alto a circa il 30% per i pazienti ricoverati in ospedale a causa di HF.1,5 I maschi neri e alcune regioni del paese sono andati peggio nei tassi di ospedalizzazione; i ricercatori hanno ipotizzato che le differenze di inaccessibilità o qualità delle cure potrebbero contribuire a questa disparità.1 I migliori risultati (costi ridotti e tassi di riammissione) sono visti con un approccio multidisciplinare che include medici, farmacisti, infermieri, nutrizionisti e fisioterapisti.6 Questo articolo è una breve rassegna della farmacoterapia dell’ADHF con uno sguardo aggiuntivo alle considerazioni farmaco-economiche e alle controversie sulla dimissione.
Patofisiologia
L’ADHF è definita come un improvviso peggioramento dei sintomi dell’HF ed è solitamente causata da edema polmonare cardiogeno con rapido accumulo di fluido nei polmoni, anche se può verificarsi senza edema polmonare.7 L’ipertensione, l’ischemia e/o la disfunzione ventricolardica causano una diminuzione della gittata cardiaca, che porta all’attivazione della via neuro-ormonale. Il sistema simpatico aumenta la norepinefrina per migliorare la perfusione periferica attraverso la vasocostrizione e attiva il sistema renina-angiotensina-aldosterone per aumentare la perfusione renale attraverso la ritenzione idrica.8 Un aumento acuto della pressione di riempimento ventricolare sinistra causa la perdita di proteine-pofluido negli alveoli polmonari e nell’interstizio, ma non si verifica alcuna integrità della membrana polmonare. I meccanismi compensatori aumentano la frequenza cardiaca e le resistenze vascolari sistemiche nel tentativo di migliorare la portata cardiaca, e ne consegue un circolo vizioso.7,8
Le cause comuni di ADHF includono disfunzione ventricolare sinistra o diastolica con o senza coronaropatia (CAD) o anomalie valvolari. Anche se la maggior parte dei pazienti ricoverati con ADHF ha un peggioramento della HF preesistente, fino al 20% dei pazienti non ha una diagnosi precedente di HF.9
ADHF può verificarsi anche in pazienti senza alcuna malattia cardiaca preesistente, comprese condizioni come ipertensione grave, sovraccarico di fluido, malattia renale grave o stenosi dell’arteria renale. I fattori che prevengono un evento coinvolgono un cambiamento nel flusso di sangue attraverso il cuore; ADHF può essere indotto da crisi ipertensiva, MI o ischemia, ostruzione atriale, rigurgito mitralico acuto, sovraccarico di liquidi, ornadherence ai farmaci HF. Alcuni farmaci, come i beta-bloccanti, i calcio-antagonisti non diidropiridinici e i farmaci antinfiammatori non steroidei (FANS), possono anche precipitare l’ADHF.7,10

Classificazione
L’ADHF può essere classificato in stadi emodinamici a seconda dell’indice cardiaco e della pressione del cuneo capillare polmonare. Gli stadi sono classificati come sottoinsiemi emodinamici di Forrester (TABELLA 1).11 L’indice cardiaco (CI) indica il grado di perfusione; i pazienti sono caratterizzati come “caldi” o “freddi” a seconda della presenza di ipoperfusione. Un CI di <2,2 L/min/m2 garantisce una classificazione di “freddo”, indicando ipoperfusione. Segni e sintomi coerenti con ipoperfusione includono affaticamento, ipotensione, coolextremities, diminuzione della funzione renale, e alterato stato mentale. pressione di incuneamento capillare polmonare (PCWP) indica lo stato dei fluidi; i pazienti sono classificati come “secco” o “bagnato” a seconda thepresence di edema, che è definito come un PCWP >18 mmHg. I segni e i sintomi del sovraccarico di volume includono tosse, dispnea, dispnea parossistica notturna, pressione venosa giugulare elevata, edema periferico, ascite, epatomegalia e splenomegalia.
La presentazione più comune, che costituisce due terzi dei ricoveri per ADHF, è il sottoinsieme II (caldo e umido).8 Rispetto al sottoinsieme I (caldo e secco), il sottoinsieme IV (freddo e umido) aumenta il tasso di morte di due volte e mezzo.12Tre parametri di laboratorio chiave indicano un aumento del rischio di mortalità nel paziente secondo lo studio Acute Decompensated Heart Failure NationalRegistry (ADHERE): azoto ureico nel sangue ≥43 g/dL, pressione sanguigna sistolica <115 mmHg, e/o creatinina sierica >2,75 mg/dL.13
Farmacoterapia
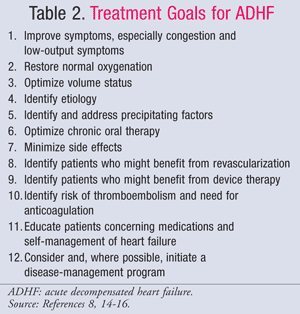
La gestione farmacologica dell’ADHF è guidata dallo stato emodinamico del paziente, che viene valutato utilizzando i valori di CI e PCWP (TABELLA 1).11 Gli obiettivi e i farmaci per il trattamento dell’ADHF sono riassunti nelle TABELLE 2 e 3.8,14-16Mentre lo standard di cura non è cambiato significativamente negli ultimi anni, una nuova attenzione all’impatto farmacoeconomico dell’HF ha dimostrato che non tutti i trattamenti sono uguali. La farmacoterapia dovrebbe essere scelta in base al sottogruppo diagnosticato, trattando il sovraccarico di liquidi o l’ipoperfusione. I pazienti del sottogruppo IV sono classificati come aventi sia sovraccarico di fluido che disfunzione perfusionale e, pertanto, richiedono una terapia per entrambi i sintomi.
Sottogruppo II o IV-Wet: I diuretici dell’ansa per via endovenosa (IV) sono il pilastro del trattamento delle ADHF per i pazienti che si presentano con sovraccarico di liquidi (PCWP >18 mmHg), nonostante i dati contrastanti sulla mortalità e la morbilità. Una meta-analisi di 14 piccoli studi ha mostrato una diminuzione della mortalità e dei ricoveri nei pazienti trattati con diuretici17 ; tuttavia, una recente analisi dei dati osservazionali dello studio ADHERE ha mostrato che i pazienti ricoverati trattati con diuretici per via endovenosa avevano una maggiore durata complessiva della degenza e una maggiore durata della degenza in terapia intensiva.18 Indipendentemente da ciò, l’aggiornamento del 2009 delle linee guida dell’American College of Cardiology/American HeartAssociation (ACC/AHA) per il trattamento dell’insufficienza cardiaca raccomanda la somministrazione precoce di diuretici per via endovenosa.14 Le dosi in bolo dei diuretici dell’ansa sono preferite. Furosemide è il più comunemente usato; tuttavia, bumetanide e torsemide sono altrettanto efficaci. Se i pazienti hanno una risposta inadeguata alla massima dose in bolo raccomandata di un loopdiuretico, l’infusione continua di furosemide può essere iniziata a 5 mg/h e titolata a 20 mg/h secondo necessità.14
La superiorità della somministrazione di furosemide in infusione continua deve ancora essere stabilita; lo studio DOSE (Diuretic Optimization StrategiesEvaluation), che ha studiato 308 pazienti ospedalizzati randomizzati a ricevere furosemide in bolo o endovena, non ha mostrato una differenza significativa tra gli endpoint di sicurezza ed efficacia, ma studi più piccoli hanno indicato un piccolo aumento della produzione urinaria con l’infusione continua.19 Gli effetti non gestiti della diuresi rapida, come gli squilibri elettrolitici e la disfunzione renale, possono portare a un’ospedalizzazione prolungata oltre la risoluzione dei sintomi dell’ADHF, quindi elettroliti e creatinina sierica devono essere monitorati frequentemente.
Un’altra strategia per aumentare la diuresi è aggiungere un secondo diuretico con un diverso meccanismo d’azione come il metolazone o lo spironolattone. Il metolazone, un diuretico simile alla tiazide, è utilizzato più frequentemente per il controllo acuto del volume; tuttavia, lo spironolattone e altri antagonisti dell’aldosterone sono preferiti nella terapia cronica della HF.20-22
In pazienti con ipertensione continua e/o sintomi persistenti nonostante la diuresi aggressiva, può essere aggiunto un vasodilatatore per ridurre la congestione polmonare. Il nitroprussiato di sodio, la nesiritide e la nitroglicerina per via endovenosa sono vasodilatatori che alleviano rapidamente i sintomi della congestione riducendo la PCWP. Se un paziente si presenta con bassa gittata cardiaca ed elevata resistenza vascolare sistemica, si raccomandano vasodilatatori venosi o inotropi, sebbene i vasodilatatori siano la terapia preferita. A causa del rischio di tossicità da cianuro per infusioni prolungate e ad alte dosi di nitroprussiato, i vasodilatatori preferiti sono la nesiritide e la nitroglicerina. Dei due, la nesiritide ha prodotto un maggiore miglioramento dello stato clinico globale rispetto alla nitroglicerina nel trial Vasodilation in theManagement of Acute Congestive Heart Failure (VMAC) nonostante la propensione del farmaco a causare ipotensione.13 Pertanto, la nesiritide è l’agente preferito in un paziente con sovraccarico di liquidi e bassa gittata cardiaca.
L’utilità della nesiritide è stata messa in discussione a causa del suo alto costo di acquisizione.23 Mancano dati clinici sui risultati, ma un modello farmaco-economico mostra che l’alto costo iniziale della nesiritide è compensato dal minor tasso di riammissione in ospedale entro 21 giorni rispetto ai pazienti che hanno ricevuto dobutamina.24 Analogamente, un’analisi retrospettiva dei dati ADHERE ha mostrato che i pazienti trattati con nitroglicerina o nesiritide sono stati dimessi dall’ospedale prima dei pazienti trattati con dobutamina o milrinone e avevano anche un rischio di mortalità inferiore.13 Poiché un maggior numero di pazienti in condizioni critiche sono stati trattati inotropi, è difficile attribuire l’incidenza dell’aumento della mortalità al farmaco.
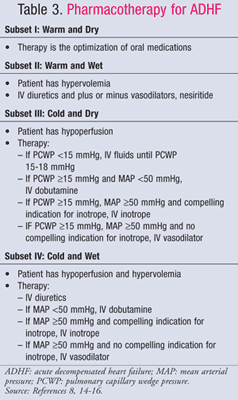
Subset III o IV-Freddo: Dobutamina andmilrinone sono gli inotropi di scelta per aumentare la perfusione andpreserve end-organ perfusion in pazienti con diminuita gittata cardiaca.indicazioni convincenti per inotropi includono pressione sanguigna sistolica<90 mmHg, ipotensione sintomatica nonostante adeguate pressioni di riempimento (PCWP 15-18 mmHg), peggioramento della funzione renale, o risposta inadeguata aIV vasodilatatori. Una prudente selezione dei pazienti è necessaria perché i dati suggeriscono che gli esiti scadenti si verificano quando gli inotropi vengono somministrati a pazienti con gittata cardiaca conservata. Lo studio OPTIME-CHF ha mostrato un aumento non significativo della mortalità e delle aritmie quando le infusioni di milrinone sono state somministrate ai pazienti come parte della cura standard.25 Il milrinone dovrebbe essere scelto per trattare i pazienti che ricevono beta-bloccanti concomitanti poiché esercita un effetto sulla portata cardiaca e sulla resistenza vascolare sistemica attraverso l’inibizione della fosfodiesterasi, mentre la dobutamina è un agonista abeta1. La dobutamina, tuttavia, è la scelta migliore per i pazienti ipotesi, poiché il milrinone può causare cali significativi della pressione sanguigna.15
Pianificazione della dimissione
La fase finale del trattamento dell’ADHF è la pianificazione della dimissione e il follow-up. Sia le linee guida ACC/AHA che quelle dell’Heart Failure Society of America (HFSA) sostengono l’importanza di una corretta pianificazione della dimissione.14,15 Le linee guida ACC/AHA raccomandano di fornire istruzioni scritte o materiale educativo ai pazienti e/o ai caregiver al momento della dimissione per quanto riguarda: livello di attività, dieta, farmaci di dimissione, appuntamenti di follow-up, monitoraggio del peso e cosa fare se i sintomi peggiorano.14Le linee guida indicano anche il beneficio di iniziare la terapia orale per la HF durante il ricovero in ospedale, come gli inibitori dell’enzima di conversione dell’angiotensina (ACE) e i beta-bloccanti.Gli studi dimostrano che la cura basata sulle linee guida diminuisce la mortalità,26 ma non riesce a mostrare una riduzione dei tassi di riammissione per i pazienti con HF.27,28

Il supporto alla dimissione, o gestione dei casi in ospedale, viene ora utilizzato per la pianificazione della dimissione. Il supporto alla dimissione è un approccio multidisciplinare, basato sul team di cura che si occupa di supporto medico, educazione del paziente, pianificazione del follow-up e coordinamento delle informazioni. Una meta-analisi di 18 studi randomizzati e controllati (RCT) che analizzano la pianificazione della dimissione con il supporto post-dimissione che coinvolge 3.304 pazienti ha trovato una riduzione significativa delle riammissioni per tutte le cause (rischio relativo 0,75, 95% CI 0,68-0,88).29 La validità esterna della meta-analisi è difficile da determinare ma può offrire alcune strategie efficaci dal punto di vista dei costi. Una strategia proviene da un RCT su 223 pazienti affetti da HF che ha confrontato il tradizionale supporto alla dimissione con materiale educativo con una sessione di insegnamento individuale di 1 ora con un educatore infermieristico prima della dimissione.30 Il gruppo di intervento infermieristico ha avuto minori rischi di riospedalizzazione o morte 180 giorni dopo la dimissione ed è stato stimato un risparmio di 2.823 dollari per paziente. Al contrario, studi osservazionali su larga scala non hanno trovato alcuna relazione tra i pazienti che hanno ricevuto materiale educativo e la diminuzione dei tassi di riammissione.26,31 Le attuali linee guida ACC/AHA non dichiarano esplicitamente come dimettere i pazienti dopo l’ADHF se non fornendo materiale educativo.14 Le raccomandazioni delle linee guida potrebbero non fornire procedure di dimissione che aiutino gli ospedali a rispettare le aspettative del CMS.
Sebbene il materiale educativo alla dimissione non abbia mostrato un beneficio in termini di mortalità, ogni agente orale aggiuntivo utilizzato per il trattamento delleHF, come un beta-bloccante o un antagonista dell’aldosterone, può ridurre le ospedalizzazioni e/o la mortalità del 25% – 35%. Le linee guida ACC/AHA suggeriscono che molti pazienti affetti da HF vengono dimessi prima che venga raggiunto uno stato volumetrico ottimale o mandati a casa senza il beneficio delle terapie salvavita, il che perpetua la rapida riammissione di tali pazienti.14 Un farmacista ospedaliero dovrebbe essere un sostenitore dei pazienti nel team di supporto alla dimissione, fornendo assistenza nella riconciliazione dei farmaci, interrompendo i farmaci controindicati e raccomandando una farmacoterapia HF basata sull’evidenza. I farmaci dovrebbero essere iniziati il prima possibile, idealmente nel contesto ospedaliero; l’inizio di questi farmaci può esacerbare i sintomi di HF che precipitano l’ADHF, il che evidenzia ulteriormente l’importanza di un follow-up tempestivo per questa popolazione di pazienti.
Conclusione
L’ADHF è un peso per i pazienti, gli operatori sanitari e i contribuenti. La farmacoterapia per l’ADHF non è cambiata di recente, ma l’utilizzo di team di supporto alla dimissione e il rapido follow-up dopo la dimissione forniscono opportunità per l’intervento del farmacista, sia dentro che fuori dall’ospedale. I farmacisti della comunità possono giocare un ruolo importante nella continuità delle cure, aiutando la transizione dei pazienti dall’ospedale alle cure primarie. I farmacisti sono in grado di offrire adeguate raccomandazioni basate sulle linee guida, assistere alla riconciliazione dei farmaci e fornire un’educazione alla dimissione. Con i recenti cambiamenti nel rimborso CMS, i farmacisti devono assumere un ruolo maggiore nel trattamento di questa malattia cronica.
1. Winslow R, Wang SS. L’insufficienza cardiaca mette meno in ospedale. Wall Street Journal. 19 ottobre 2011. http://online.wsj.com/article/SB10001424052970203658804576639360226103584.html. Accessed settembre 1, 2012.
2. Lloyd-Jones D, Adams RJ, Brown TM, et al. Statistiche di malattia di cuore e ictus-2010 aggiornamento. Un rapporto dell’American HeartAssociation. Circolazione. 2010;121:e46-e215.
3. Michota FA Jr, Amin A. Colmare il divario tra prove e pratica nella gestione acuta scompensata insufficienza cardiaca. J Hosp Med. 2008;3(suppl):S7-S15.
4. Rau J. Medicare per penalizzare 2.217 ospedali per eccesso di riammissioni. Kaiser Health News.13 agosto 2012.www.kaiserhealthnews.org/Stories/2012/August/13/medicare-hospitals-readmissions-penalties.aspx.Accessed 1 settembre 2012.
5. Chen J, Normand ST, Wang Y, Krumholz HM. Tendenze nazionali e regionali nell’ospedalizzazione di insufficienza cardiaca e tassi di mortalità per i beneficiari di Medicare, 1998-2008. JAMA. 2011;306:1669-1678.
6. Amin A. Chi sta gestendo l’insufficienza cardiaca acuta scompensata? La necessità di un approccio multidisciplinare. J Hosp Med. 2008;6(suppl):S1-S6.
7. Pinto DS, Lewis S. Fisiopatologia dello scompenso cardiaco acuto. In: Basow DS, ed. UpToDate. Waltham, MA: UpToDate; 2012.
8. Crouch MA, Didomenico RJ, Rodgers JE. Applicare le linee guida di consenso nella gestione di scompenso cardiaco acuto. Programma ACPE #204-000-06-407-H01. Bethesda, MD: ASHP Advantage;2007.
9. Joseph SM, Cedars AM, Ewald GA, et al. Scompenso cardiaco acuto scompensato: gestione medica contemporanea. Tex Heart Inst J. 2009;36:510-520.
10. Pinto DS, Lewis S. Valutazione dell’insufficienza cardiaca acuta scompensata. In: Basow DS, ed. UpToDate. Waltham, MA: UpToDate; 2012.
11. Forrester JS, Diamond G, Chatterjee K, et al. Terapia medica di infarto miocardico acuto mediante applicazione di hemodynamicsubsets. N Engl J Med. 1976;295:1356-1362.
12. Nohria A, Mielniczuk LM, Stevenson LW. Valutazione e monitoraggio dei pazienti con sindromi di insufficienza cardiaca acuta. Am J Cardiol. 2005;96:32G-40G.
13. Abraham WT, Adams KF, Fonarow GC, et al. In-hospitalmortality in pazienti con insufficienza cardiaca acuta scompensata che richiedono farmaci vasoattivi per via endovenosa: un’analisi dal AcuteDecompensated Heart Failure National Registry (ADHERE). J Am Coll Cardiol. 2005;46:57-64.
14. Hunt SA, Abraham WT, Chin MH, et al. 2009 focusedupdate incorporato nelle linee guida ACC/AHA 2005 per la diagnosi e la gestione di insufficienza cardiaca negli adulti: un rapporto dell’AmericanCollege of Cardiology Foundation/American Heart Association Task Forceon Practice Guidelines. Circolazione. 2009;119;e391-e479.
15. Società di insufficienza cardiaca dell’America. Valutazione e gestione dei pazienti con insufficienza cardiaca acuta scompensata: HFSA 2010comprehensive heart failure practice guideline. J Card Fail. 2010;16:e134-e156.
16. Colucci W. Trattamento dell’insufficienza cardiaca acuta scompensata: Componenti della terapia. In: Basow DS, ed. UpToDate. Waltham, MA: UpToDate; 2012.
17. Faris R, Flather MD, Purcell H, et al. Diuretici per insufficienza cardiaca. Cochrane Database Syst Rev. 2012;(1):CD003838.
18. Gheorghiade M, Filippatos G. Rivalutazione del trattamento delle sindromi acute di insufficienza cardiaca: il registro ADHERE. Eur Heart J. 2005;7:813-819.
19. Felker GM, Lee KL, Bull DA, et al. Strategie diuretiche in pazienti con insufficienza cardiaca acuta scompensata. N Engl J Med. 2011;364:797-805.
20. Efficacia di spironolattone aggiunto a un inibitore dell’enzima di conversione dell’angiotensina e un diuretico dell’ansa per grave insufficienza cardiaca congestizia cronica (il Randomized Aldactone EvaluationStudy). Am J Cardiol. 1996;78:902-907.
21. Pitt B, Remme W, Zannad F, et al. Eplerenone, aselective aldosterone blocker, in pazienti con ventriculardysfunction sinistra dopo infarto miocardico. N Engl J Med. 2003;348:1309-1321.
22. Zannad F, McMurray JJ, Krum H, et al; EMPHASIS-HFStudy Group. Eplerenone in pazienti con insufficienza cardiaca sistolica e sintomi lievi. N Engl J Med. 2011;364:11-21.
23. Gerhard T, Zineh I, Winterstein AG, Hartzema AG.Pharmacoeconomic modeling di nesiritide contro dobutamina fordecompensated insufficienza cardiaca. Farmacoterapia. 2006;26:34-43.
24. Lissovoy G, Stier DM, Ciesla G, et al. Economicimplications di nesiritide versus dobutamina nel trattamento ofpatients con insufficienza cardiaca congestizia acutamente scompensata. Am J Cardiol. 2003;92:631-633.
25. Cuffe MS, Califf RM, Adams KF Jr, et al. milrinone a breve termine intravenosa per esacerbazione acuta di insufficienza cardiaca: arandomized controlled trial. JAMA. 2002;287:1541-1547.
26. Kfoury AG, French TK, Horne BD, et al. beneficio di sopravvivenza incrementale con aderenza alle misure di base standardizzate di insufficienza cardiaca: uno studio di valutazione delle prestazioni di 2958 pazienti. J Card Fail. 2008;14:95-102.
27. Patterson ME, Hernandez AF, Hammill BG, et al. Processof care misure di performance e risultati a lungo termine in pazienti ospedalizzati con insufficienza cardiaca. Med Care. 2010;48:210.
28. Fonarow GC, Abraham WT, Albert NM, et al. Associazione tra misure di performance e risultati clinici per i pazienti ospedalizzati con insufficienza cardiaca. JAMA. 2007;297:61-70.
29. Phillips CO, Wright SM, Kern DE, et al. Comprehensivedischarge pianificazione con supporto post-scarico per i pazienti anziani con insufficienza cardiaca congestizia: una meta-analisi. JAMA. 2004;291:1358-1367.
30. Koelling TM, Johnson ML, Cody RJ, Aaronson KD.Discharge educazione migliora i risultati clinici in pazienti con insufficienza cardiaca cronica. Circolazione. 2005;111:179-185.
31. Jha AK, Orav EJ, Epstein AM. Segnalazione pubblica della pianificazione della dimissione e dei tassi di riammissione. N Engl J Med. 2009;361:2637-2645.