Karthish Manthiram sogna un futuro elettrificato. L’ingegnere chimico del MIT è tra un gruppo crescente di ricercatori che esplorano i modi in cui l’elettrochimica alimentata da fonti rinnovabili potrebbe sostituire i combustibili fossili come base dell’industria chimica.
“La visione generale è quella di pensare a un futuro in cui la produzione chimica inizia solo con anidride carbonica, acqua e azoto”, dice Manthiram. Se iniziamo con queste tre materie prime, e abbiamo elettricità rinnovabile, allora possiamo immaginare di usare l’anidride carbonica come fonte di atomi di carbonio, usare l’acqua per gli ossigeni e gli idrogeni, e il dinitrogeno come fonte di azoto, e iniziare a cucire insieme molecole organiche relativamente complesse”, dice.
In quel mondo futuro che stiamo sognando, potremmo fare l’ammoniaca solo da aria, acqua ed elettricità rinnovabile
In cima alla lista delle molecole che i ricercatori elettrochimici vogliono fare in questo modo c’è l’ammoniaca. Ingrediente chiave dei fertilizzanti sintetici, circa 175 milioni di tonnellate di ammoniaca sono prodotte ogni anno. Ma le grandi quantità in cui viene fatta, e la natura ad alta intensità energetica della sua produzione, significa che gli impianti di ammoniaca consumano circa il 2% della produzione globale di energia, e producono una proporzione simile delle emissioni globali di anidride carbonica.
Con la crescente disponibilità di elettricità rinnovabile, i ricercatori possono vedere un percorso alternativo per l’ammoniaca. In quel mondo futuro che stiamo sognando, potremmo produrre ammoniaca solo da aria, acqua ed elettricità rinnovabile”, dice Manthiram. Quest’anno, il laboratorio di Manthiram si è unito ai pochi in tutto il mondo ad aver definitivamente dimostrato che, se mediata da un elettrocatalizzatore al litio, l’ammoniaca potrebbe essere prodotta in questo modo.
In un giovane campo di ricerca in cui le prime affermazioni sulla produzione elettrochimica di ammoniaca spesso non hanno retto al controllo, la manciata di risultati solidi che coinvolgono la produzione di ammoniaca mediata dal litio potrebbe formare la solida base da cui si inizia a costruire un futuro di ammoniaca pulita.
Mal di testa da scissione
La grande sfida della sintesi dell’ammoniaca, elettrochimica o meno, è l’esigenza di prendere il dinitrogeno dall’aria e spezzarlo in due. Il triplo legame che tiene insieme i due atomi di azoto è uno dei più forti conosciuti.
Dal secolo scorso, gli impianti di ammoniaca hanno superato la reticenza del dinitrogeno a reagire attraverso un processo in due fasi. Nella prima fase, la reazione di steam-methane reforming, l’acqua e il metano sono riscaldati su un catalizzatore che incoraggia lo scambio di partner atomici, producendo un flusso di anidride carbonica e idrogeno. L’idrogeno viene poi fatto reagire con l’azoto su un catalizzatore di ferro nel processo Haber-Bosch, dal nome dei chimici tedeschi Fritz Haber, che inventò la reazione, e Carl Bosch, che la perfezionò per l’industria.
Gran parte della nostra disuguaglianza nell’accesso al cibo nel mondo è riconducibile al fatto che la produzione di ammoniaca è centralizzata
Quello che Haber ha scoperto è un modo per aggirare il problema che, alle alte temperature necessarie per scindere il dinitrogeno, l’equilibrio per la formazione dell’ammoniaca si trova molto a sinistra, dice Ib Chorkendorff, un ricercatore di catalisi alla Technical University of Denmark, e direttore del Villum Center per la scienza dei combustibili e dei prodotti chimici sostenibili. La grande invenzione di Haber è stata quella di rendersi conto che non si ottiene ammoniaca se non la si pressurizza”, dice Chorkendorff. Se prendi quattro moli di gas e le trasformi in due, la pressione aiuta molto”. Gli impianti Haber Bosch oggi funzionano tipicamente a pressioni superiori alle 200 atmosfere.
L’anidride carbonica stechiometrica che la reazione produce, così come le emissioni di carbonio coinvolte nella generazione delle alte temperature e pressioni richieste, è una ragione convincente per cercare un approccio alternativo. Ma anche se l’anidride carbonica non fosse un gas che intrappola gli infrarossi e porta al riscaldamento globale, avremmo ancora un problema con il processo”, dice Manthiram. Le temperature e le pressioni davvero elevate significano che non è possibile fare questa reazione in modo distribuito”.
Il costo della costruzione di reattori ad alta pressione fa pendere l’equilibrio economico pesantemente verso la costruzione di impianti di ammoniaca molto grandi e centralizzati. Gran parte della nostra disuguaglianza nell’accesso al cibo nel mondo è riconducibile al fatto che la produzione di ammoniaca è centralizzata”, dice Manthiram. Nell’Africa sub-sahariana, l’infrastruttura di distribuzione è così povera che il fertilizzante finisce per costare da due a tre volte la media internazionale. Questo ne limita l’uso, il che porta a basse rese dei raccolti, fame, minore produttività della forza lavoro, minori guadagni, il che limita ulteriormente la capacità di permettersi il fertilizzante.
L’ammoniaca prodotta da aria, acqua ed elettricità rinnovabile, a temperature e pressioni ambientali, potrebbe essere prodotta ovunque sia necessario.
Sentendo la spinta delle rinnovabili
I ricercatori hanno cercato per decenni di trovare alternative più verdi alla reazione Haber-Bosch. La differenza questa volta è il rapido cambiamento del mercato dell’energia, dice Doug MacFarlane, un chimico della Monash University che dirige l’Australian Research Council Centre of Excellence for Electromaterials Science. Negli ultimi 10 anni circa, sono diventate disponibili quantità crescenti di energia rinnovabile sempre più economica”, dice MacFarlane. Dal 2010, il prezzo dell’energia solare è sceso dell’80% e quello dell’energia eolica del 50%, con la prospettiva di ulteriori cadute. Questo ha messo l’accento sulle tecnologie elettrochimiche in senso lato, usando gli elettroni come riduttore finale”, dice.

Fonte: Courtesy of the Science and Technology Facilities Council
Siemens Energy Green Ammonia Demonstrator nel Regno Unito sta testando la scissione dell’acqua e la chimica Haber-Bosch
Il laboratorio di MacFarlane – come molti laboratori di sintesi elettrochimica – si è inizialmente concentrato sulla chimica di scissione dell’acqua guidata dalle energie rinnovabili, per produrre un flusso di idrogeno pulito che potrebbe essere usato come materia prima o carburante. La seconda ondata di ricerca si è concentrata sulla riduzione dell’anidride carbonica, per trasformare le emissioni di carbonio in prodotti utili, dice. Crescendo da questo, circa sei anni fa abbiamo cominciato a capire che la nostra ricerca aveva una terza prospettiva, che era la riduzione dell’azoto”, dice MacFarlane. Sono le stesse idee, lo stesso kit di laboratorio, ma un substrato diverso e un prodotto di destinazione”. Piuttosto che idrogeno, la cella produrrebbe un flusso di ammoniaca.
La produzione di ammoniaca potrebbe andare ben oltre l’uso di fertilizzanti. Il calo dei prezzi dell’elettricità spinto dalle energie rinnovabili ha già spinto a ripensare la tradizionale reazione di steam reforming (vedi box Riformazione elettrica qui sotto). Paesi come l’Australia, che hanno risorse solari ed eoliche ben oltre il loro fabbisogno, stanno guardando all’ammoniaca sintetizzata elettrochimicamente non solo per la produzione di fertilizzanti più puliti, ma come un combustibile verde che potrebbe consentire l’esportazione di energia rinnovabile.
Nel maggio 2020, MacFarlane e i suoi colleghi hanno pubblicato una tabella di marcia che traccia il percorso potenziale verso un’economia verde dell’ammoniaca. Il concetto di prima generazione, l’idea di combinare la produzione convenzionale di ammoniaca con la cattura del carbonio, è già stato superato da un approccio di seconda generazione, in cui l’idrogeno per Haber-Bosch proviene dalla scissione elettrochimica dell’acqua alimentata da fonti rinnovabili, piuttosto che dallo steam reforming guidato dal metano.
Dopo decenni di ricerca, la scissione elettrochimica dell’acqua ha raggiunto il punto in cui gli spaccatori d’acqua su scala industriale stanno diventando disponibili, da aziende come ITM-Power in UK e Siemens in Germania. Siemens ha già testato il concetto di combinare la scissione dell’acqua e Haber-Bosch nel Siemens Green Ammonia Demonstrator nell’Oxfordshire. Nella regione Pilbara dell’Australia occidentale – che riceve una delle più alte energie solari annuali di tutto il pianeta – anche Yara Fertilisers si sta preparando a pilotare il cambiamento. Questo impianto produce attualmente il 5% dell’ammoniaca mondiale.
La barriera principale all’ampia adozione della produzione di ammoniaca di seconda generazione non è più il costo dell’elettricità rinnovabile, dice MacFarlane. La barriera è il costo di capitale delle cellule di elettrolisi”, dice. Gli elettrodi più performanti per la scissione dell’acqua usano metalli preziosi.
Riformazione elettrica
Il primo passo nella sintesi convenzionale dell’ammoniaca è generare l’idrogeno che sarà combinato con il dinitrogeno per fare ammoniaca. Oggi, quell’idrogeno proviene dal metano, attraverso la reazione di steam reforming, guidata da una serie di bruciatori a gas che circondano i tubi rivestiti di catalizzatore in cui avviene la reazione.
La quantità di catalizzatore può essere ridotta di un ordine di grandezza
Lo steam reforming è così endotermico, genera un significativo gradiente di temperatura all’interno del tubo, che può portare all’accumulo di carbonio sulla superficie del catalizzatore e al blocco o addirittura alla rottura del tubo.
Nel 2019, Chorkendorff ha dimostrato che la reazione potrebbe essere guidata molto più efficacemente dal riscaldamento ohmico. Il passaggio di una corrente elettrica attraverso il tubo d’acciaio del steam reformer genera calore in loco, a causa della resistività elettrica. Otteniamo un contatto molto stretto tra la fonte di riscaldamento e il catalizzatore, il che elimina tutti i problemi di trasporto del calore e non abbiamo alcun gradiente di temperatura”, dice Chorkendorff.
Oltre a evitare il deposito di carbonio, il riscaldamento ohmico offre molti vantaggi, aggiunge Chorkendorff. Per avviare un impianto di steam reforming di solito ci vuole circa una settimana, ma il sistema con riscaldamento ohmico richiede circa due minuti. La quantità di catalizzatore può essere ridotta di un ordine di grandezza e le dimensioni dell’impianto di due ordini di grandezza”, dice. In precedenza, il costo dell’elettricità rendeva il riscaldamento ohmico proibitivo – ma con le energie rinnovabili, questo non è più il caso, dice Chorkendorff. L’azienda con cui Chorkendorff ha collaborato per portare avanti la ricerca sta già lavorando su un impianto pilota, e ha piani per il riscaldamento ohmico ben oltre lo steam reforming, dice.
Ridurre i costi
Trovare alternative più economiche agli elettrodi di platino e iridio è stato un obiettivo a lungo termine del laboratorio di Chorkendorf. Nel 2005 il team ha dimostrato che il solfuro di molibdeno è un forte elettrocatalizzatore per la reazione di evoluzione dell’idrogeno. La parte cataliticamente attiva del MoS2 si è rivelata essere lungo i bordi del catalizzatore, piuttosto che sulla sua superficie piatta, spingendo molte ricerche a sviluppare materiali MoS2 nanostrutturati o stratificati che massimizzano la proporzione dei bordi.
Sappiamo che un catalizzatore OER deve essere un ossido e deve essere stabile a pH estremi
‘Abbiamo guardato molto all’evoluzione dell’idrogeno, ma lo consideriamo risolto – ci sono alcuni catalizzatori molto buoni’, dice Chorkendorff. Il vero problema è l’energia persa a causa dell’evoluzione dell’ossigeno”, sostiene. Le celle a scissione d’acqua producono idrogeno al catodo e ossigeno all’anodo (vedi box nel frattempo, all’anodo sotto). La bassa efficienza della reazione di evoluzione dell’ossigeno (OER) sul lato dello splitter dell’acqua rende l’intero processo più energivoro e più costoso da eseguire. Oggi funzionano con un’efficienza massima del 70%, ma normalmente non così alta.”
Nonostante anni di lavoro, la svolta del catalizzatore OER deve ancora arrivare. Non c’è nulla che dica che non possiamo trovare un materiale, ma sappiamo che è sempre più stretto – sappiamo che deve essere un ossido, deve essere stabile sia in acido forte che in soluzione alcalina forte”, dice Chorkendorff. Gli elettrolizzatori vengono fatti funzionare a un estremo o all’altro della scala del pH per massimizzare l’efficienza, ma i catalizzatori OER più attivi non sono abbastanza stabili in queste condizioni per un uso pratico a lungo termine.
Un concetto, introdotto da Daniel Nocera, allora al Massachusetts Institute of Technology negli Stati Uniti, è un catalizzatore OER autorigenerante, che si forma in situ e si rigenera continuamente dagli ioni metallici nell’elettrolita. Gli elettrocatalizzatori di Nocera funzionavano in condizioni neutre. Nel 2019, MacFarlane e i suoi colleghi hanno dimostrato un catalizzatore OER autorigenerante, generato in situ, a ossido di metallo misto per condizioni fortemente acide.
Mentre, all’anodo
Per la maggior parte dei processi elettrochimici – fare idrogeno o ammoniaca, o ridurre il biossido di carbonio – tutti gli occhi sono sul catodo. La reazione di accompagnamento che avviene all’anodo è un processo ossidativo che tipicamente genera ossigeno, un innocuo sottoprodotto dell’evento principale.
“Molte persone considerano l’ossigeno solo un prodotto di scarto”, dice Chorkendorff. Ma ci sono usi potenzialmente preziosi per il gas. Un flusso di ossigeno puro è la chiave del concetto di centrali elettriche a ossicombustibile, che evitano i problemi di cattura del carbonio bruciando il combustibile nell’ossigeno piuttosto che nell’aria. Se si brucia la biomassa in una centrale elettrica con quell’ossigeno, si ottiene un grado molto più alto di anidride carbonica”, dice Chorkendorff.
Manthiram vede anche un valore nella reazione anodica. Abbiamo lavorato su metodi con cui si può usare quell’ossigeno per la sintesi chimica, invece di cercare di combinare due atomi di ossigeno per fare il diossigeno, che è cineticamente difficile da fare”. Dal lavoro precedente, il team sapeva che l’ossido di manganese è un catalizzatore che ossida l’acqua, generando una specie oxo di manganese nel processo. E se potessimo intercettare questo usando un’olefina, per fare un epossido? Chiede Manthiram. Era una pura congettura, ma in qualche modo ha funzionato”. Oltre a produrre epossidi, il team ha dimostrato che può inserire l’ossigeno in un legame carbonio-carbonio per fare lattoni. Potrebbe rendere l’elettrolizzatore di acqua più economicamente fattibile”, dice Manthiram. Non c’è modo di fare tutto l’idrogeno del mondo in questo modo – abbiamo un bisogno troppo grande di idrogeno – ma potremmo fare dell’idrogeno che è veramente economico mentre co-creiamo lattoni che vanno in plastiche biodegradabili ad alto volume, o epossidi ad alto volume per fare glicole etilenico.
Fonti inaffidabili
Con la scissione dell’acqua ancora da perfezionare, e con la sua continua dipendenza dalla reazione Haber-Bosch, la speranza è che la produzione di ammoniaca verde di seconda generazione sia un passo avanti verso l’obiettivo finale di produrre ammoniaca direttamente per via elettrochimica. Piuttosto che produrre gas diidrogeno, gli atomi di idrogeno e di azoto potrebbero essere combinati in situ al catodo per fare ammoniaca.
La sfida principale è trovare il modo di favorire la produzione di ammoniaca rispetto alla formazione di diidrogeno, spiega Manthiram. La riserva di elettroni al catodo potrebbe reagire con due protoni in soluzione per fare idrogeno; o invece reagire con l’azoto per rompere il triplo legame, e anche reclutare sei protoni, per fare due molecole di ammoniaca”, dice Manthiram. Praticamente qualsiasi catalizzatore tenderà a produrre più idrogeno che ammoniaca”.
Negli ultimi cinque anni circa, è apparso un flusso di documenti che sembravano mostrare catalizzatori che potevano produrre un po’ di ammoniaca nel flusso di gas prevalentemente idrogeno prodotto al catodo. Nel frattempo, il laboratorio di MacFarlane stava testando l’idea che un buon modo per sopprimere la produzione di idrogeno sarebbe stato quello di eliminare una fonte importante di protoni – l’elettrolita. Passando a un elettrolita liquido ionico aprotico, e poi aggiungendo solo la quantità controllata di acqua, acido o base, il team ha dimostrato di poter favorire la produzione di ammoniaca.
Virtualmente qualsiasi catalizzatore tenderà a produrre più idrogeno che ammoniaca
‘Il lavoro aprotico è abbastanza agnostico sul catalizzatore, quindi il nostro approccio è sempre stato quello di applicarlo al miglior catalizzatore che potevamo trovare’, dice MacFarlane. Ogni volta che veniva pubblicato un articolo su un nuovo catalizzatore, cercavamo rapidamente di ripetere il lavoro in letteratura, per poi applicarlo nel nostro lavoro aprotico. Con una certa frustrazione, in alcuni casi dopo aver parlato con gli autori coinvolti, non siamo mai riusciti a far funzionare bene un catalizzatore della letteratura. Abbiamo finito per diventare esperti in ciò che non funziona.”
Anche se trasformare l’azoto in ammoniaca è molto difficile, è fin troppo facile produrre tracce di ammoniaca da altre fonti di azoto. La lunga lista di possibili fonti di azoto avventizio include l’elettrodo, o tracce di NO o NO2 nella fornitura di azoto gassoso. Eliminando o tenendo conto di queste fonti, la quantità di azoto che viene convertita in ammoniaca dalla maggior parte dei sistemi di catalizzatori è così bassa che non è di alcun interesse pratico, dice MacFarlane.
‘è stato un grande sostenitore di capire da dove l’ammoniaca viene effettivamente e se il catalizzatore sta davvero facendo il lavoro’, dice Lauren Greenlee dell’Università dell’Arkansas negli Stati Uniti, che è stato uno dei primi a lavorare sulla produzione elettrocatalitica di ammoniaca, e uno dei primi a sottolineare che l’ammoniaca accidentale era una preoccupazione importante. Convertire direttamente il dinitrogeno in due molecole di ammoniaca sulla superficie del catalizzatore è un problema molto difficile, e non so se siamo così vicini a risolverlo”.
Per ora, Greenlee si è allontanato dagli esperimenti di produzione di ammoniaca per condurre una ricerca più fondamentale sul problema. Ci siamo interessati alla chimica dell’elettrolita e stiamo lavorando per capire la chimica della superficie del catalizzatore e come cambia con questi elettroliti”, dice Greenlee.
Guardando al litio
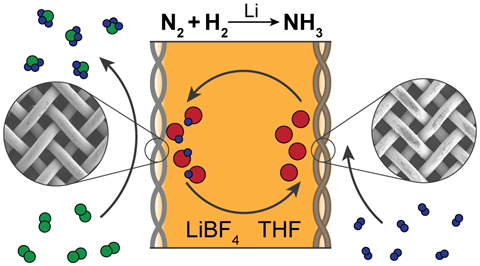
Come Greenlee e MacFarlane, Chorkendorff ha impostato i rigorosi esperimenti di controllo, compreso l’uso di dinitrogeno radiomarcato, necessari per dimostrare che l’ammoniaca prodotta proviene effettivamente dal dinitrogeno e non da una fonte alternativa di azoto. Abbiamo pubblicato un metodo, perché sono stufo di guardare tutti quei documenti che affermano che stanno facendo ammoniaca, perché non ne stanno facendo nessuna”, dice Chorkendorff. Conosco solo un sistema che sta facendo ammoniaca con certezza, e questo è il percorso mediato dal litio.’
Fonte: © Nikifar Lazouski et al/Springer Nature Limited 2020
I catalizzatori a base di litio sembrano essere il sistema migliore, come questo sviluppato dal gruppo di Karthish Manthiram al MIT
Il litio è l’unico metallo che può reagire spontaneamente con il dinitrogeno per formare un nitruro metallico – spezzando il triplo legame del dinitrogeno nel processo. La capacità del litio di generare ammoniaca è stata dimostrata da ricercatori giapponesi a metà degli anni ’90 – l’unico protocollo che Chorkendorff è stato in grado di riprodurre.
L’approccio all’ammoniaca mediato dal litio è attualmente l’unico che funziona senza ombra di dubbio, concorda MacFarlane. Lo svantaggio del litio è che comporta una pesante penalità di efficienza energetica, richiedendo un sovrapotenziale di più di 3V. Si tratta di un sacco di energia che sarà sprecata, persa come calore, ed è per questo che non è stato raccolto e sviluppato in precedenza”, dice MacFarlane.
Ma ciò che il protocollo ha a suo favore è il fatto che funziona sicuramente – e offre molte direzioni per la ricerca futura. L’approccio mediato dal litio è il nostro approccio principale al momento”, dice MacFarlane. Un modo ovvio per risolvere il problema dell’energia è quello di guardare ad altri metalli e ai loro nitruri metallici, che realizzerebbero questo processo ad un costo energetico più basso, un potenziale energetico meno negativo”, dice.
Nel laboratorio di Chorkendorff, l’attenzione è sulla comprensione di ciò che rende il litio efficace in primo luogo. Stiamo prima di tutto cercando di capire cosa si trova effettivamente su quella superficie per realizzare quel processo. Stiamo usando il sincrotrone di Stanford, cercando di costruire un modello per il processo.’
Un paio di anni fa, i tassi erano così bassi che non sapevamo nemmeno se stavamo facendo ammoniaca
Manthiram, nel frattempo, ha cercato modi per affrontare il problema di far reagire in modo efficiente i gas in una cella elettrochimica a base liquida. Abbiamo dimostrato come si potrebbe usare un elettrodo a diffusione di gas come mezzo per introdurre l’azoto gassoso in modo molto più efficace nel reattore, superare le limitazioni di trasporto, e quindi fare ammoniaca a tassi molto più veloci e con una maggiore selettività per fare ammoniaca rispetto all’idrogeno”, dice. Il team ha raggiunto una resa record di ammoniaca.
Finora, il reattore a diffusione di gas funziona solo per pochi minuti, e ad un sovrapotenziale estremo. Stanno un po’ forzando la cosa, ma nonostante gli svantaggi, mi piace molto questo documento”, dice Chorkendorff.
Il team – e il campo – ha il suo lavoro da fare per trasformare il processo in una soluzione pratica per la fertilizzazione delle colture, o per lo stoccaggio e il trasporto di energia rinnovabile, dice Manthiram. Ma quando ripensiamo a dove eravamo in questo campo un paio di anni fa, i tassi erano così bassi che non sapevamo nemmeno se stavamo facendo ammoniaca. Siamo finalmente al punto, penso che il nostro documento dimostri, che i tassi sono così alti che non c’è bisogno di fare un esperimento di controllo con azoto etichettato per dimostrare che l’ammoniaca è reale. Non c’è proprio modo che ci possa essere ammoniaca accidentale a quelle concentrazioni”. Anche se si affretta ad aggiungere che il team fa ancora gli esperimenti di controllo.
Per ora, il team sta sopportando il problema intrinseco dell’overpotenziale del litio. È il pedaggio che si deve pagare per percorrere questa strada, e siamo venuti a patti con il pagamento di questo prezzo, perché non c’è nessun altro sistema che possa funzionare anche nelle vicinanze dei tassi che abbiamo raggiunto con il litio”, dice Manthiram. Sarei sorpreso se nel prossimo decennio non emergessero altri metodi che non paghino questa pena”, aggiunge. Ma questo è il punto in cui si trova il campo in questo momento”.
James Mitchell Crow è uno scrittore scientifico di Melbourne, Australia