N-Bromosuccinimide (NBS) è un agente bromminante e ossidante che viene utilizzato come fonte di bromo in reazioni radicaliche (per esempio: brominazioni alliliche) e varie aggiunte elettrofile. La bromurazione NBS di substrati come alcoli e ammine, seguita dall’eliminazione di HBr in presenza di una base, porta ai prodotti di ossidazione netta in cui non è stato incorporato bromo.
Reazioni di nome
Reazione di Wohl-Ziegler
Letteratura recente

Una procedura efficiente e facile da usareè stata sviluppata per la deprotezione ossidativa di eteri tetraidropiranilici (THP) con N-bromosuccinimide (NBS) utilizzando β-ciclodestrina (β-CD) in acqua. Una serie di eteri tetraidropiranilici sono stati deprotetti ossidativamente a temperatura ambiente in rese impressionanti.
M. Narender, M. S. Reddy, K. R. Rao, Synthesis, 2004,1741-1743.

N-alcossiammidi permettono convenientemente i corrispondenti esteri carbossilici in presenza di NBS in toluene tramite omocoppiamento ossidativo e successiva denitrogenazione termica. Anche i substrati che recano un substituente ingombrante o a catena lunga hanno dato prodotti in buone rese in questo approccio conveniente ed economico per una trasformazione diretta di una parte alcossiammidica nel gruppo funzionale estere carbossilico.
N. Zhang, R. Yang, D. Zhang-Negrerie, Y. Du, K. Zhao, J. Org. Chem, 2013,78, 8705-8711.

Trasformazione diretta di etileni in ammidi aromatiche primarie con N-Bromosuccinimide e I2-Aqueous NH3
S. Shimokawa, Y. Kawagoe, K. Moriyama, H. Togo, Org. Lett, 2016, 18, 784-787.

Un’efficiente reazione chemioselettiva, priva di metalli e basi, di acidi boronici con radicali cianamidili/arilcianamidili fornisce ammine primarie aril-, eteroaril- e alchiliche a temperatura ambiente entro 1 h. La reazione è mediata da PIFA e NBS.
N. Chatterjee, M. Arfeen, P. V. Bharatam, A. Goswami, J. Org. Chem., 2016,81, 5120-5127.
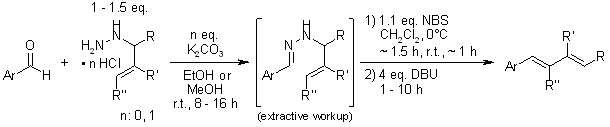
Una sintesi stereoselettiva di dieni da aldeidi e derivati di N-allilidrazina offre alti livelli di (E)-stereoselettività per una varietà di substrati. L’aggiunta di un dienofilo alla miscela di reazione permette una sequenza di sintesi-ciclicizzazione del diene in un unico contenitore.
D. A. Mundal, K. E. Lutz, R. J. Thomson, Org. Lett., 2009,11, 465-468.

Un’efficiente trasformazione one-pot di composti β-idrossicarbonilici a composti α-bromurati 1,3-dicarbonilici è ottenuta con MoO2Cl2 in presenza di N-bromosuccinimide. Tutte le reazioni sono state effettuate in condizioni blande e forniscono buone rese. Nessuna bromurazione si verifica in posizioni benziliche e alliliche.
K. Jeyakumar, D. K. Chand, Synthesis, 2009, 306-310.

K. Jeyakumar, D. K. Chand, Synthesis, 2009, 306-310.

Selettive oxyhalogenations di alchini sono state ottenute in acqua in condizioni molto delicate in presenza di reagenti alogenanti economici, come N-bromosuccinimide e N-clorosuccinimde, e FI-750-M come anfifilo. Non è stata rilevata alcuna alogenazione agli anelli aromatici. Il mezzo di reazione e il catalizzatore possono essere riciclati.
L. Finck, J. Brals, B. Pavuluri, F. Gallou, S. Handa, J. Org. Chem., 2018, 83, 7366-7372.

Un’alogenazione riduttiva catalizzata dall’ossido di trifenilfosfina di un chetone α,β-insaturo con triclorosilano come reagente riducente e un N-halosuccinimide come fonte di alogeni elettrofili consente una sintesi selettiva di α-haloketoni asimmetrici.
Z. Lao, H. Zhang, P. H. Toy, Org. Lett., 2019, 21, 8149-8152.

Reazioni di idroalluminazione affidabili, operativamente semplici, catalitiche α-selettive procedono in presenza di diisobutilalluminio idruro e (Ni(dppp)Cl2), e, a differenza delle trasformazioni non catalizzate, generano pochi o nessun sottoprodotto alchinilalluminio. Gli alogenuri α-vinilici derivati e i boronati possono essere sintetizzati attraverso il trattamento diretto con gli elettrofili appropriati.
F. Gao, A. H. Hoveyda, J. Am. Chem. Soc., 2010, 132, 10961-10963.

L’intrappolamento di una specie diazo in modo intermolecolare da due specie ioniche indipendenti in tandem al centro del carbene installa un elettrofilo e un nucleofilo sullo stesso carbonio. Questo concetto metal-free permette sintesi regioselettive di vari alogenuri vinilici, solfoni vinilici e derivati alchinici.
D. P. Ojha, K. R. Prabhu, Org. Lett., 2015,17, 18-21.

Composti insaturi come alcheni, alchini, alleni e metileneciclopropani (MCP) possono essere dibromurati in pochi minuti da NBS e bromuro di litio in THF a temperatura ambiente in rese da buone a eccellenti in condizioni blande.
L.-X. Shao, M. Shi, Synlett, 2006, 1269-1271.

L.-X. Shao, M. Shi, Synlett, 2006, 1269-1271.

L.-X. Shao, M. Shi, Synlett, 2006, 1269-1271.

L’uso della N-bromosuccinimmide permette una strategia one-pot metal-free per la sintesi di α-amino chetoni farmaceutici importanti da alcoli secondari benzilici e ammine facilmente disponibili. Questa reazione procede attraverso tre passi consecutivi che coinvolgono l’ossidazione degli alcoli, α-bromurazione dei chetoni e sostituzione nucleofila di α-bromo chetoni per dare α-amino chetoni.
S. Guha, V. Rajeshkumar, S. S. Kotha, G. Sekar, Org. Lett., 2015,17, 406-409.

Una combinazione di N-bromoimide e DBU consente reazioni di aminazione allilica di alcheni, in cui sia nucleofili azoto interno ed esterno può essere installato direttamente. La doppia attivazione di NBS o NBP da parte di DBU porta a più bromo elettrofilo e più atomi di azoto nucleofili contemporaneamente. Questo protocollo fornisce un accesso complementare all’aminazione allilica in condizioni miti.
Y. Wei, F. Liang, X. Zhang, Org. Lett., 2013,15, 5186-5189.

Un metodo conveniente ed efficiente per aminobromurazione di alchilideneciclopropani è riportato. Questo è esemplificato nella preparazione stereoselettiva di N–p-toluenesulfonamides utilizzando p-toluenesulfonamide e N-bromosuccinimide (NBS) come fonti di azoto e bromo, rispettivamente.
X. Huang, W.-J. Fu, Synthesis, 2006, 1016-1017.

In un protocollo a flusso continuo per la bromurazione di composti benzilici con solo un piccolo eccesso di N-bromosuccinimide, le reazioni radicali sono state attivate con una lampada fluorescente compatta (CFL) facilmente disponibile in casa utilizzando un semplice reattore a flusso basato su tubi di polimero etilene fluorato trasparente. Tutte le reazioni sono state eseguite usando l’acetonitrile come solvente, evitando così solventi clorurati pericolosi come il CCl4.
D. Cantillo, O. de Frutos, J. A. Rincon, C. Mateos, C. O. Kappe, J. Org. Chem., 2014,79, 223-229.

La base di Lewis Trip-SMe (Trip = triptycenyl) catalizza un’alogenazione elettrofila di composti aromatici non attivati utilizzando N-halosuccinimidi (NXS) a temperatura ambiente in presenza di AgSBF6 come fonte di un anione non coordinante. Il sistema π della funzionalità triptycenyl esercita un ruolo cruciale per l’aumento dell’elettrofilia.
Y. Nishii, M. Ikeda, Y. Hayashi, S. Kawauchi, M. Miura, J. Am. Chem. Soc., 2020, 142, 1621-1629.

Una bromurazione altamente regioselettiva di composti aromatici attivati è stata realizzata utilizzando N-bromosuccinimidein tetrabutilammonio bromuro. Predominantepara-selettiva monobromurazione di aromatici attivati, accelerazione del tasso per substrati meno reattivi su aggiunta di argilla montmorillonite acida K-10, con o senza assistenza microonde, sono le caratteristiche notevoli di questo protocollo.
N. C. Ganguly, P. De. S. Dutta, Synthesis, 2005, 1103-1108.

L’uso di un esafluoroisopropanolo come solvente permette un’alogenazione delicata e regioselettiva di una vasta gamma di arene ed eterocicli con N-halosuccinimidi in buone rese. Inoltre, la versatilità del metodo è dimostrata dallo sviluppo di dihalogenation sequenziale one-pot e reazioni di cross-coupling alogenazione-Suzuki.
R.-J. Tang, T. Milcent, B. Crousse, J. Org. Chem., 2018, 83, 930-938.

Un’alogenazione altamente para-selettiva di arene recanti gruppi coordinatori elettron-donanti in presenza di un sale di dimidazolio rpovide p-haloarenes in buone rese. Un meccanismo plausibile per la reazione catalitica è proposto.
J. Chen, X. Xiong, Z. Chen, J. Huang, Synlett, 2015, 26, 2831-2834.

Composti aromatici altamente disattivati sono stati agevolmente monobromurati mediante trattamento con N-bromosuccinimide (NBS) in acido solforico concentrato. Le condizioni di reazione miti e la semplice lavorazione forniscono un percorso pratico e commercialmente praticabile per la sintesi di composti bromo di aromatici disattivati in buone rese.
K. Rajesh, M. Somasundaram, R. Saiganesh, K. K. Balasubramanian, J. Org. Chem., 2007,72, 5867-5869.

N-Halosuccinimides sono efficacemente attivati in acido trifluorometansulfonico e BF3-H2O, permettendo le alogenazioni di aromatici disattivati. BF3-H2O è più economico, facile da preparare, non ossidante, e offre un’acidità sufficientemente alta.
G. K. S. Prakash, T. Mathew, D. Hoole, P. M. Esteves, Q. Wang, G. Rasul, G. A. Olah, J. Am. Chem. Soc., 2004,126, 15770-15776.

Aril ed eteroaril acidi boronici reagiscono con N-iodosuccinimide e N-bromosuccinimide per dare i corrispondenti iodo- e bromo-arene in buone o ottime rese. La reazione è solitamente altamente regioselettiva e produce solo il prodotto ipso-sostituito.
C. Thiebes, G. K. Surya Prakash, N. A. Petasis, G. A. Olah, Synlett, 1998, 141-142.

Una reazione di ortobromurazione e iodinazione ad alta resa, generale e pratica di diverse classi di composti aromatici avviene tramite la metodologia di attivazione del legame C-H catalizzata da Rh(III)
N. Schröder, J. Wencel-Delord, F. Glorius, J. Am. Chem. Soc., 2012, 134, 8298-8301.

Utilizzando ciano come gruppo direttivo, una reazione di orto-alogenazione catalizzata con palladio (I, Br, Cl) ha dato rese da buone a eccellenti. Il metodo è compatibile con arylnitriles con elettroni-ritiranti o gruppi elettron-donanti. Il presente metodo è stato applicato con successo alla sintesi dei precursori di paucifloral F e isopaucifloral F.
B. Du, X. Jiang, P. Sun, J. Org. Chem., 2013,78, 2786-2791.

Un protocollo efficiente per una sintesi one-pot altamente stereoselettiva di (E)-β-aril vinil ioduri e (E)-β-aril vinil bromuri da stirene si basa su un accoppiamento sililativo catalizzato da rutenio seguito da una reazione di alodesilazione mediata da N-halosuccinimide.
P. Pawluć, G. Hreczycho, J. Szudkowska, M. Kubicki, B. Marciniec, Org. Lett., 2009,11, 3390-3393.

Utilizzando la trietilammina come catalizzatore nelle reazioni di Hunsdiecker con N-halosuccinimidi come fonte Br+ o I+, gli acidi cinnamici e propiolici vengono convertiti nei corrispondenti α-halostyrenes e 1-halo-1-alkynes in buone rese isolate entro 1-5 min.
J. Prakash, S. Roy, J. Org. Chem., 2002, 67, 7861-7864.

J. Prakash, S. Roy, J. Org. Chem., 2002, 67, 7861-7864.

(E)-β-rylvinyl bromuri sono stati facilmente preparati in un breve tempo di reazione (1-2 min) per irradiazione a microonde dei corrispondenti acidi 3-arylpropenoic in presenza di N-bromosuccinimide e quantità acatalitica di acetato di litio.
C. Kuang, Q. Yang, H. Senboku, M. Tokuda, Synthesis, 2005,1319-1325.

Un’efficiente sintesi di aldeidi/chetoni α-iodo/bromo-α,β-insaturi direttamente da alcoli propargilici è catalizzata in collaborazione da Ph3PAuNTf2 e MoO2(acac)2, e Ph3PO come additivo aiuta a sopprimere la formazione indesiderata di enone/enale. Caratteristiche notevoli di questo metodo includono basse cariche di catalizzatore, condizioni di reazione mite, e soprattutto buona diastereoselettività.
L. Ye, L. Zhang, Org. Lett., 2009,11, 3646-3649.

Una iodinazione regio- e stereoselettiva, insieme ad alcuni esempi di bromurazione, di acrilammidi facilmente disponibili procede in condizioni blande attraverso un meccanismo di attivazione/alogenazione C-H catalizzato da Rh(III). La reazione rappresenta un raro esempio di un’alogenazione diretta dei derivati dell’acido acrilico elettronicamente poveri per accedere ad una varietà di derivati dell’acido Z-aloacrilico diversamente sostituiti.
N. Kuhl, N. Schröder, F. Glorius, Org. Lett., 2013,15, 3860-3863.

In una reazione a cascata NBS-promossa di addizione allilossile-riarrangiamento Claisen-deidrobrominazione, più di 20 alchinilsulfonamidi sostituiti sono stati fatti reagire con alcoli allilici per generare (2Z)-2,4-dienamidi in buone rese. Calcoli teorici hanno suggerito che un riarrangiamento sigmatropico essere il passo limitante del tasso.
R. Ding, Y. Li, C. Tao, B. Cheng, H. Zhai, Org. Lett., 2015,17, 3994-3997.

Una procedura one-step veloce e conveniente permette la conversione di composti carbonilici α,β-insaturi nei loro corrispondenti bromo-enoni a temperatura ambiente in condizioni molto miti in alte rese utilizzando NBS-Et3N – 3 HBr in presenza di carbonato di potassio in diclorometano.
D. Jyothi, S. HariPrasad, Synlett, 2009, 2309-2311.

Una delicata cianoimidazione one-pot di aldeidi utilizzando cianamide come fonte di azoto e NBS come ossidante è stata ottenuta in alte rese senza l’aggiunta di un catalizzatore. Successivamente, i prodotti sostituiti N-cianobenzimidato possono anche subire una reazione di ciclizzazione per dare derivati 1,2,4-triazolo in alte rese.
P. Yin, W.-B. Ma, Y. Chen, W.-C. Huang, Y. Deng, L. Egli, Org. Lett., 2009,11, 5482-5485.

Sm(OTf)3 è un catalizzatore efficace per un versatile ed efficiente alogeno-promosso altamente regio- e stereoselettivo Friedel-Crafts (F-C) alchilazione di arene ricche di elettroni con alcheni e composti carbonilici α,β-insaturi in presenza di NBS o I2 come fonti alogene.
S. Haira, B. Maji, S. Bar, Org. Lett., 2007,9, 2783-2786.

Una nuova reazione di difunzionalizzazione altamente regio- e stereoselettiva catalizzata dall’argento di semplici alchini terminali dà (Z)-β-alenolo acetato derivati in buone rese. I prodotti risultanti sono intermedi versatili nella sintesi organica.
Z. Chen, J. Li, H. Jiang, S. Zhu, Y. Li, C. Qi, Org. Lett., 2010,12, 3262-3265.

Una nuova procedura per aminobromurazione di olefine dà vicinale bromoamina derivati in alte rese utilizzando Cu, Mn, o V catalizzatori conp-toluensolfonamide come fonte di azoto e N-bromosuccinimide (NBS) come fonte di bromo. Eccellente regio- e stereoselettività è mostrato per diversi substrati olefinici così come catalizzatori di metallo di transizione. V. Thakur, S. K. Talluri, A. Sudalai, Org. Lett., 2003,5, 861-864.

Una conveniente ed efficiente aminobromurazione catalizzata da ferro di alcheni è stata sviluppata utilizzando FeCl2 economico come catalizzatore, ammidi/sulfonamidi e NBS come fonti di azoto e bromo, rispettivamente, in condizioni delicate.
Z. Wang, Y. Zhang, H. Fu, Y. Jiang, Y. Zhao, Synlett, 2008, 2667-2668.

In una bromoidazione efficiente, senza catalizzatore e senza metallo di olefine non attivate, 4-(trifluoromethyl)benzenesulfonamide e N-bromosuccinimide sono stati usati come fonti di azoto e alogeni, rispettivamente. La metodologia è applicabile sia alle olefine cicliche che a quelle alifatiche.
W. Z. Yu, F. Chen, Y. A. Cheng, Y.-Y. Yeung, J. Org. Chem., 2015,80, 2815-2821.

Un’efficiente reazione di cross-coupling radicale senza catalizzatore tra aldeidi aromatiche e sulfoximine ha avuto luogo in presenza di N-bromosuccinimide come iniziatore radicale sotto irradiazione a microonde per permettere le corrispondenti sulfoximine acilate in buone rese.
K. K. Rajbongshi, S. Ambala, T. Govender, H. G. Kruger, P. I. Arvidsson, T. Naicker, Synthesis, 2020, 52, 1279-1286.

Una nuova reazione elettrofila one-pot di un’olefina, una cianimide, un’ammina e N-bromosuccinimide permette la sintesi di una serie di derivati della guanidina con ottime rese – incluso un precursore rTRTVI.
L. Zhou, J. Chen, J. Zhou, Y.-Y. Yeung, Org. Lett., 2011,13, 5804-5807.

Un’arilazione e vinilazione stereoselettiva di alcheni senza catalizzatori a metalli di transizione avviene attraverso un interessante riarrangiamento semipinacolo promosso dall’NBS in condizioni blande e una successiva insolita frammentazione Grob mediata da NaOH.
D.-Y. Yuan, Y.-Q. Tu, C.-A. Fan, J. Org. Chem., 2008,73, 7797-7799.

Un nuovo cationico Br avviato one-pot sintesi utilizzando olefina, nitrile, ammina, e N-bromosuccinimide dà imidazoline in buone rese. I substrati olefinici e i partner nitrile può essere variato in modo flessibile per ottenere una gamma di derivati imidazoline.
L. Zhou, J. Zhou, C. K. Tan, J. Chen, Y.-Y. Yeung, Org. Lett., 2011,13, 2448-2451.

Una sintesi diretta mediata da N-bromosuccinimide di 2,5-diariloxazoli a partire da N-H chetoaziridine procede attraverso la formazione in situ di N-bromoketoaziridine seguita dalla generazione di azometilidi.
H. S. Samimi, F. Dadvar, Synthesis, 2015, 47, 1899-1904.

3-Oxazoline-4-carbossilati come intermedi sintetici facilmente disponibili possono essere ossidati per produrre oxazole-4-carbossilati. Inoltre, la derivatizzazione di 3-oxazoline-4-carbossilati con reagenti di Grignard permette una facile preparazione di derivati 4-keto-oxazoli.
K. Murai, Y. Takahara, T. Matsushita, H. Komatsu, H. Fujioka, Org. Lett., 2010,12, 3456-3459.

2-Amino-4-alchil- e 2-amino-4-aril-tiazolo-5-carbossilati e i loro analoghi selenazolici sono stati sintetizzati mediante α-alogenazione di esteri β-cheto con N-bromosuccinimide, seguita da ciclizzazione con tiourea o selenourea, rispettivamente, in presenza di β-ciclodestrina in acqua a 50°C.
M. Narender, M. S. Reddy, V. P. Kumar, B. Srinivas, R. Sridhar, Y. V. D. Nageswar, K. R. Rao, Synthesis, 2007, 3469-3472.
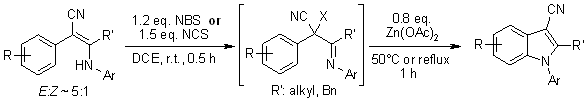
Vari 2-aril-3-arilammino-2-alchenitrili danno N-arilindolo-3-carbonitrili in modo one-pot attraverso alogenazione mediata da NBS o NCS seguita da ciclizzazione intramolecolare catalizzata da Zn(OAc)2. Il processo comporta la formazione di intermedi di ioni arilnitrenium, che subiscono una sostituzione aromatica elettrofila per dare il N-arilindoli ciclizzati.
Q. Yan, J. Luo, D. Zhang-Negrerie, H. Li, X. Qi, K. Zhao, J. Org. Chem., 2011,76, 8690-8697.

i solfossidi di butile possono essere usati come fonti di solfinile in una sulfinilazione intramolecolare di sulfonamidi seguita da un processo Wittig-equivalente a tutti gli eteroatomi per permettersi arilisotiazoli in alte rese.
F. Xu, Y. Chen, E. Fan, Z. Sun, Org. Lett., 2016, 18, 2777-2779.

Una ciclizzazione alogenativa senza catalizzatore di N-aril diazoamidi con N-halosuccinimidi (NXS) fornisce 3-halooxindoli in buone rese attraverso un meccanismo senza carbeni in condizioni miti e senza catalizzatore. Questa trasformazione è proposto di procedere attraverso la formazione di ioni diazonio seguita da intramolecolare Friedel-Crafts alchilazione.
C. Ma, D. Xing, W. Hu, Org. Lett., 2016, 18, 3134-3137.

Nuova metodologia per la sintesi di 2-oxazoline variamente sostituite e una diidrooxazine utilizzando aldeidi, amino alcoli, e N-bromosuccinimide come agente ossidante è descritto. Questa sintesi one-pot è caratterizzata da condizioni di reazione mite, ampia portata, alte rese, e la sua semplicità preparativa.
K. Schwekendiek, F. Glorius, Synthesis, 2006, 2996-3002.

Una ciclizzazione catalizzata dall’oro di intermedi β-amino-ionici e un processo di alodeaurazione permette una rapida ed efficiente sintesi one-step di alopiridone.
K. H. Nguyen, S. Tomasi, M. Le Roch, L. Toupet, J. Renault, P. Uriac, N. Gouault, J. Org. Chem., 2013,78, 7809-7815.

Una reazione one-pot catalizzata da Zn(OTf)2 versatile e altamente efficiente di alcheni, NBS, nitrili e TMSN3 dà vari tetrazoli 1,5-disostituiti contenenti un’ulteriore funzionalità α-bromo del sostituente N1-alchile.
S. Hajra, D. Sinha, M. Bhowmick, J. Org. Chem., 2007,72, 1852-1855.

Si descrive una sintesi one-pot di solfoni arilici da alcoli primari. Gli alcoli sono stati trattati con N-bromosuccinimide e trifenilfosfina, seguita da aggiunta di arenesulfinato di sodio con una quantità catalitica di ioduro di tetrabutilammonio per permettersi i solfoni arilici in buona ad alta resa.
T. Murakami, K. Furusawa, Synthesis,2002, 479-482.

I solfossidi con un gruppo terz-butilico possono essere attivati usando N-bromosuccinimide (NBS) in condizioni acide. Il successivo trattamento con vari nucleofili di azoto, carbonio o ossigeno permette un’ampia gamma di ammidi di acido solfinico, nuovi solfossidi ed esteri di acido solfinico.
J. Wei, Z. Sun, Org. Lett., 2015,17, 5396-5399.

Il cianuro media una generazione in situ di uno ione nucleofilo solfato da solfoni vinilici. La successiva S-alchilazione in situ fornisce solfoni in alte rese. In presenza di N-bromosuccinimide, ammine primarie e secondarie subiscono la formazione di sulfonamide.
T. Roy, J.-W. Lee, Synlett, 2020, 31, 455-458.

I tiosolfonati sintetizzati dalla dimerizzazione aerobica catalizzata dal rame servono come substrato per strategie semplici e ad alta resa per la produzione di una varietà di sulfoni e sulfonamidi. I tiosolfonati sono alternative stabili e non tossiche ai sali di solfato di metallo derivati dalla tossica SO2.
P. K. Shyam, H.-Y. Jang, J. Org. Chem., 2017, 82, 1761-1767.

La sintesi di N-cianosulfilimine può essere facilmente ottenuta per reazione dei corrispondenti solfuri con ammina cianogena in presenza di una base e NBS o I2 come agenti alogenanti. L’ossidazione seguita dalla decanazione permette di ottenere sulfoximine sinteticamente utili.
O. García Mancheño, O. Bistri, C. Bolm, Org. Lett., 2007,9, 3809-3811.

In una trasformazione a cascata one-pot di chetoni in α-imidoketoni, la N-bromosuccinimide (NBS) fornisce sia bromo elettrofilo che fonti di azoto nucleofile, e il diazabicycloundec-7-ene (DBU) funziona come base e promotore nucleofilo per l’attivazione della NBS. L’α-bromurazione è supposta come il passo chiave del processo.
Y. Wei, S. Lin, F. Liang, Org. Lett., 2012,14, 4202-4205.