INTRODUZIONE
La stenosi valvolare aortica è la valvulopatia acquisita più comune e quella che più spesso richiede un intervento di sostituzione valvolare nel nostro ambiente.1 Per questi pazienti, la valutazione ecocardiografica transtoracica (TTE) bidimensionale e l’ecocardiografia Doppler svolgono un ruolo importante nel determinare la gravità della cardiopatia valvolare, la sua gestione e la prognosi.2
Durante la valutazione ecocardiografica, è normale incontrare un’area della valvola aortica (AVA)
cm2 con bassi gradienti transvalvolari nonostante la frazione di eiezione conservata.3 L’impatto prognostico di questa entità non è ben definito. Alcuni studi hanno suggerito che questo pattern ecocardiografico è associato a una prognosi peggiore.4,5 Tuttavia, un recente studio prospettico riporta che questa entità può avere una prognosi simile a quella della stenosi aortica, migliore di quella precedentemente riportata, il che suggerisce una classificazione errata della gravità della stenosi della valvola aortica utilizzando i metodi diagnostici abituali.6
Le tecniche di ecocardiografia tridimensionale (3D) si sono dimostrate utili nella diagnosi di stenosi aortica7 e nel monitoraggio del suo trattamento.8 È stato inoltre dimostrato che la valutazione di AVA attraverso la planimetria con l’ecocardiografia transesofagea 3D (3D-TOE) è fattibile. I risultati sono stati coerenti con le misure calcolate utilizzando la TTE.9 La planimetria valvolare con 3D-TOE potrebbe essere un utile strumento diagnostico per controllare la gravità della valvulopatia aortica quando lo studio transtoracico mostra discrepanza tra l’AVA stimata dall’equazione di continuità e i gradienti ottenuti dall’ecocardiografia Doppler.
L’obiettivo di questo studio è stato quello di valutare la concordanza tra l’AVA ottenuta dall’equazione di continuità con TTE e quella ottenuta dalla planimetria 3D-TOE in pazienti con stenosi aortica grave e basso gradiente con funzione ventricolare normale, al fine di stabilire l’esistenza di questa malattia.
METHODDesign, pazienti e considerazioni etiche
Studio descrittivo e trasversale di pazienti consecutivi trasferiti a un centro di riferimento tra settembre 2009 e giugno 2012 per la valutazione della stenosi aortica. Sono stati selezionati pazienti con stenosi aortica grave, definita come AVA
cm2. Da questo campione di pazienti, abbiamo selezionato quelli che presentavano gradiente aortico medio mmHg e frazione di eiezione ventricolare sinistra≥50%. Il protocollo dello studio è stato rivisto e approvato dal comitato di etica della ricerca clinica del centro il 27 luglio 2009. Il consenso informato è stato ottenuto da tutti i pazienti.Ecocardiografia transtoracica
TTE è stata eseguita con apparecchiature ad ultrasuoni iE33 (Philips Medical Systems; Andover, Massachusetts, Stati Uniti) con una sonda settoriale S5-2 (larghezza di banda 5 a 1 MHZ). Cardiologi esperti hanno condotto uno studio standardizzato seguendo le raccomandazioni attuali,10 utilizzando tutte le viste (apicale, subcostale, soprasternale e parasternale destra) per ottenere la massima velocità transvalvolare. Le misurazioni della pressione sanguigna sono state registrate durante lo studio. Le immagini ottenute sono state memorizzate ed elaborate con un sistema specializzato per la gestione delle immagini (Xcelera, Philips Medical Systems) e l’AVA è stata calcolata mediante l’equazione di continuità.10 Le ostruzioni ventricolo-arteriose sono state calcolate secondo il metodo descritto da Briand et al.11
Ecocardiografia transesofagea tridimensionale
Lo stesso giorno della TTE standard, anche la TOE è stata eseguita in tutti i pazienti da un ecografista in cieco ai risultati dello studio transtoracico. La sedazione con propofol è stata impiegata a discrezione dell’ecografista.
La pressione sanguigna è stata monitorata e registrata durante la procedura. Il 3D-TOE è stato eseguito con un’apparecchiatura a ultrasuoni iE33 (Philips Medical Systems) con un trasduttore X7-2t. Sono state ottenute immagini in tempo reale (Live 3D®) del volume piramidale della valvola aortica e del tratto di efflusso ventricolare sinistro (LVOT). L’angolo e la profondità dell’area esplorata sono stati ridotti per ottenere una frequenza di acquisizione superiore a 20Hz. Le immagini ottenute sono state centrate nella valvola aortica da una vista ad asse corto tra 30° e 45°, guidata dalla modalità biplanare (x-Plane®) in modo da ottenere l’apertura della valvola a livello delle cuspidi della valvola (Fig. 1). In ogni paziente sono stati registrati 3 cicli cardiaci.

Risultati elaborati con Q-Lab® dell’immagine della valvola aortica ottenuta con il metodo Live 3D®. I pannelli A, B e C mostrano la ricostruzione multiplanare. Il pannello A contiene il piano trasversale a livello delle cuspidi aortiche dove abbiamo eseguito la planimetria dell’area della valvola aortica (in questo caso 0,45 cm2). Pannello B mostra il piano longitudinale utilizzato per selezionare il piano trasversale nelle cuspidi della valvola. Il pannello D mostra un’immagine tridimensionale di una valvola aortica bicuspide con un rafe fibroso nella cuspide anteriore. Su questa immagine abbiamo selezionato il fotogramma in cui è visibile la massima apertura della valvola.
Il post-processing delle immagini è stato effettuato su una stazione di lavoro Xcelera utilizzando il software Q-Lab® (Philips Medical Systems). Questo software di gestione delle immagini permette la ricostruzione di qualsiasi finestra precedentemente ottenuta del volume piramidale. Sull’immagine 3D abbiamo selezionato la fase del ciclo cardiaco in cui l’apertura della valvola era massima. Su questa cornice, la ricostruzione multiplanare è stato fatto per ottenere una vista perpendicolare alla valvola aortica semilunare, riorientato come necessario per visualizzare la zona di apertura della valvola a livello delle cuspidi della valvola (Fig. 1). Allo stesso modo, la planimetria dell’area LVOT è stata eseguita e inclusa nell’equazione di continuità per calcolare l’AVA utilizzando un approccio misto: 3D-TOE per l’LVOT e TTE per i flussi.
L’elaborazione dei dati e l’analisi statistica
I calcoli sono stati eseguiti dopo 3 cicli cardiaci (5 cicli non estremi se il paziente era in fibrillazione atriale). Tutte le misurazioni e i calcoli sono stati eseguiti in cieco e in doppio, da due diversi ecocardiografi.
La distribuzione normale delle variabili continue è stata valutata utilizzando il test di Kolmogorov-Smirnov (correzione Lilliefors). Le variabili sono espresse come proporzioni, media (deviazione standard) o come mediana, come appropriato in ogni caso. I confronti tra stimatori centrali sono stati eseguiti utilizzando il test t di Student o il test chi-quadro. L’affidabilità delle misurazioni è stata valutata mediante il coefficiente di correlazione intraclasse12 e il plot di Bland-Altman.13 Il coefficiente Kappa è stato utilizzato per confrontare la classificazione della gravità della stenosi valvolare mediante i metodi studiati. Le differenze sono state considerate statisticamente significative quando il valore bilaterale era P14
RESULTS
Tra le date specificate, abbiamo valutato 240 pazienti con stenosi aortica nel nostro laboratorio, di cui 212 avevano un AVA aortico
cm2. Di questi pazienti, 63 (29,7%) soddisfacevano i criteri di stenosi valvolare aortica grave con basso gradiente e funzione ventricolare normale (Fig. 2). Non siamo stati in grado di eseguire la planimetria 3D-TOE in 2 pazienti a causa di un’estesa calcificazione della valvola che ci ha impedito di identificare correttamente l’area di apertura della valvola. Pertanto, la nostra popolazione finale consisteva di 61 pazienti le cui caratteristiche sono riportate nella Tabella 1.
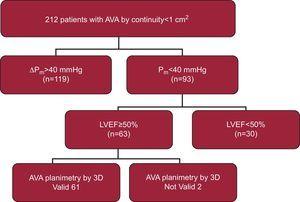
Diagramma del flusso dei pazienti. Partendo da 240 pazienti valutati, 212 pazienti con stenosi aortica grave sono stati selezionati nello studio transtoracico. Infine, 61 pazienti sono rimasti come partecipanti al nostro studio. AVA, area della valvola aortica; LVEF, frazione di eiezione ventricolare sinistra; ΔPm, gradiente aortico medio.
Caratteristiche di tutti i 61 pazienti nello studio.
| Femmina | 29 (47.5) |
| Età, anni | 77.2±8.72 |
| BSA, m2 | 1,76±0,17 |
| Pazienti in FA | 22 (36,1) |
| frequenza cardiaca, bpm | 73.6±16.6 |
| SBP, mmHg* | 135.1±24.6 |
| DBP, mmHg* | 71.9±12.8 |
| LVEF, %* | 62.82±6.98 |
| VTI1, cm* | 19.87±6.17 |
| Indice di volume sistolico, mL/m2* | 32,5±9,9 |
| Gradiente aortico massimo, mmHg* | 50.14±13,40 |
| Gradiente aortico medio, mmHg* | 29,3±7.2 |
| Diametro LVOT, TTE, mm* | 19.4±2.3 |
| Area LVOT, TTE, cm2* | 2.99±0.71 |
| Area LVOT, 3D-TOE, cm2* | 3.40±0.97 |
| AVA TTE, cm2* | 0.74±0,16 |
| AVA 3D-TOE, cm2* | 0,75±0,20 |
| Z, mmHg/mL/m2* | 5,40±1.83 |
3D-TOE, ecocardiografia transesofagea tridimensionale; AF, fibrillazione atriale; AVA, area della valvola aortica; BSA, superficie corporea; DBP, pressione sanguigna diastolica; LVEF, frazione di eiezione ventricolare sinistra; LVOT, tratto di efflusso ventricolare sinistro; SBP, pressione sanguigna sistolica; TTE, ecocardiografia transtoracica; VTI1: integrale della velocità-tempo prevalvolare; Z, impedenza arteriosa ventricolare.
I dati sono espressi come n. (%) o media±deviazione standard.
Misurato durante 3D-TOE.
Studio di concordanza
La planimetria AVA mediante ricostruzione 3D-TOE ha confermato la presenza di stenosi grave (AVA
cm2) in 52 casi (85,2%). Il coefficiente di correlazione intraclasse tra TTE e 3D-TOE era 0,505 (intervallo di confidenza al 95%, 0,290-0,671; PFigura 3. La differenza media tra i due metodi era 0.003cm2, con la misurazione 3D-TOE era leggermente superiore (95%CI, -0.353 a 0.359).
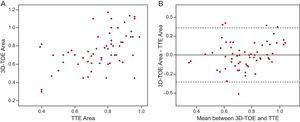
A: dispersione grafica delle misure dell’area della valvola aortica attraverso l’ecocardiografia transesofagea tridimensionale e l’ecocardiografia transtoracica. B: grafico Bland-Altman13 che mostra la concordanza delle misure dell’area della valvola aortica con l’ecocardiografia transesofagea tridimensionale e l’ecocardiografia transtoracica. La differenza media tra i 2 metodi era y-x=0,003 (intervallo di confidenza al 95%, da -0,353 a 0,359). 3D-TOE, ecocardiografia transesofagea tridimensionale; TTE, ecocardiografia transtoracica.
In 9 pazienti (14,7%), la valutazione dell’AVA mediante 3D-TOE ha rivelato dimensioni maggiori di 1cm2. Questi pazienti avevano una superficie corporea maggiore. Solo uno di loro aveva fibrillazione atriale e aveva LV e LVOT più grandi rispetto ai pazienti con la classificazione corretta. Anche l’AVA in TTE era maggiore di quella dei pazienti classificati correttamente. Un confronto delle variabili analizzate è mostrato nella Tabella 2.
Differenze tra i pazienti secondo l’accordo dei due metodi nella classificazione della gravità aortica.
| Classificazione concordante (n=52) | Classificazione discordante (n=9) | P | ||
| Età, anni | 77.9±8.5 | 73.1±8.9 | .125 | |
| Maschio | 23 (44,2) | 9 (100) | .001* | |
| BSA, m2 | 1.74±0,16 | 1,90±0,18 | .024 | |
| Pazienti in FA | 21 (40,3) | 1 (11,1) | .090* | |
| Uso di sedativo | 34 (65,4) | 5 (55,5) | .138* | |
| Tdd LV, mm | 41,9±5.4 | 51.6±9.3 | ||
| Tdv LV, mL | 67.4±25.5 | 103.8±36.1 | ||
| LVEF, % | 63.2±6.6 | 60.5±8.6 | .296 | |
| LVOTD | 19.1±2.1 | 21.8±2.2 | .001 | |
| SVI, mL/m2 | 31.6±9.8 | 38.3±9.8 | .065 | |
| GRAdiente medio, mmHg | 29.2±7.4 | 29.8±5.8 | .811 | |
| AVA TTE, cm2 | 0.72±0.16 | 0.86±0.08 | .024 | |
| AVA 3D-TOE, cm2 | 0,69±0,15 | 1,08±0,05 | ||
| Z, mmHg/mL/m2 | 5,50±1.90 | 4.46±0.63 | .194 |
3D-TOE, ecocardiografia transesofagea tridimensionale; AF, fibrillazione atriale; AVA, area della valvola aortica; BSA, superficie corporea; LV, ventricolo sinistro; LVEF, frazione di eiezione ventricolare sinistra; LVOTD, diametro del tratto di efflusso ventricolare sinistro; SVI, indice di volume sistolico; Tdd, diametro telediastolico; Tdv, volume teledistolico; TTE, ecocardiografia transtoracica; Z, impedenza arteriosa ventricolare.
I dati sono espressi come no. (%) o media±deviazione standard.
I confronti sono stati effettuati tramite il test t di Student e il test chi-quadro.
Quando abbiamo usato l’area LVOT ottenuta da 3D-TOE nell’equazione di continuità, l’AVA ottenuta era>1cm2 in 9 casi, che sono stati riclassificati come stenosi moderate. Tuttavia, il coefficiente Kappa di accordo tra il 3D-TOE e la valutazione con metodo misto ha raggiunto solo lo 0,28.
Discussione
Questo studio descrittivo mostra che la stenosi aortica grave paradossale a basso gradiente presente nel 30% dei partecipanti al nostro studio è un’entità reale. È stata confermata come tale nell’85,2% dei pazienti valutati dalla planimetria 3D-TOE. In studi precedenti, la planimetria di AVA utilizzando immagini 3D-TOE ha anche confermato l’esistenza di veri casi di stenosi aortica secondo i criteri anatomici.2,10
Concordanza
Il coefficiente di correlazione intraclasse è uno strumento utile per valutare l’accordo tra diversi metodi di misurazione o osservatori, basato su un modello di analisi della varianza utilizzando misure ripetute.12 Nel nostro studio, la concordanza tra TTE e 3D-TOE è moderata, con un coefficiente di correlazione intraclasse inferiore a quello precedentemente riportato in uno studio su pazienti con stenosi aortica.9 Attribuiamo questo tasso inferiore di accordo al nostro campione appositamente selezionato. I pazienti del nostro studio sono quelli che per molti autori solleverebbero dubbi sull’accuratezza delle misurazioni effettuate con la TTE.7,15,16 L’inclusione di alcuni pazienti con AVA sottostimata dalla TTE (15% nella nostra serie) rende i risultati inferiori a quelli riportati in una popolazione meno selettiva.9
D’altra parte, otteniamo l’area anatomica della valvola tramite planimetria mentre l’equazione di continuità calcola l’area effettiva della valvola.7 È stato descritto che l’area anatomica mostra valori superiori a quelli stimati dall’equazione di continuità, in particolare nei casi con valvole degenerative, piatte, senza bulging, simili a quelli della maggior parte della nostra popolazione di studio.17 I nostri risultati, tuttavia, non mostrano differenze significative tra i due metodi. Nell’analisi del Bland-Altman plot la differenza media nelle stime era quasi la stessa, anche se la misurazione 3D-TOE era leggermente più alta, 0,003cm2 (95%CI, -0,353 a 0,359).
Gruppo sclassificato
La gravità della valvola colpita non è stata confermata dalla planimetria 3D-TOE in 9 dei pazienti che abbiamo valutato. Consideriamo questo un numero insufficiente di casi per stabilire le cause dell’errore di classificazione. Tuttavia, questi pazienti avevano misure di superficie corporea, LV e LVOT più grandi. Solo uno di loro aveva fibrillazione atriale e l’indice di volume endosistolico era leggermente più alto, anche se non raggiungeva la significatività statistica rispetto al gruppo concordante. La maggior parte di questi pazienti presentava un’AVA da TTE>0,8cm2. Come mostrato nella Figura 3, solo un paziente con 0,75cm2 di AVA su TTE ha poi presentato un AVA>1cm2 su 3D-TOE. Questo è sicuramente un gruppo di pazienti con stenosi valvolare al limite della gravità.
I potenziali errori nella misurazione dell’LVOT sono noti nelle linee guida per la quantificazione della valvulopatia10 e sono sospettati di essere responsabili di errori di classificazione in alcuni studi.6 Dato che la morfologia del LVOT non è circolare, è stato promosso l’uso di altri metodi come la stima 3D-TOE dell’area del LVOT per migliorare l’affidabilità della misurazione7 e contribuire ad evitare risultati insoddisfacenti del trattamento.18 Nel nostro studio, l’utilizzo dell’area del LVOT valutata dal 3D-TOE ci ha permesso di riclassificare alcuni pazienti a livello moderato che avevano AVA>1cm2. Tuttavia, i pazienti sono stati anche erroneamente classificati utilizzando i risultati 3D-TOE, quindi il coefficiente Kappa non era molto buono (0,28).
A causa del disegno dei criteri di inclusione, il gruppo di pazienti erroneamente classificati può solo rappresentare i casi in cui il grado di gravità della stenosi aortica diminuisce. Pertanto, trarre conclusioni da questo gruppo sarebbe molto suscettibile al fenomeno della regressione verso la media,19 come abbiamo riconosciuto.
Limitazioni
Questo studio non ha un criterio di riferimento per la stima di AVA. Lo standard clinico è la TTE con l’equazione di continuità2,10 ma il fenomeno di incoerenza di questo metodo3 è proprio quello che abbiamo cercato di indagare. Abbiamo optato per una metodologia fattibile che quantifica l’AVA utilizzando una strategia di Doppler indipendente e misurazioni LVOT. Tuttavia, 3D-TOE ha importanti limitazioni tra cui la sua risoluzione spaziale e temporale. Con una frequenza di acquisizione di 20Hz e frequenza cardiaca intorno 70 bpm, può ottenere tra 6 e 7 immagini durante la sistole cardiaca. In generale, il 5° o 6° fotogramma è quello in cui si cattura la massima apertura valvolare. È anche possibile, in alcuni casi, non ottenere l’immagine della massima apertura valvolare.
La sedazione con propofol ci permette di esplorare a fondo e permette al paziente di essere più comodo. Sebbene siano stati menzionati gli effetti del propofol sulla contrattilità e sulla tensione arteriosa,20 questi non sembrano aver influenzato i nostri risultati perché quando i pazienti di entrambi i gruppi sono stati riclassificati non ci sono state differenze legate al suo uso. Inoltre, consideriamo di grande importanza il controllo della frequenza cardiaca e la possibilità di un esame approfondito; pertanto, in caso di dubbio preferiamo l’aiuto fornito dal sedativo.
In alcuni pazienti la presenza di estese calcificazioni, soprattutto quelle situate nella faccia posteriore della radice o sulla cuspide posteriore, ci impediscono di valutare l’apertura. Questo si è verificato solo in due pazienti.
Anche se l’inclusione dei pazienti è stata consecutiva, un bias di rinvio è possibile perché abbiamo incluso solo pazienti con stenosi grave precedente. Questo significa che il campione potrebbe non rappresentare la popolazione generale. I diversi criteri di inclusione utilizzati dai diversi autori possono spiegare le differenze nella prevalenza della stenosi grave a basso gradiente paradossale riportata in letteratura.
CONCLUSIONI
La stenosi aortica grave nonostante un basso gradiente paradossale è un’entità reale confermata nell’85% dei casi valutati tramite 3D-TOE. Uno studio più approfondito dei casi con discrepanze è necessario per scoprire le ragioni della loro errata classificazione.
CONFLITTI DI INTERESSE
Nessuno dichiarato.