La motilità è la capacità di un organismo di muoversi da solo per mezzo di flagelli ad elica unici per i batteri o di speciali fibrille che producono una forma di motilità scivolosa. I batteri mobili si muovono usando i flagelli, appendici locomotorie simili a fili che si estendono verso l’esterno della membrana plasmatica e della parete cellulare, sia con un singolo flagello che con flagelli multipli. La motilità è stata a lungo riconosciuta come un importante strumento tassonomico e caratteristica biologica dei microrganismi. La presenza di flagelli si verifica principalmente nei bacilli, ma ci sono alcuni cocchi flagellati, quindi la motilità è un mezzo molto importante di identificazione nella famiglia delle Enterobacteriaceae. Fin dai primi giorni nel campo della microbiologia, la capacità dei batteri di muoversi è stata usata come mezzo di differenziazione e classificazione degli organismi.
Obiettivo
- Determinare la motilità del batterio.
- Definire tra batteri mobili e non mobili.
Principio
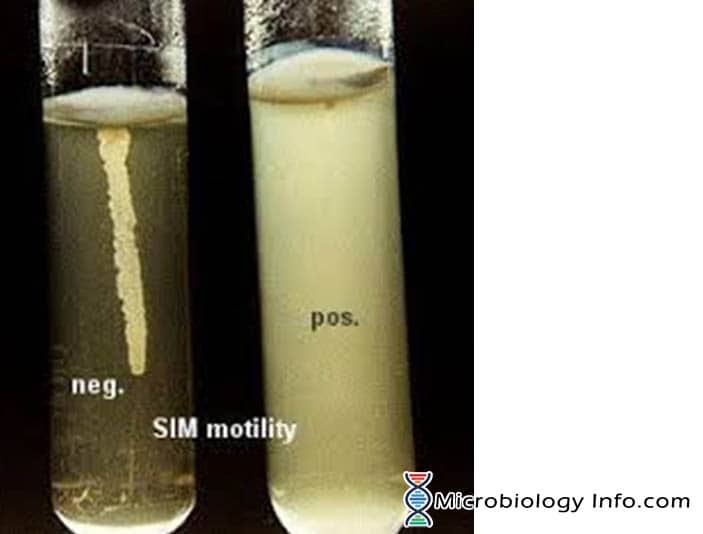
La motilità del batterio è dimostrata principalmente in un mezzo di agar semi solido. Il mezzo utilizzato principalmente per questo scopo è il SIM medium (Sulphide Indole Motility medium) che è un mezzo differenziale combinato che testa tre diversi parametri: riduzione dello zolfo, produzione di indolo e motilità. Questo terreno ha una consistenza molto morbida che permette ai batteri mobili di migrare facilmente attraverso di esso causando torbidità. L’inoculo viene infilzato nel centro di un agar semisolido in profondità. La motilità batterica è evidente da una zona diffusa di crescita che si estende dalla linea di inoculazione. Alcuni organismi crescono in tutto il terreno, mentre altri mostrano piccole aree o noduli che si estendono dalla linea di inoculazione. I batteri non mobili cresceranno solo nella provetta di agar morbido e solo nell’area in cui sono stati inoculati.
Media:
SIM Medium
Digesto pancreatico di caseina 20.0g, Digest peptico di tessuto animale 6.1g, Agar 3.5g, Fe(NH4)2(SO4)2-6H2O 0.2g, Na2S2O3-5H2O 0.2g, pH 7.3 ± 0.2 a 25°C
Metodo
- Punta un ago dritto su una colonia di una cultura giovane (da 18 a 24 ore) che cresce su agar. Assicurati di mantenere l’ago nella stessa linea in cui è entrato quando viene rimosso dal mezzo.
- Incubare a 35°-37°C ed esaminare ogni giorno per un massimo di 7 giorni.
- Osservare una zona diffusa di crescita che si allarga dalla linea di inoculazione.
Risultati attesi
- Positivo: Crescite diffuse e vaporose che si diffondono in tutto il mezzo rendendolo leggermente opaco.
- Negativo: Crescita che è confinata alla stab-line, con margini ben definiti e che lascia il mezzo circostante chiaramente trasparente.
Usi
- È utilizzato per la differenziazione dei microrganismi sulla base della motilità in un ambiente di laboratorio.
- Si esegue per assegnare la classificazione tassonomica agli organismi.
- I test di motilità sono importanti nella caratterizzazione degli agenti patogeni.
- I test sono spesso impiegati nei protocolli di identificazione nella famiglia delle Enterobacteriaceae
- Il test di motilità è utilizzato anche per la differenziazione di specie di cocchi gram positivi, Enterococci. Enterococcus faecium ed E. faecalis non sono mobili, mentre E. gallinarum ed E. casseliflavus/E. flavescens sono generalmente mobili.
Limitazioni
- Alcuni organismi non mostrano una crescita sufficiente in questo terreno per una determinazione accurata e sono necessari ulteriori test di controllo.
- Si raccomanda di eseguire test biochimici, immunologici, molecolari o di spettrometria di massa su colonie di coltura pura per un’identificazione completa.
- Reazioni falso-negative possono verificarsi se i flagelli batterici sono danneggiati a causa di riscaldamento, agitazione o altri traumi. Tale shock ambientale renderà l’organismo non mobile.
- Gli organismi che sono debolmente mobili possono provocare reazioni falso-negative.
- Quando si inoculano mezzi semisolidi, è importante che l’ago inoculante sia rimosso lungo la stessa linea usata per inoculare il mezzo. Un movimento a ventaglio può provocare una crescita lungo la linea di pugnalata che può portare a un’interpretazione falsamente positiva.
- Tille, P. M., & Forbes, B. A. (2014). Bailey & Microbiologia diagnostica di Scott (tredicesima edizione.). St. Louis, Missouri: Elsevier.
- Cappuccino J.G. e Sherman N. 2008. Microbiologia: A Laboratory Manual, 8a ed. Pearson Benjamin Cummings, San Francisco, CA, USA.
- vlab.amrita.edu/?sub=3&brch=73&sim=697&cnt=1
- www.asmscience.org/content/education/protocol/protocol.3658
- https://catalog.hardydiagnostics.com/cp_prod/Content/hugo/MotilityTestMedia.htm